Hidrazin
| Hidrazin | |
|---|---|
 | |
| Općenito | |
| Hemijski spoj | Hidrazin |
| Druga imena | Diamid, Diazan |
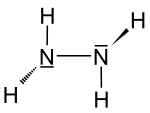
| Molekularna formula | N2H4 |
| CAS registarski broj | 302-01-2 |
| Kratki opis | bezbojna čista tekućina |
| Osobine1 | |
| Molarna masa | 32,05 g/mol |
| Agregatno stanje | tekuće |
| Gustoća | 1,01 kg/m3 pri 20°C |
| Tačka topljenja | 1,5 °C |
| Tačka ključanja | 113,5 °C |
| Pritisak pare | 21 hPa pri 20°C |
| Rastvorljivost | miješa se s vodom |
| Rizičnost | |
| NFPA 704 | |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Hidrazin je spoj dušika sa sumarnom hemijskom formulom N2H4. To je bezbojna, uljasta tekućina, mirisa sličnog amonijaku. Gori gotovo neprimjetnim plamenom. Na tržište dolazi uglavnom kao vodeni rastvor ili kao hidrazin hidrat (H2N−NH2 · H2O).
Proizvodnja[uredi | uredi izvor]
Tehnička proizvodnja[uredi | uredi izvor]
Tehnički posmatrano, postoji mnogo načina za sintezu hidrazina:[1]
- Raschigova sinteza: oksidacija amonijaka (NH3) sa natrij hipohloritom.
- Rastvor amonijaka i ioni hipohlorita burno reagiraju u hloramin i ione hidroksida.
- Pri visokom pritisku se u rastvor upumpava amonijak kao gas u velikim količinama, pri čemu se zagrijava na oko 400 K, te se odvija reakcija pri kojoj nastaje hidrazin.
- Bayerov proces: Oksidacija amonijaka sa natrij-hipohloritom preko acetona.
- Amonijak sa acetonom daje ketazin, proizvod kondenzacije jednog ketona sa hidrazinom.
- Ketazin se hidrolizira pod pritiskom od 8 do 12 bara pri temperaturi od 180 °C u hidrazin.
- Pechiney-Ugine-Kuhlmannov proces: Tehnički unaprijeđen i usavršen proces se sastoji od oksidacije amonijaka sa vodik-peroksidom (H2O2) u prisustvu metiletil ketona kao katalizatora za ketazin kao i acetamida i natrij-hidrogenfosfata kao aktivatora.
- Amonijak reagira sa ketonom dajući ketazin i vodu.
- Nastali ketazin se može kao i kod Bayerovog procesa putem hidrolize lahko prevesti u hidrazin.
- Prednosti ovog procesa u odnosu na dva prethodno spomenuta su manja potrošnja energije i nekorištenje otrovnih hlorida.
Laboratorijska proizvodnja[uredi | uredi izvor]
- Uvođenjem hlora u 20%-tni rastvor uree te kasnije dodavanje 20%-tne natron sode. Prinos reakcije iznosi oko 50%.
- Prvo se dobijaju amidni ioni putem deprotoniranja, zatim elekrofilna halogenacija amidnih iona, a potom slijedi drugo deprotoniziranje. Hlorni amidi se spontano raspadaju na acilnitrite i jedan ion hlorida. Acil nitriti se skladište do izocijanata, koji putem adicije vode prelaze u nepostojanu karbamidnu kiselinu, a koja se odmah raspada na ugljik dioksid i hidrazin. Nastali ugljik dioksid se odstranjuje putem spajanja sa natronskom sodom dajući natrij-karbonat.
- Urea, hlor i rastvor natrij-hidroksida reagiraju do hidrazina, natrij-karbonata i natrij-hlorida.
- Monohidrat se može dobiti također iz hidrazinsulfata i kalij-hidroksida, dodavanje vode i zatim destilacijom rastvora. Prinos ove reakcije, po teoriji, je 25%:
- Daljnja mogućnost pravljenja suhog hidrazina je cijepanje hidrazij-soli sa amonijakom:[2]
Osobine[uredi | uredi izvor]
Hidrazin pokazuje dinamičku viskoznost od 0,9·10−3 Pa·s. Čisti hidrazin se može pri zagrijavanju disproporcionirati eksplozivno na amonijak i dušik.
Koncentrirani rastvori su u spoju sa oksidacionim sredstvima jako eksplozivni. Hidrazin se također može uz pomoć katalizatora raspasti.
Kiselo-bazne osobine[uredi | uredi izvor]
Hidrazin je dvovalentna baza sa baznom konstantom pKb1 6,07; pKb2 = 15, mada je slabija od amonijaka pKb = 4,75. Reagira kao dvovalentna baza sa kiselinama dajući dvije vrste hidrazinij soli (ime je analogno amonijumu sa općom formulom [H2N−NH3]+X− i [H3N−NH3]2+2X−. Sa hlorovodičnom kiselinom daje hidrazinij monohlorid ([H2N−NH3]Cl) i hidrazinij dihlorid ([H3N−NH3]Cl2). Sa sumpornom kiselinom daje hidrazinij sulfat ([H3N−NH3]SO4) i dihidrazinij sulfat ([H2N-NH3]2SO4).
U prisustvu veoma jakih baza (pKb >> 0), hidrazin može djelovati također i kao kiselina. Tako putem reakcije natrij-hidrida ili natrij-amida sa hidrazinom može nastati izuzetno oksidacijski osjetljiv natrij-hidrazid, u kojem postoje hidrazid anioni (N2H3-). Nasuprot toga, reagiraju hidrazid ioni sa vodom praktično u potpunosti dajući hidroksid ione i hidrazin.
Upotreba[uredi | uredi izvor]
Gorivo[uredi | uredi izvor]

Iz razloga svojih jako reaktivnih osobina, hidrazin se upotrebljava kao raketno gorivo, koje sa oksidatorima poput didušik tetraoksidom ili dušičnom kiselinom čini hipergolnu kombinaciju goriva. Hidrazin se ne koristi samo u čistom obliku nego i u smjesi sa 1,1-dimetil hidrazinom sa naprijed navedenim oksidatorima. Poznate smjese u raznim koncentracijama oba sastojka su aerozin 50 i UH 25. Također i hidrazin posebno se koristi u korekturnim pogonima gdje se katalitički raspada.
Hidrazin se koristi kao pogonsko gorivo koje je lahko skladištiti u mnogim raketama, satelitima i svemirskim sondama. Međutim, to može dovesti i do većih opasnosti po okoliš u slučaju neuspješnog lansiranja raketa. Međutim, kada satelit odnosno raketa dođe do orbite i potroši svo gorivo, spremnici hidrazina (koji su kuglastog oblika) se odvajaju od nje te padaju kroz atmosferu. Pri tom se oni zagrijavaju a eventualno preostali hidrazin se raspada.
Kod katastrofe Challengera nije utvrđena kontaminacija hidrazinom. Nakon uspješnog slijetanja Shuttle-a, umjesto prvih sigurnosnih mjera i provjera, zaustavljeni šatl se ispituje na istjecanje hidrazina. Tek kada je ovaj test negativan, na mjesto sletanja se upućuju ostala pomoćna vozila, koja vrše njegovo hlađenje i iskrcavanje.
Hidrazin se u avio-saobraćaju koristi naprimjer kod lovca F-16 kao gorivo za pomoćne energetske agregate.[3][4]
Hidrazin služi za elektrohemijsku proizvodnju električne energije u sekundarnim ćelijama i u alkalnim gorivim ćelijama, koji se najčešće u svemirskoj tehnologiji, u podmornicama (gdje se osim toga koristi i kao intergralna komponenta sistema za spašavanje) te u drugim oblastima vojne industrije.
Redukcijsko sredstvo/Inhibitor korozije[uredi | uredi izvor]
Razrijeđeni rastvori hidrazina se koriste i kao reagensi u laboratorijama kao i za deoksigeniranje (oslobađanje od kisika) vode u bojlerima u termocentralama. Njegova upotreba se proširila i na uklanjanje ostataka kisika nakon ozračenja toplotnih sistema, za zaštitu protiv manjeg ulaska kisika u područje kondenzatora kao i za katalitičko odstranjivanje kisika iz dodatnih vodenih rezervoara. Prednost hidrazina je da se pri njegovoj reakciji stvara isključivo dušik i voda.[5] Pored deoksigeniranja, postiže se i povećanje pH-vrijednosti u sistemu voda-para.
U hemijskim sintezama, hidrazin se koristi najčešće kao jaki nukleofil (takozvani alfa-efekat) i kao redukciono sredstvo za karbonilne grupe (Wolff-Kishnerova reakcija) ili kao izvor vodika pri katalitičkoj hidrogenaciji[6].
Sigurnosna upozorenja[uredi | uredi izvor]
Hidrazin je otrovan. U pokusima na životinjama pokazao se da izaziva rak i djeluje izuzetno otrovno na vodene organizme. Hidrazin se također može apsorbirati putem kože. Najveća dopuštena tehnička koncentracija hidrazina na radnom mjestu iznosi 0,13 mg·m−3[7][8].
Reference[uredi | uredi izvor]
- ^ A.F.Holleman, E.Wiberg. Lehrbuch der Anorganischen Chemie. Walter de Gruyter & Co. Berlin 1995, 101. izdanje, ISBN 3-11-012641-9
- ^ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2. izd., vol. 1, Academic Press 1963, str. 469-72.
- ^ General Flugsicherheit in der Bundeswehr (Hrsg.): Hilfe bei Flugunfällen (izdanje 2004, PDF 2,8 MB) Arhivirano 7. 9. 2012. na Wayback Machine. izdanje 2005: str 10.
- ^ General Flugsicherheit in der Bundeswehr (Hrsg.): Hilfe bei Flugunfällen (izdanje 2007, PDF 6,4 MB)[mrtav link]. izdanje 2007: str. 10.
- ^ K. Hancke, S. Wilhelm: Wasseraufbereitung: Chemie und chemische Verfahrenstechnik. Spinger, 2003, str. 249. ISBN 3-540-06848-1
- ^ F. Zymalkokowski: Katalytische Hydrierung, Ferdinand Enke Verlag, Stuttgart 1965
- ^ "Arhivirana kopija". Arhivirano s originala, 27. 2. 2005. Pristupljeno 6. 1. 2012.CS1 održavanje: arhivirana kopija u naslovu (link)
- ^ "Arhivirana kopija". Arhivirano s originala, 5. 3. 2016. Pristupljeno 6. 1. 2012.CS1 održavanje: arhivirana kopija u naslovu (link)
| Commons ima datoteke na temu: Hidrazin |
















