Receptor (biohemija)

2. Receptori
3.Sekundarni stimulans ("glasnik")
Primjeri membranskih receptora
Receptor, u biohemiji i farmakologiji, proteinska je molekula, koja je obično ugrađena u površinu plazma membrane na površini ćelije koja prima vanjske hemijske signale. Kada su takvi signali vežu na receptor, izazivaju neki od oblika ćelijskog/tkivnog odgovora, npr. promjene u električnoj aktivnosti ćelije. U tom smislu, receptor je protein koji prepoznaje i odgovara na endogene hemijske signale, kao što acetilholinski receptor prepoznaje i reagira na svoj endogeni ligand, acetilholin. Međutim, ponekad, u farmakologiji, termin se također koristi i za druge proteine, kao što su lijekovi, enzimi, transporteri i ionski kanali.
Receptorski proteini su ugrađeni u plazmamembrana ćelija, ispoljeni kao i u ekstracelularne površine ćelije, citoplazmatski ili jedarni (nukleusni) receptori. Molekula koja se veže na receptor se naziva ligand, a može biti peptid (kratki protein) ili neka druga od malih molekula, kao što je neurotransmiter, hormon, farmaceutski lijek, toksin, ili dijelovi vnjskog virusa ili mikroba. Endogeno određena molekula za odredjeni receptor je njen endogeni ligand. Na primjer endogeni ligand za nikotinske receptore acetilholina je acetilholin, ali se receptor može aktivirati nikotinom i blokirati kurarom.[1][2][3][4]
Svaki receptor je povezan sa specifičnim ćelijskim biohemijskim putem. Iako se u većini ćelija nalaze brojni receptori, svaki od njih će se vezati samo uz ligandi određene strukture, na način na koji će brave prihvatitaju samo konkretne oblike ključeva. Kada se ligand veže za svoj odgovarajući receptor, on aktivira ili inhibira receptorski biohemijski put.
Struktura[uredi | uredi izvor]
Oblici i aktivnosti receptora se proučavaju Rendgenskom strukturnom analizom X kristalografije, dvojnom polarizacijskom interferometrijom, računarskim modeliranjem i strukturno-funkcijskim relacijama, čime se omogućava razumijevanje djelovanje lijekova, uključujući i njihove interakcije, na pozicijama njihovog vezanja za receptore. Odnosi strukture i aktivnosti objašnjavaju korelaciju induciranih konformacijskih promjena i aktivnosti biomolekula. Proučavaju se primjenom dinamičkih tehnika, kao što su cirkularni dihroizam i dualna polarizacijska interferometrija.
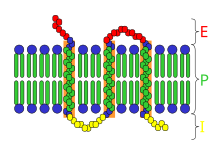
I = intracelularni prostor;
P = plazma ćelijska membrane
Strukture receptora su vrlo raznolike i mogu se svrstati u šire kategorije.
- Tip 1: L (jonotropski receptori ili membranski receptori) su obično mete brzih neurotransmitera poput acetilholina (nikotinskog) i GABA, a aktiviranje ovih receptora rezultira u promjenama kretanja jona kroz membranu. Imaju heterogene strukture. Svaka podjedinica sadrži ekstracelularnu ligand-obavezujuću i itransmembransku domenu, koja se zauzvrat uključuje u četiri transmembranska alfa heliksa. Ligand vezujući prostori se nalaze na granici između podjedinica.
- Tip 2: Receptori u sprezi sa G proteinima (metabotropni) ili hormonski receptori, neurotransmiterski receptori, su transmembranski proteini i najveća su porodica receptora. Uključuju receptore za nekoliko hormona i sporih odašiljača, kso što je dopamin, metabotropni glutamat. Oni se sastoje od sedam transmembranskih alfa heliksa. Alfa heliksi formiraju ekstracelularne i intracelularnr domene. Većina veeza za veće peptidne ligande se obično nalazi u ekstracelularnom domenu, dok je obavezujuće mjesto za manje nepeptidske ligande obično između sedam alfa heliksia i jedne ekstracelularne petlje.
- Tip 3: Receptori vezani ili srodni kinazi, enzimski receptori, su građeni od vanćelijske domene koja sadrži vezujućie ligande i unutarćelijske domene, često sa enzimskom funkcijom, vezanom preko jednnostrukog transmembranakog alfa heliksa, tj. insulinskog receptora. tor.
- Tip 4: Jedarni receptori, unatoč tom nazivu nalaze se u citosolu i, nakon vezanja sa odgovarajućim ligandom, migriraju ka nukleusu. Sastoje se od regije vezivanje C-terminalnog liganda, srži DNK-vezujuće domene (DBD) i N-terminalne domene koja sadrži AF1 (funkciju aktivacije 1) regiju. U ključnoj regiji ima dva cinkova „prsta“, koji su odgovorni za prepoznavanje specifične DNK sekvence za ovaj receptor. N-terminal nezavisno komunicira s drugim faktorima ćelijske transkripcije liganda i, ovisno o tim interakcijama, može alternirati vezivanje ili aktivnost receptora. Primjeri takvih receptora su steroidi i hormoni štitnjače.[5]
Vezanje liganda stabilizira određenu konformacijsku promjenu proteinskih receptora (tro-dimenzionalni oblik receptora, bez promjene u primarnoj strukturi proteinskih sekvenci. To je često povezano sa poprimanjem ili gubitkom proteinske aktivnosti, što obično dovodi do neke vrste ćelijskog odgovora ili samo blokade receptora, bez izazivanja odgovora. Ligand-inducirane promjene u receptorima rezultiraju promjename u ćelijskim aktivnostima, uključujući i biološku aktivnost liganda. Mnoge funkcije našeg tijela su regulirane jedinstvenim odgovorima receptora na specifične molekule.
Vezivanje i aktivacija[uredi | uredi izvor]
Vezivanje liganda je ravnotežni proces. Ligandi se vezuju za receptore i od njih disociraju po načelima zakona o dejstvu masa.
- (zagrade označavaju koncentracije)
Jedan od pokazatelja komplementarnosti liganda i receptora je afinitet vezivanja, koji je u inverznoj relaciji sa konstantom disocijacije Kd. Uspješno uklapanje koincidicira sa visokim afinitetom i niskim Kd vrijednostima. Krajnji biološki odgovor (npr. kaskada sekundarnih glasnika ili mišićna kontrakcija), se postiže samo nakon aktivacije značajnog broja receptora. Afinitet vezivanja liganda se može proučavati primjenom statističke mehanike [6]. Afinitet u vezi receptor-ligand je poput afiniteta enzim – supstrat. Dokle su oba tipa interakcije specifična i reverzibilna, ne dolazi do hemijske modifikacije vezanog liganda (za receptor), za razliku od supstrata nakon vezivanja za enzim. Ako postoji dva stanja receptora,[7] onda vezivanje liganda mora doprinijeti diferencijaciji tih stanja. O aktivacijskim mehanizmima ta dva stanja, u literaturi su raširene detaljne rasprave,[8]
Konstitucijska aktivnost[uredi | uredi izvor]
Konstitutivno je aktivan receptor koji može producirati svoj biološki odgovor u odsustvu vezanog liganda.[9] Ta aktivnost receptora može biti blokirana vezivanjem inverznog agoniste. Mutacijereceptora koje uvjetuju povećanje konstitucijske aktivnosti mogu uzrokovati neke nasljedne bolesti, kao što su prijevremeni pubertet (usljed mutacija|mutacije]] u genima za luteinizirajući hormon (LH), luteinizirajuće hormonske receptore i hipertiroidizam (usljed [[Genske mutacije na tiroidno-stimulirajućim hormonima i njihovim receptorima.
Reference[uredi | uredi izvor]
- ^ Collado-Vides J., Magasanik B., Smith T. F., Eds (1996): Integrative approaches to molecular biology. The MIT Press, Cambridge (Mass), London, ISBN 0-262-03239-2.
- ^ Hadžiselimović R., Pojskić N. (2005): Uvod u humanu imunogenetiku. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-3-4.
- ^ Lawrence E. (1999): Henderson's Dictionary of biological terms. Longman Group Ltd., London, ISBN 0-582-22708-9.
- ^ Alberts B. et al. (1983: Molecular biology of the cell. Garland Publishing, Inc., New York & London, ISBN 0-8240-7283-9.
- ^ Rang H. P., Dale M, M., Ritter J. M, Flower R. J., Henderson G. (2012): Pharmacology, 7th edition. Elsevier Churchill. Livingstone, ISBN 978-0-7020-3471-8.
- ^ Vu-Quoc L. (2008): Configuration integral statistical mechanics.http://clesm.mae.ufl.edu/wiki.pub/index.php/Configuration_integral_%28statistical_mechanics%29
- ^ [1]
- ^ [2]
- ^ Milligan G. (2003): Constitutive activity and inverse agonists of G protein-coupled receptors: a current perspective. Mol. Pharmacol., 64 (6): 1271–6.
Također pogledajte[uredi | uredi izvor]
Vanjski linkovi[uredi | uredi izvor]
- IUPHAR GPCR baza podataka i kompendijum jonkih kanala Arhivirano 23. 3. 2019. na Wayback Machine
- Receptom ljudske plasma membrane
- Cell surface receptors na US National Library of Medicine Medical Subject Headings (MeSH)

![{\displaystyle \left[\mathrm {Ligand} \right]\cdot \left[\mathrm {Receptor} \right]\;\;{\overset {K_{d}}{\rightleftharpoons }}\;\;\left[{\mbox{Ligand-receptor complex}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5431cbae57c83df32ebb7cf4c3aa839c097854df)