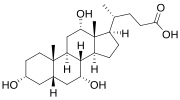
Žučna kiselina
Žučne kiseline su steroidne kiseline koje se pretežno nalaze u žuči sisara i drugih kičmenjaka. U jetri se sintetiziraju različite žučne kiseline.[1] Žučne kiseline su konjugirane sa taurinskim ili glicinskim ostacima dajući anione zvane žučne soli.[2][3][4]
Primarne žučne kiselinesu one koje sintetizira jetra. Sekundarne žučne kiseline rezultat su djelovanja bakterija u debelom crijevu. Kod ljudi, tauroholna i glikoholna kiselina (derivati holne kiseline), taurohenodeoksiholna i glikohenodeoksiholna kiselina (derivati henodeoksiholne kiseline) su glavne žučne soli. Otprilike su jednake koncentracije.[5] Pronađene su i soli njihovih 7-alfa-dehidroksiliranih derivata, dezoksiholna i litoholna kiselina, a derivati holne, henodeoksiholne i deoksiholne kiseline čine više od 90% žučnih kiselina u žuči ljudi.[5]
Žučne kiseline sadrže oko 80% organskih spojeva u žuči (drugi su fosfolipidi i holesterol.[5] Povećano lučenje žučnih kiselina dovodi do povećanja protoka žuči. Žučne kiseline olakšavaju probavu hranjivihih masti i ulja. Suže kao micele – formirajući tenzide, koji inkapsuliraju hranjive sastojke, olakšavajući njihovu apsorpciju.[6] Ove micele suspenduju se u himusu, prije dalje prerade. Žučne kiseline također djeluju hormonski u tijelu, posebno preko farnesoidnih X receptora i GPBAR1 (poznat i kao TGR5).[7]

Proizvodnja[uredi | uredi izvor]
Sinteza žučne kiseline odvija se u ćelijama jetre, koje sintetiziraju primarne žučne kiseline (holna i henodeoksiholna kiselina kod ljudi, putem citohromom P450 posredovane oksidacije holesterola, u više koraka. Dnevno se sintetizira otprilike 600 mg žučnih soli, kako bi nadomjestilo žučne kiseline izgubljene u fecesu, iako se, kako je opisano u nastavku, izlučuju mnogo veće količine, koje se ponovo apsorbiraju u crijevima i recikliraju. Korak ograničavanja brzine u sintezi je dodavanje hidroksilne grupe na 7. položaju steroidne jezgre enzimom holesterol 7 alfa-hidroksilaza. Ovaj enzim dolje regulira holna kiselina, a gornji holesterol inhibira se djelovanjem ileumskog hormona FGF15/19.[2][3]
Prije izlučivanja bilo koje žučne kiseline (primarne ili sekundarne, vidi dolje), ćelije jetre ih konjugiraju ili sa glicinom ili taurinom, dajući ukupno osam mogućih konjugiranih žučnih kiselina. Ove konjugirane žučne kiseline često se označavaju kao žučne soli. pKa nekonjugiranih žučnih kiselina je između 5 i 6,5,[4], a pH duodenuma kreće se između 3 i 5, pa kada su nekonjugirane žučne kiseline tu gotovo uvijek protonirana (oblik HA), što ih čini relativno netopivima u vodi. Konjugacija žučnih kiselina sa aminokiselinama snižava pKa konjugata žuč-kiselina / aminokiselina na između 1 i 4. Tako su konjugirane žučne kiseline u duodenumu gotovo uvijek u svom deprotoniranom (A–) obliku, što ih čini mnogo više topivim u vodi i mnogo sposobnijim da ispune svoju fiziološku funkciju emulgiranja masti.[8][9]
Izlučene u lumen crijeva, žučne soli modificiraju crijevne bakterije. Djelomično su dehidroksilirane. Njihove glicinske i taurinske grupe uklanjaju se, dajući sekundarne žučne kiseline, dezoksiholnu i litoholnu kiselinu. Holna pretvara se u dezoksiholnu kiselinu, a henodeoksiholna u litoholnu kiselinu. Sve četiri žučne kiseline reciklirane su, u procesu poznatom kao enterohepatska cirkulacija.[2][3]
Funkcije[uredi | uredi izvor]
Kao amfipatijske molekule sa hidrofobnim i hidrofilnim regionima, konjugirane žučne soli nalaze se na granici lipida/vode i u pravoj koncentraciji formiraju micele. Dodatna topivost konjugiranih žučnih soli pomaže njihovoj funkciji, sprečavanjem pasivne ponovne apsorpcije u tankom crijevu. Kao rezultat, koncentracija žučnih kiselina / soli u tankom crijevu je dovoljno visoka da tvore micele i otapaju lipide. "Kritična koncentracija micela" odnosi se, kako na svojstveno svojstvo same žučne kiseline, tako i na količinu žučne kiseline neophodne za funkcioniranje u spontanom i dinamičnom stvaranju micela.[9] Micele koje sadrže žučnu kiselinu pomažu lipazama za probavu lipida i njihovo približavanje membrani crijevne četkaste granice, što rezultira apsorpcijom masti.
Sinteza žučnih kiselina glavni je put metabolizma holesterola u većini vrsta, osim u ljudi. Tijelo proizvodi oko 800 mg holesterola dnevno, a oko polovine od toga koristi se za sintezu žučnih kiselina, proizvodeći 400–600 mg dnevno. Odrasli ljudi svakodnevno izlučuju između 12–18 g žučnih kiselina u crijeva, uglavnom nakon obroka. Veličina bazena žučnih kiselina je između 4-6 g, što znači da se žučne kiseline recikliraju nekoliko puta dnevno. Otprilike 95% žučnih kiselina se ponovo apsorbira aktivnim transportom u ileumu i reciklira natrag u jetru radi daljeg lučenja u žučni sistem i žučnu kesu. Ova enterohepatična cirkulacija žučnih kiselina omogućava nisku brzinu sinteze, samo oko 0,3 g/dan, ali s velikim količinama koje se izlučuju u crijevo.[5].[5]
Žučne kiseline imaju i druge funkcije, uključujući uklanjanje holesterola iz tijela, podsticanje protoka žuči da bi se eliminirali određeni kataboliti (uključujući bilirubin), emulgiranje vitamina topivih u mastima, kako bi se omogućila njihova apsorpcija, te pomoć u pokretljivosti i smanjenju količine bakterija u tankom crijevu i žučnom traktu.[5]
Žučne kiseline imaju metaboličke akcije u tijelu nalik djelovanju hormona, djelujući preko dva specifična receptora: farnesoidni X-receptor i G-protein-spregnuti receptor žučne kiseline / TGR5.[7][10] Oni se manje specifično vežu za neke druge receptore, a zabilježeno je i da regulišu aktivnost određenih enzima[11] and ion channels [12] i sinteze različitih supstanci, uključujući endogene masne kiseline etanolamida.[13] [14]
Struktura i sinteza[uredi | uredi izvor]
- Stukture glavnih ljudskih žučnih kiselina
Žučne soli čine veliku porodicu molekula, sastavljenih od steroidne strukture s četiri prstena, bočnim lancem od pet ili osam ugljika, koji završava karboksilnom kiselinom i nekoliko hidroksilnih grupa čiji se broj i orijentacija razlikuje od specifične žućne soli.[1] Četiri prstena su označena A, B, C i D, od najudaljenijeg do najbližeg bočnom lancu s karboksilnom skupinom. D-prsten je za jedan ugljik manji od ostala tri. Struktura se obično crta s A lijevo i D desno. Hidroksilne grupe mogu biti u bilo kojoj od dvije konfiguracije: bilo gore (ili van), nazvane beta (β; često se povlače konvencionalno kao puna linija), ili dolje, nazvane alfa (α; prikazuju se kao isprekidana linija). Sve žučne kiseline imaju 3-hidroksilnu grupu, izvedenu iz matične molekule, holesterola, u kojoj je 3-hidroksil beta.[1]

Početni korak u klasičnom putu jetarske sinteze žučnih kiselina je enzimski dodatak 7α hidroksilne grupe pomoću holesterolne 7α-hidroksilaze (CYP7A1), formirajući 7α-hidroksiholesterol. To se zatim metabolira u 7α-hidroksi-4-holesten-3-on. U sintezi žučne kiseline postoji više koraka, za koje je potrebno ukupno 14 enzima.[3] Oni rezultiraju promjenom spoja između prva dva steroidna prstena (A i B), čineći molekulu savijenim; u ovom procesu 3-hidroksil se pretvara u α orijentaciju. Najjednostavnija žučna kiselina, sa 24 ugljika, ima dvije hidroksilne grupe, na položajima 3α i 7α. To je 3α, 7α-dihidroksi-5β-holan-24-ojsna kiselina ili, kao što je uobičajenije poznato, henodeoksiholna kiselina. Ova žučna kiselina prvo je izolirana iz domaće guske, odakle je izveden i heno dio imena (grč.: χήν = guska). 5β u nazivu označava orijentaciju spoja između prstenova A i B steroidnog jezgra (u ovom slučaju su savijeni). Izraz "holan" označava određenu steroidnu strukturu od 24 ugljika, a "24-ojsna kiselina" ukazuje da se karboksilna kiselina nalazi na položaju 24, na kraju bočnog lanca. Henodeoksiholnu kiselinu proizvode mnoge vrste i ona je prototipska funkcijska žučna kiselina.[2][3]
Alternativni (kiselinski) put sinteze žučne kiseline pokreće mitohondrijska sterol 27-hidroksilaza (CYP27A1), eksprimirana u jetri, a također i u makrofagima i drugim tkivima. CYP27A1 značajno doprinosi ukupnoj sintezi žučnih kiselina, katalizirajući oksidaciju bočnog lanca sterola, nakon čega cijepanje jedinice od tri ugljika u peroksisomima dovodi do stvaranja žučne kiseline C24. Manji putevi pokrenuti 25-hidroksilazom u jetri i 24-hidroksilazom u mozgu također mogu doprinijeti sintezi žučnih kiselina. 7α-hidroksilaza (CYP7B1) generira oksisterole, koji se u jetri mogu dalje pretvoriti u CDCA.[2][3]
Holna kiselina, 3α, 7α, 12α-trihidroksi-5β-holan-24-ojna kiselina, najzastupljenija žučna kiselina kod ljudi i mnogih drugih vrsta, otkrivena je prije henodeoksiholne kiseline. To je tri-hidroksi-žučna kiselina sa 3 hidroksilne grupe (3α, 7α i 12α). U njenoj sintezi u jetri, 12α hidroksilacija se odvija dodatnim dejstvom CYP8B1. Kao što je to već bilo opisano, otkriće henodeoksholne kiseline (sa dvije hidroksilne grupe) učinilo je od ove nove žučne kiseline "dezoksiholnu kiselinu", jer je imala jednu hidroksilnu grupu manje od holske kiseline.[2][3]
Dezoksiholna kiselina nastaje iz holne kiseline, 7-dehidroksilacijom, što rezultira u dvije hidroksilne grupe (3α i 12α). Ovaj postupak s henodeoksiholnom kiselinom rezultira žučnom kiselinom sa samo 3α hidroksilnom grupom, koja se naziva litoholna kiselina (lito = kamen), a koja je prvo identificirana u žučnom kamenu teleta. Slabo je topiva u vodi i prilično je toksična za ćelije.[2][3]
Različite porodice kičmenjaka evoluirale su da koriste modifikacije većine položaja na steroidnom jezgru i bočnom lancu strukture žučnih kiselina. Da bi se izbjegli problemi povezani s proizvodnjom litoholne kiseline, većina vrsta ima treću hidroksilnu grupu u henodeoksiholnoj kiselini. Naknadno uklanjanje 7α hidroksilne grupe crijevnim bakterijama rezultirat će manje toksičnom, ali još uvijek funkcionalnom dihidroksi žučnom kiselinom. Tokom evolucije kičmenjaka, odabran je niz položaja za smještanje treće hidroksilne grupe. U početku je favoriziran položaj 16α, posebno kod ptica. Kasnije je ovaj položaj zamijenjen kod velikog broja vrsta selekcijom položaja 12α. Primati (uključujući ljude) imaju 12α kao svoj treći položaj hidroksilne grupe, proizvodeći holnu kiselinu. Kod miševa i ostalih glodara, 6β hidroksilacija formira muriholinsku kiseline (α ili β, ovisno o položaju 7 hidroksila). Svinje imaju 6α hidroksilaciju u hioholnoj kiselini (3α, 6α, 7α-trihidroksi-5β-holanska kiselina), a ostale vrste imaju hidroksilnu grupu na položaju 23 bočnog lanca. Ursodezoksiholna kiselina prvi je put izolovana iz medvjeđe žuči, koja se medicinski koristi stoljećima. Njena struktura podsjeća na henodeoksiholnu kiselinu, ali sa 7-hidroksilnom grupom u položaju β.[1]
Obetiholna kiselina, 6α-etil-hendodeoksiholna kiselina, je polusintetska žučna kiselina sa većom aktivnošću, kao FXR agonist, a koja je u fazi ispitivanja kao farmaceutsko sredstvo.
Hormonske aktivnosti[uredi | uredi izvor]
Žučne kiseline djeluju i kao steroidni hormoni koji se izlučuju iz jetre, apsorbiraju iz crijeva i imaju različita direktna metabolička djelovanja u tijelu, putem jedarnog receptora zvanog farnesoidni X-receptor (FXR), poznatog i pod imenom gena NR1H4.[15][16][17] Drugi receptor žučne kiseline je receptor ćelijske membrane, poznat kao G-protein spregnuti receptor žučne kiseline 1 ili TGR5. Mnoge od njihovih funkcija signalnih molekula u jetri i crijevima su aktiviranjem FXR, dok TGR5 može biti uključen u metaboličke, endokrine i neurološke funkcije.[7]
Regulacija sinteze[uredi | uredi izvor]
Kao surfaktanti ili deterdženti, žučne kiseline su potencijalno toksične za ćelije, pa su i njihove koncentracije strogo regulirane. Aktivacija FXR u jetri inhibira sintezu žučnih kiselina i jedan je od mehanizama povratne kontrole, kada su razine žučne kiseline previsoke. Drugo, FXR aktivacija žučnim kiselinama tokom apsorpcije u crijevima povećava transkripciju i sintezu FGF19, što zatim inhibira sintezu žučnih kiselina u jetri.[18]
Metaboličke funkcije[uredi | uredi izvor]
Novi dokazi povezuju aktivaciju FXR s promjenama u metabolizmu triglicerida metabolizmu glukoze i rastu jetre.[7][19]
Ostale interakcije[uredi | uredi izvor]
Žučne kiseline se, uz svoje hormonske receptore (FXR i TGR5) i njihove transportere, vežu i za neke druge proteine. Među tim proteinima, enzim N-acil fosfatidiletanolamin-specifična fosfolipaza D (NAPE-PLD) stvara bioaktivne lipidne amide (npr. erndogeni kanabinoid i anandamid), koji imaju važnu ulogu u nekoliko fizioloških puteva, uključujući reakcije na stres i bol, apetit i životni vijek. NAPE-PLD organizira direktnu unakrsnu razmjenu između signala lipidnih amida i fiziologije žučnih kiselina.[13]
Klinički značaj[uredi | uredi izvor]
Hiperlipidemija[uredi | uredi izvor]
Kako se žučne kiseline prave od endogenog holesterola, poremećaj enterohepatske cirkulacije žučnih kiselina smanjit će holesterol. Sekvestranti žučne kiseline vežu žučne kiseline u crijevima, sprečavajući reapsorpciju. Na taj način se više endogenog holesterola usmjerava u proizvodnju žučnih kiselina, čime se smanjuje nivo holesterola. Tako vezanne žučne kiseline se zatim izlučuju fecesom. .[20]
Holestaza[uredi | uredi izvor]
Testovi na žučne kiseline korisni su i u ljudskoj i u veterinarskoj medicini, jer pomažu u dijagnozi brojnih stanja, uključujući vrste holestaza, kao što su intrajetrena holestaza trudnoće, portosistemska zamjena i jetrena mikrovaskularna displazija kod pasa.[21] Strukturne ili funkcijske abnormalnosti žučnog sistema rezultiraju porastom bilirubina (žutica) i žučnih kiselina u krvi. Žučne kiseline povezane su sa svrabom (pruritus), koji je čest u holestatskim stanjima kao što su primarna bilijarna ciroza (PBC), primarni sklerozirajući holangitis ili intrahepatsk holestaza trudnoće.[22] Kod ovih holestatskih poremećaja primjenjuje se liječenje ursodezoksiholnom kiselinom već dugi niz godina.[23][24]
Kamenje u žuči[uredi | uredi izvor]
Odnos žučnih kiselina i zasićenja holesterola u žuči i pada holesterola za stvaranje žučnih kamenaca opsežno je proučavan. Kamen u žuči može biti rezultat povećane zasićenosti holesterolom ili bilirubina ili zastoja žuči. Niže koncentracije žučnih kiselina ili fosfolipida u žuči smanjuju rastvorljivost holesterola i dovode do stvaranja mikrokristala. Za otapanje kamenja u holesterolu korištena je oralna terapija henodezoksiholnom kiselinom i / ili ursodeoksiholnom kiselinom.[25][26][27] Nakon prekida liječenja, kamenje se može ponoviti. Terapija žučnim kiselinama može biti korisna za prevenciju kamenaca u određenim okolnostima, kao što je primjena bariatrijske hirurgije.[28]
Žučnokiselinski proljev[uredi | uredi izvor]
Prekomjerne koncentracije žučnih kiselina u debelom crijevu uzrok su hroničnog proljeva. Često nastaje kada je ileum abnormalan ili je hirurški uklonjen, kao u Crohnovoj bolesti, ili uzrokuje stanje koje liči dijareji: sindrom iritabilnog crijeva (IBS-D). Ovo stanje dijareje žučne kiseline / malapsorpcija žučne kiseline može se dijagnosticirati testom SeHCAT i liječiti sekvestrantima žučne kiseline.[29]
Žučne kiseline i rak debelog crijeva[uredi | uredi izvor]
Žučne kiseline mogu imati određeni značaj u razvoju kolorektumskog karcinoma.[30] Dezoksiholna kiselina (DCA) povećana je u sadržaju debelog crijeva kod ljudi, kao odgovor na prehranu s puno masnoća.[31] U populacijama s velikom učestalošću raka debelog creva, izmetske koncentracije žučnih kiselina su veće,[32][33] i ova povezanost sugerira da bi povećana izloženost debelog crijeva žučnim kiselinama mogla imati ulogu u razvoju karcinoma. U jednoj posebnoj usporedbi, koncentracija DCA u fekalijama u urođenika iz Južne Afrike (koji jedu hranu s niskim udjelom masti) u odnosu na Afroamerikance (koji jedu hranu sa više masti) iznosila je 7,30 naspram 37,51 nmol / g mokre stolice.[34] Afrički domoroci u Južnoj Africi imaju nisku stopu incidencije raka debelog crijeva, manju od 1:100.000,[35] u poređenju sa visokom stopom incidencije za muškarce Afroamerikance od 72:100.000.[36]
Eksperimentalne studije također sugeriraju mehanizme uticaja žučnih kiselina u raku debelog crijeva. Izlaganje ćelija debelog creva visokim koncentracijama DCA povećava stvaranje reaktivne vrste kiseika, uzrokujući oksidacijski stres, a također povećava oštećenje DNK.[37] Miševi koji su se prehranjivali dodatkom DCA koji imitira nivoe DCA u debelom crevu kod ljudi uz hranu sa visokim udjelom masti razvili su neoplazije, debelog crijeva, uključujući adenom i adenokarcinome (kancere, za razliku od miševa koji su se hranili kontrolnom hranom koja je proizvodila jednu desetinu nivoa DCA debelog crijeva, a koji nidu imali neoplaziju debelog crijeva.[38][39]
Učinci ursodezoksiholne kiseline (UDCA) na modificiranje rizika od raka debelog crijeva proučavani su u nekoliko studija, posebno pri primarnom sklerozirajućem holangitisu i upalnoj bolesti crijeva, s različitim rezultatima, djelimično povezanim s doziranjem.[40][41] U jednom opsežnom ispitivanju, nađeno je da su genetičke varijacije u ključnom enzimu za sintezu žučne kiseline, CYP7A1, uticale na efikasnost UDCA u prevenciji kolorektalnog adenoma.[42]
Dermatologija[uredi | uredi izvor]
Žučne kiseline mogu se koristiti u potkožnim injekcijama za uklanjanje neželjenih masnih kiselina (vidi mezoterapija). Dezoksiholna kiselina kao injekcija dobila je odobrenje FDA za otapanje submentne masnoće.[43] Ispitivanja faze III pokazala su značajne odgovore, iako su mnogi ispitanici imali blage neželjene reakcije modrica, otoka, bolova, utrnulosti, eritema i čvrstoće oko tretiranog područja.[44][45]
Reference[uredi | uredi izvor]
- ^ a b c d Hofmann AF, Hagey LR, Krasowski MD (februar 2010). "Bile salts of vertebrates: structural variation and possible evolutionary significance". J. Lipid Res. 51 (2): 226–46. doi:10.1194/jlr.R000042. PMC 2803226. PMID 19638645.
- ^ a b c d e f g Russell DW (2003). "The enzymes, regulation, and genetics of bile acid synthesis". Annu. Rev. Biochem. 72: 137–74. doi:10.1146/annurev.biochem.72.121801.161712. PMID 12543708.
- ^ a b c d e f g h Chiang JY (oktobar 2009). "Bile acids: regulation of synthesis". J. Lipid Res. 50 (10): 1955–66. doi:10.1194/jlr.R900010-JLR200. PMC 2739756. PMID 19346330.
- ^ a b Carey, MC.; Small, DM. (Oct 1972). "Micelle formation by bile salts. Physical-chemical and thermodynamic considerations". Arch Intern Med. 130 (4): 506–27. doi:10.1001/archinte.1972.03650040040005. PMID 4562149.
- ^ a b c d e f Hofmann AF (1999). "The continuing importance of bile acids in liver and intestinal disease". Arch. Intern. Med. 159 (22): 2647–58. doi:10.1001/archinte.159.22.2647. PMID 10597755.
- ^ Hofmann AF, Borgström B (februar 1964). "The intraluminal phase of fat digestion in man: the lipid content of the micellar and oil phases of intestinal content obtained during fat digestion and absorption". J. Clin. Invest. 43 (2): 247–57. doi:10.1172/JCI104909. PMC 289518. PMID 14162533.
- ^ a b c d Fiorucci S, Mencarelli A, Palladino G, Cipriani S (novembar 2009). "Bile-acid-activated receptors: targeting TGR5 and farnesoid-X-receptor in lipid and glucose disorders". Trends Pharmacol. Sci. 30 (11): 570–80. doi:10.1016/j.tips.2009.08.001. PMID 19758712.
- ^ 'Essentials of Medical Biochemistry, Lieberman, Marks and Smith, eds, p432, 2007'
- ^ a b Hofmann AF (oktobar 1963). "The function of bile salts in fat absorption. The solvent properties of dilute micellar solutions of conjugated bile salts". Biochem. J. 89: 57–68. doi:10.1042/bj0890057. PMC 1202272. PMID 14097367.
- ^ Li T, Chiang JY (2014). "Bile acid signaling in metabolic disease and drug therapy". Pharmacol. Rev. 66 (4): 948–83. doi:10.1124/pr.113.008201. PMC 4180336. PMID 25073467.
- ^ Nagahashi M, Takabe K, Liu R, Peng K, Wang X, Wang Y, Hait NC, Wang X, Allegood JC, Yamada A, Aoyagi T, Liang J, Pandak WM, Spiegel S, Hylemon PB, Zhou H (2015). "Conjugated bile acid-activated S1P receptor 2 is a key regulator of sphingosine kinase 2 and hepatic gene expression". Hepatology. 61 (4): 1216–26. doi:10.1002/hep.27592. PMC 4376566. PMID 25363242.
- ^ Wiemuth D, Sahin H, Falkenburger BH, Lefevre CM, Wasmuth HE, Grunder S (2012). "BASIC--a bile acid-sensitive ion channel highly expressed in bile ducts". FASEB J. 26 (10): 4122–30. doi:10.1096/fj.12-207043. PMID 22735174.
- ^ a b Magotti P, Bauer I, Igarashi M, Babagoli M, Marotta R, Piomelli D, Garau G (2015). "Structure of Human N-Acylphosphatidylethanolamine-Hydrolyzing Phospholipase D: Regulation of Fatty Acid Ethanolamide Biosynthesis by Bile Acids". Structure. 23 (3): 598–604. doi:10.1016/j.str.2014.12.018. PMC 4351732. PMID 25684574.
- ^ Margheritis, E, Castellani B, Magotti P, Peruzzi S, Romeo E, Natali F, Mostarda S, Gioiello A, Piomelli D, Garau G (2016). "Bile Acid Recognition by NAPE-PLD". ACS Chemical Biology. 11 (10): 2908–2914. doi:10.1021/acschembio.6b00624. PMC 5074845. PMID 27571266.
- ^ Makishima M, Okamoto AY, Repa JJ, et al. (maj 1999). "Identification of a nuclear receptor for bile acids". Science. 284 (5418): 1362–5. Bibcode:1999Sci...284.1362M. doi:10.1126/science.284.5418.1362. PMID 10334992.
- ^ Parks DJ, Blanchard SG, Bledsoe RK, et al. (maj 1999). "Bile acids: natural ligands for an orphan nuclear receptor". Science. 284 (5418): 1365–8. Bibcode:1999Sci...284.1365P. doi:10.1126/science.284.5418.1365. PMID 10334993.
- ^ Wang H, Chen J, Hollister K, Sowers LC, Forman BM (maj 1999). "Endogenous bile acids are ligands for the nuclear receptor FXR/BAR". Mol. Cell. 3 (5): 543–53. doi:10.1016/s1097-2765(00)80348-2. PMID 10360171.
- ^ Kim, I; Ahn, SH; Inagaki, T; Choi, M; Ito, S; Guo, GL; Kliewer, SA; Gonzalez, FJ (2007). "Differential regulation of bile acid homeostasis by the farnesoid X receptor in liver and intestine". Journal of Lipid Research. 48 (12): 2664–72. doi:10.1194/jlr.M700330-JLR200. PMID 17720959.
- ^ Shapiro, Hagit; Kolodziejczyk, Aleksandra A.; Halstuch, Daniel; Elinav, Eran (16. 1. 2018). "Bile acids in glucose metabolism in health and disease". Journal of Experimental Medicine (jezik: engleski). 215 (2): 383–396. doi:10.1084/jem.20171965. ISSN 0022-1007. PMC 5789421. PMID 29339445.
- ^ Davidson MH (2011). "A systematic review of bile acid sequestrant therapy in children with familial hypercholesterolemia". J Clin Lipidol. 5 (2): 76–81. doi:10.1016/j.jacl.2011.01.005. PMID 21392720.
- ^ Allen L, Stobie D, Mauldin GN, Baer KE (januar 1999). "Clinicopathologic features of dogs with hepatic microvascular dysplasia with and without portosystemic shunts: 42 cases (1991-1996)". J. Am. Vet. Med. Assoc. 214 (2): 218–20. PMID 9926012.
- ^ Pusl T, Beuers U (2007). "Intrahepatic cholestasis of pregnancy". Orphanet J Rare Dis. 2: 26. doi:10.1186/1750-1172-2-26. PMC 1891276. PMID 17535422.
- ^ Poupon RE, Balkau B, Eschwège E, Poupon R (maj 1991). "A multicenter, controlled trial of ursodiol for the treatment of primary biliary cirrhosis. UDCA-PBC Study Group". N. Engl. J. Med. 324 (22): 1548–54. doi:10.1056/NEJM199105303242204. PMID 1674105.
- ^ Glantz A, Marschall HU, Lammert F, Mattsson LA (decembar 2005). "Intrahepatic cholestasis of pregnancy: a randomized controlled trial comparing dexamethasone and ursodeoxycholic acid". Hepatology. 42 (6): 1399–405. doi:10.1002/hep.20952. PMID 16317669.
- ^ Danzinger RG, Hofmann AF, Schoenfield LJ, Thistle JL (januar 1972). "Dissolution of cholesterol gallstones by chenodeoxycholic acid". N. Engl. J. Med. 286 (1): 1–8. doi:10.1056/NEJM197201062860101. PMID 5006919.
- ^ Thistle JL, Hofmann AF (septembar 1973). "Efficacy and specificity of chenodeoxycholic acid therapy for dissolving gallstones". N. Engl. J. Med. 289 (13): 655–9. doi:10.1056/NEJM197309272891303. PMID 4580472.
- ^ Petroni ML, Jazrawi RP, Pazzi P, et al. (januar 2001). "Ursodeoxycholic acid alone or with chenodeoxycholic acid for dissolution of cholesterol gallstones: a randomized multicentre trial. The British-Italian Gallstone Study group". Aliment. Pharmacol. Ther. 15 (1): 123–8. doi:10.1046/j.1365-2036.2001.00853.x. PMID 11136285.
- ^ Uy MC, Talingdan-Te MC, Espinosa WZ, Daez ML, Ong JP (decembar 2008). "Ursodeoxycholic acid in the prevention of gallstone formation after bariatric surgery: a meta-analysis". Obes Surg. 18 (12): 1532–8. doi:10.1007/s11695-008-9587-7. PMID 18574646.
- ^ Pattni, S; Walters, JR (2009). "Recent advances in the understanding of bile acid malabsorption". British Medical Bulletin. 92: 79–93. doi:10.1093/bmb/ldp032. PMID 19900947.
- ^ Degirolamo C, Modica S, Palasciano G, Moschetta A (2011). "Bile acids and colon cancer: Solving the puzzle with nuclear receptors". Trends Mol Med. 17 (10): 564–72. doi:10.1016/j.molmed.2011.05.010. PMID 21724466.
- ^ Reddy BS, Hanson D, Mangat S, et al. (septembar 1980). "Effect of high-fat, high-beef diet and of mode of cooking of beef in the diet on fecal bacterial enzymes and fecal bile acids and neutral sterols". J. Nutr. 110 (9): 1880–7. doi:10.1093/jn/110.9.1880. PMID 7411244.
- ^ Hill MJ (maj 1990). "Bile flow and colon cancer". Mutat. Res. 238 (3): 313–20. doi:10.1016/0165-1110(90)90023-5. PMID 2188127.
- ^ Cheah PY (1990). "Hypotheses for the etiology of colorectal cancer--an overview". Nutr Cancer. 14 (1): 5–13. doi:10.1080/01635589009514073. PMID 2195469.
- ^ Ou J, DeLany JP, Zhang M, Sharma S, O'Keefe SJ (2012). "Association between low colonic short-chain fatty acids and high bile acids in high colon cancer risk populations". Nutr Cancer. 64 (1): 34–40. doi:10.1080/01635581.2012.630164. PMC 6844083. PMID 22136517.
- ^ O'Keefe SJ, Kidd M, Espitalier-Noel G, Owira P (maj 1999). "Rarity of colon cancer in Africans is associated with low animal product consumption, not fiber". Am. J. Gastroenterol. 94 (5): 1373–80. PMID 10235221.
- ^ American Cancer Society. Cancer Facts and Figures 2009. http://www.cancer.org/Research/CancerFactsFigures/cancer-facts-figures-2009 Arhivirano 13. 9. 2012. na Wayback Machine
- ^ Bernstein H, Bernstein C, Payne CM, Dvorak K (juli 2009). "Bile acids as endogenous etiologic agents in gastrointestinal cancer". World J. Gastroenterol. 15 (27): 3329–40. doi:10.3748/wjg.15.3329. PMC 2712893. PMID 19610133.
- ^ Bernstein C, Holubec H, Bhattacharyya AK, et al. (august 2011). "Carcinogenicity of deoxycholate, a secondary bile acid". Arch. Toxicol. 85 (8): 863–71. doi:10.1007/s00204-011-0648-7. PMC 3149672. PMID 21267546.
- ^ Prasad AR, Prasad S, Nguyen H, Facista A, Lewis C, Zaitlin B, Bernstein H, Bernstein C (Jul 2014). "Novel diet-related mouse model of colon cancer parallels human colon cancer". World J Gastrointest Oncol. 6 (7): 225–43. doi:10.4251/wjgo.v6.i7.225. PMC 4092339. PMID 25024814.CS1 održavanje: više imena: authors list (link)
- ^ Singh S, Khanna S, Pardi DS, Loftus EV, Talwalkar JA (2013). "Effect of ursodeoxycholic acid use on the risk of colorectal neoplasia in patients with primary sclerosing cholangitis and inflammatory bowel disease: a systematic review and meta-analysis". Inflamm. Bowel Dis. 19 (8): 1631–8. doi:10.1097/MIB.0b013e318286fa61. PMID 23665966.
- ^ Eaton JE, Silveira MG, Pardi DS, Sinakos E, Kowdley KV, Luketic VA, Harrison ME, McCashland T, Befeler AS, Harnois D, Jorgensen R, Petz J, Lindor KD (2011). "High-dose ursodeoxycholic acid is associated with the development of colorectal neoplasia in patients with ulcerative colitis and primary sclerosing cholangitis". Am. J. Gastroenterol. 106 (9): 1638–45. doi:10.1038/ajg.2011.156. PMC 3168684. PMID 21556038.
- ^ Wertheim BC, Smith JW, Fang C, Alberts DS, Lance P, Thompson PA (2012). "Risk modification of colorectal adenoma by CYP7A1 polymorphisms and the role of bile acid metabolism in carcinogenesis". Cancer Prev Res (Phila). 5 (2): 197–204. doi:10.1158/1940-6207.CAPR-11-0320. PMC 3400261. PMID 22058145.
- ^ "Deoxycholic acid injection". Medline plus. Pristupljeno 26. 8. 2015.
- ^ Ascher B, Hoffmann K, Walker P, Lippert S, Wollina U, Havlickova B (2014). "Efficacy, patient-reported outcomes and safety profile of ATX-101 (deoxycholic acid), an injectable drug for the reduction of unwanted submental fat: results from a phase III, randomized, placebo-controlled study". J Eur Acad Dermatol Venereol. 28 (12): 1707–15. doi:10.1111/jdv.12377. PMC 4263247. PMID 24605812.
- ^ Wollina U, Goldman A (2015). "ATX-101 for reduction of submental fat". Expert Opin Pharmacother. 16 (5): 755–62. doi:10.1517/14656566.2015.1019465. PMID 25724831.
Vanjski linkovi[uredi | uredi izvor]
- Bile Acids and Salts na US National Library of Medicine Medical Subject Headings (MeSH)
- Special Issue on "Bile Acids"