ACTG1
Gama-aktin je protein koji je kod ljudi kodiran genom ACTG1.[5] Gama-aktin je široko eksprimiran u ćelijskim citoskeletima mnogih tkiva; u ćelijama prugastih mišića odraslih. gama-aktin je lokaliziran na Z-disk i kostamerne strukture, koje su odgovorne za transdukciju i prenos sile u mišićnim ćelijama. Mutacije u ACTG1 povezane su sa nesindromnim gubitkom sluha i Baraitser-Winterovim sindromom, kao i podložnošću adolescentnih pacijenata toksičnosti vinkristina.
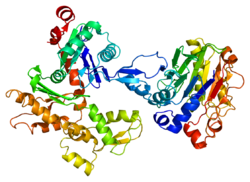
Struktura[uredi | uredi izvor]
Aminokiselimska selvenca
Dužina polipeptidnog lanca je 375 aminokiselina, a molekulska težina 41.793 Da.[6]
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MEEEIAALVI | DNGSGMCKAG | FAGDDAPRAV | FPSIVGRPRH | QGVMVGMGQK | ||||
| DSYVGDEAQS | KRGILTLKYP | IEHGIVTNWD | DMEKIWHHTF | YNELRVAPEE | ||||
| HPVLLTEAPL | NPKANREKMT | QIMFETFNTP | AMYVAIQAVL | SLYASGRTTG | ||||
| IVMDSGDGVT | HTVPIYEGYA | LPHAILRLDL | AGRDLTDYLM | KILTERGYSF | ||||
| TTTAEREIVR | DIKEKLCYVA | LDFEQEMATA | ASSSSLEKSY | ELPDGQVITI | ||||
| GNERFRCPEA | LFQPSFLGME | SCGIHETTFN | SIMKCDVDIR | KDLYANTVLS | ||||
| GGTTMYPGIA | DRMQKEITAL | APSTMKIKII | APPERKYSVW | IGGSILASLS | ||||
| TFQQMWISKQ | EYDESGPSIV | HRKCF |
- Simboli
C: Cistein
D: Asparaginska kiselina
E: Glutaminska kiselina
F: Fenilalanin
G: Glicin
H: Histidin
I: Izoleucin
K: Lizin
L: Leucin
M: Metionin
N: Asparagin
P: Prolin
Q: Glutamin
R: Arginin
S: Serin
T: Treonin
V: Valin
W: Triptofan
Y: Tirozin
Aktini su visoko konzervirani proteini koji sudjeluju u različitim tipovima pokretljivosti ćelija i održavanju citoskeleta. U kičmenjaka identificirane su tri glavne grupe aktintinskih izoformi, alfa, beta i gama.[7]
Alfa aktini nalaze se u mišićnim tkivima i glavni su sastojak kontraktilnog aparata sarkomera. Beta i gama aktini koegzistiraju u većini tipova ćelija kao komponente citoskeleta i kao posrednici unutrašnje ćelijske pokretljivosti. Aktin gama 1, kodiran ovim genom, nalazi se u u citoplazmi mišićnih ćelija i u mišićnim ćelijama na kostamernim strukturama ili u poprečnim tačkama adhezije ćelijsa–ćelija koje idu okomito na dugu os miocita.[8][9][10]
Funkcija[uredi | uredi izvor]
U miocitima, sarkomere se pridržavaju sarkolemaama putem kostamera, koje se poravnavaju na Z-diskovima i M-linijama.[11] Dvije primarne citoskeletne komponente kostamera su dezmin, srednji filament i gama-aktinski mikrofilamenti.[12] Pokazalo se da je gama-aktin u interakciji sa drugim kostamernim proteinom, distrofinom presudan za kostamerno formiranje mehanički jakih veza između citoskeleta i sarkolema i membrana.[13][14] Dodatne studije pokazale su da se gama-aktin kolokalira sa alfa-aktininom i GFP - označenim gama aktinom lokalizovanim na Z-diskovima , dok je GFP - alfa-aktin na šiljastim krajevima tankih filamenata, što ukazuje da se gama aktin specifično lokalizuje na Z-diskovima u prugastim mišićnim ćelijama.[15][16][17]
Smatra se da tokom razvoja miocita, gama-aktin ima ulogu u organizaciji razvijanja i sastavljanju razvijanja sarkomera, što se dijelom dokazuje i njegovom ranom kolokalizacijom sa alfa-aktininom.[18] Gama-aktin se na kraju zamjenjuje izoformama sarkomernog alfa-aktina,[19][20][21] sa niskim nivoima gama-aktina koji perzistiraju u miocitima odraslih koji se povezuju sa Z-diskovima i kostamernim domenima.[15][22][23]
Bolji uvid u funkciju gama-aktina u mišićima proizašao je iz studija koje koriste transgenezu. U skeletnomišićnom specifičnom gama-aktinu kod nokaut-miševa, ove životinje nisu pokazale uočljive abnormalnosti u razvoju; međutim, nokaut-miševi pokazali su slabost mišićnih vlakana i nekrozu, zajedno sa smanjenom izometrijskom silom trzanja, poremećene intrafibrilske i interfibrilske veze između miocita i miopatija .[24]
Klinički značaj[uredi | uredi izvor]
U pacijenata sa oštećenjem sluha identificirana je autosomno dominantna mutacija u ACTG1 u lokusu DFNA20/ 26 na 17q25-qter. Mutacija Thr 278 Ile identificirana je u proteinskom heliksu 9 gama-aktina, za koji se predviđa da će promeniti strukturu proteina. Ova studija identificirala je prvu bolest koja uzrokuje mutaciju gama-aktina i podvlači važnost gama-aktina kao strukturnih elemenata u trepljstim ćelijama unutrašnjeg uha.[25] Od tada su i druge ACTG1 mutacije povezane sa nesindromnim oštećenjem sluha, uključujući Met 305 Thr.[26]
Misens mutacije u ACTG1 na Ser 155 Phe također je identifikovana kod pacijenata sa Baraitser-Winterovim sindromom, što je poremećaj u razvoju koji karakteriše urođena ptoza, prekomjerno zasvođene obrve, hipertelorizam, okularni kolobom, lizencefalija, nizak rast, napadi i gubitak sluha.[27][28]
Diferencijalna ekspresija ACTG1-ove iRNK također je identifikovana kod pacijenata sa sporadičnom amiotrofnom lateralnom sklerozom, razarajućom bolešću sa nepoznatom uzročnošću, koristeći sofisticirani bioinformatički pristup koji koristi Affymetrix dugooligonukleotidnog BaFL metoda.[29]
Jednonukleotidni polimorfizmi u ACTG povezani su s toksičnošću vinkristina, što je dio standardnog režima liječenja za djetinjstvenu akutne limfoblastne leukemije. Neurotoksičnost bila je češća kod pacijenata koji su bili nositelji mutacije ACTG1 u sekvenci Gly 310 Ala, što sugerira da ovo može imati ulogu u ishodima pacijenta oliječenih vinkristinom.[30]
Interakcije[uredi | uredi izvor]
Dokazano je da ACTG1 komunicira sa:
Također pogledajte[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ a b c GRCh38: Ensembl release 89: ENSG00000184009 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000062825 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Entrez Gene: ACTG1 actin, gamma 1".
- ^ "UniProt, P63261". Pristupljeno 25. 6. 2021.
- ^ Rubenstein PA (Jul 1990). "The functional importance of multiple actin isoforms". BioEssays. 12 (7): 309–15. doi:10.1002/bies.950120702. PMID 2203335. S2CID 2163289.
- ^ Craig SW, Pardo JV (1983). "Gamma actin, spectrin, and intermediate filament proteins colocalize with vinculin at costameres, myofibril-to-sarcolemma attachment sites". Cell Motility. 3 (5–6): 449–62. doi:10.1002/cm.970030513. PMID 6420066.
- ^ Pardo JV, Siliciano JD, Craig SW (Feb 1983). "A vinculin-containing cortical lattice in skeletal muscle: transverse lattice elements ("costameres") mark sites of attachment between myofibrils and sarcolemma". Proceedings of the National Academy of Sciences of the United States of America. 80 (4): 1008–12. Bibcode:1983PNAS...80.1008P. doi:10.1073/pnas.80.4.1008. PMC 393517. PMID 6405378.
- ^ Danowski BA, Imanaka-Yoshida K, Sanger JM, Sanger JW (Sep 1992). "Costameres are sites of force transmission to the substratum in adult rat cardiomyocytes". The Journal of Cell Biology. 118 (6): 1411–20. doi:10.1083/jcb.118.6.1411. PMC 2289604. PMID 1522115.
- ^ Clark KA, McElhinny AS, Beckerle MC, Gregorio CC (2002). "Striated muscle cytoarchitecture: an intricate web of form and function". Annual Review of Cell and Developmental Biology. 18: 637–706. doi:10.1146/annurev.cellbio.18.012502.105840. PMID 12142273.
- ^ Kee AJ, Gunning PW, Hardeman EC (2009). "Diverse roles of the actin cytoskeleton in striated muscle". Journal of Muscle Research and Cell Motility. 30 (5–6): 187–97. doi:10.1007/s10974-009-9193-x. PMID 19997772. S2CID 6632615.
- ^ a b Rybakova IN, Patel JR, Ervasti JM (Sep 2000). "The dystrophin complex forms a mechanically strong link between the sarcolemma and costameric actin". The Journal of Cell Biology. 150 (5): 1209–14. doi:10.1083/jcb.150.5.1209. PMC 2175263. PMID 10974007.
- ^ Ervasti JM (Apr 2003). "Costameres: the Achilles' heel of Herculean muscle". The Journal of Biological Chemistry. 278 (16): 13591–4. doi:10.1074/jbc.R200021200. PMID 12556452.
- ^ a b Nakata T, Nishina Y, Yorifuji H (Aug 2001). "Cytoplasmic gamma actin as a Z-disc protein". Biochemical and Biophysical Research Communications. 286 (1): 156–63. doi:10.1006/bbrc.2001.5353. PMID 11485322.
- ^ Papponen H, Kaisto T, Leinonen S, Kaakinen M, Metsikkö K (Jan 2009). "Evidence for gamma-actin as a Z disc component in skeletal myofibers". Experimental Cell Research. 315 (2): 218–25. doi:10.1016/j.yexcr.2008.10.021. PMID 19013151.
- ^ Vlahovich N, Kee AJ, Van der Poel C, Kettle E, Hernandez-Deviez D, Lucas C, Lynch GS, Parton RG, Gunning PW, Hardeman EC (Jan 2009). "Cytoskeletal tropomyosin Tm5NM1 is required for normal excitation-contraction coupling in skeletal muscle". Molecular Biology of the Cell. 20 (1): 400–9. doi:10.1091/mbc.E08-06-0616. PMC 2613127. PMID 19005216.
- ^ Lloyd CM, Berendse M, Lloyd DG, Schevzov G, Grounds MD (Jul 2004). "A novel role for non-muscle gamma-actin in skeletal muscle sarcomere assembly". Experimental Cell Research. 297 (1): 82–96. doi:10.1016/j.yexcr.2004.02.012. PMID 15194427.
- ^ Schwartz RJ, Rothblum KN (Jul 1981). "Gene switching in myogenesis: differential expression of the chicken actin multigene family". Biochemistry. 20 (14): 4122–9. doi:10.1021/bi00517a027. PMID 7284314.
- ^ Shani M, Zevin-Sonkin D, Saxel O, Carmon Y, Katcoff D, Nudel U, Yaffe D (Sep 1981). "The correlation between the synthesis of skeletal muscle actin, myosin heavy chain, and myosin light chain and the accumulation of corresponding mRNA sequences during myogenesis". Developmental Biology. 86 (2): 483–92. doi:10.1016/0012-1606(81)90206-2. PMID 7286410.
- ^ von Arx P, Bantle S, Soldati T, Perriard JC (Dec 1995). "Dominant negative effect of cytoplasmic actin isoproteins on cardiomyocyte cytoarchitecture and function". The Journal of Cell Biology. 131 (6 Pt 2): 1759–73. doi:10.1083/jcb.131.6.1759. PMC 2120671. PMID 8557743.
- ^ Hanft LM, Bogan DJ, Mayer U, Kaufman SJ, Kornegay JN, Ervasti JM (Jul 2007). "Cytoplasmic gamma-actin expression in diverse animal models of muscular dystrophy". Neuromuscular Disorders. 17 (7): 569–74. doi:10.1016/j.nmd.2007.03.004. PMC 1993539. PMID 17475492.
- ^ Kee AJ, Schevzov G, Nair-Shalliker V, Robinson CS, Vrhovski B, Ghoddusi M, Qiu MR, Lin JJ, Weinberger R, Gunning PW, Hardeman EC (Aug 2004). "Sorting of a nonmuscle tropomyosin to a novel cytoskeletal compartment in skeletal muscle results in muscular dystrophy". The Journal of Cell Biology. 166 (5): 685–96. doi:10.1083/jcb.200406181. PMC 2172434. PMID 15337777.
- ^ Sonnemann KJ, Fitzsimons DP, Patel JR, Liu Y, Schneider MF, Moss RL, Ervasti JM (Sep 2006). "Cytoplasmic gamma-actin is not required for skeletal muscle development but its absence leads to a progressive myopathy". Developmental Cell. 11 (3): 387–97. doi:10.1016/j.devcel.2006.07.001. PMID 16950128.
- ^ van Wijk E, Krieger E, Kemperman MH, De Leenheer EM, Huygen PL, Cremers CW, Cremers FP, Kremer H (Dec 2003). "A mutation in the gamma actin 1 (ACTG1) gene causes autosomal dominant hearing loss (DFNA20/26)". Journal of Medical Genetics. 40 (12): 879–84. doi:10.1136/jmg.40.12.879. PMC 1735337. PMID 14684684.
- ^ Park G, Gim J, Kim AR, Han KH, Kim HS, Oh SH, Park T, Park WY, Choi BY (18. 3. 2013). "Multiphasic analysis of whole exome sequencing data identifies a novel mutation of ACTG1 in a nonsyndromic hearing loss family". BMC Genomics. 14: 191. doi:10.1186/1471-2164-14-191. PMC 3608096. PMID 23506231.
- ^ Rivière JB, van Bon BW, Hoischen A, Kholmanskikh SS, O'Roak BJ, Gilissen C, Gijsen S, Sullivan CT, Christian SL, Abdul-Rahman OA, Atkin JF, Chassaing N, Drouin-Garraud V, Fry AE, Fryns JP, Gripp KW, Kempers M, Kleefstra T, Mancini GM, Nowaczyk MJ, van Ravenswaaij-Arts CM, Roscioli T, Marble M, Rosenfeld JA, Siu VM, de Vries BB, Shendure J, Verloes A, Veltman JA, Brunner HG, Ross ME, Pilz DT, Dobyns WB (Apr 2012). "De novo mutations in the actin genes ACTB and ACTG1 cause Baraitser-Winter syndrome". Nature Genetics. 44 (4): 440–4, S1–2. doi:10.1038/ng.1091. PMC 3677859. PMID 22366783.
- ^ Di Donato N, Rump A, Koenig R, Der Kaloustian VM, Halal F, Sonntag K, Krause C, Hackmann K, Hahn G, Schrock E, Verloes A (Feb 2014). "Severe forms of Baraitser-Winter syndrome are caused by ACTB mutations rather than ACTG1 mutations". European Journal of Human Genetics. 22 (2): 179–83. doi:10.1038/ejhg.2013.130. PMC 3895648. PMID 23756437.
- ^ Baciu C, Thompson KJ, Mougeot JL, Brooks BR, Weller JW (24. 9. 2012). "The LO-BaFL method and ALS microarray expression analysis". BMC Bioinformatics. 13: 244. doi:10.1186/1471-2105-13-244. PMC 3526454. PMID 23006766.
- ^ Ceppi F, Langlois-Pelletier C, Gagné V, Rousseau J, Ciolino C, De Lorenzo S, Kevin KM, Cijov D, Sallan SE, Silverman LB, Neuberg D, Kutok JL, Sinnett D, Laverdière C, Krajinovic M (Jun 2014). "Polymorphisms of the vincristine pathway and response to treatment in children with childhood acute lymphoblastic leukemia". Pharmacogenomics. 15 (8): 1105–16. doi:10.2217/pgs.14.68. PMC 4443746. PMID 25084203.
- ^ Hubberstey A, Yu G, Loewith R, Lakusta C, Young D (Jun 1996). "Mammalian CAP interacts with CAP, CAP2, and actin". Journal of Cellular Biochemistry. 61 (3): 459–66. doi:10.1002/(SICI)1097-4644(19960601)61:3<459::AID-JCB13>3.0.CO;2-E. PMID 8761950.
- ^ Hertzog M, van Heijenoort C, Didry D, Gaudier M, Coutant J, Gigant B, Didelot G, Préat T, Knossow M, Guittet E, Carlier MF (maj 2004). "The beta-thymosin/WH2 domain; structural basis for the switch from inhibition to promotion of actin assembly". Cell. 117 (5): 611–23. doi:10.1016/S0092-8674(04)00403-9. PMID 15163409. S2CID 8628287.
- ^ Van Troys M, Dewitte D, Goethals M, Carlier MF, Vandekerckhove J, Ampe C (Jan 1996). "The actin binding site of thymosin beta 4 mapped by mutational analysis". The EMBO Journal. 15 (2): 201–10. doi:10.1002/j.1460-2075.1996.tb00350.x. PMC 449934. PMID 8617195.
- ^ Hijikata T, Nakamura A, Isokawa K, Imamura M, Yuasa K, Ishikawa R, Kohama K, Takeda S, Yorifuji H (Jun 2008). "Plectin 1 links intermediate filaments to costameric sarcolemma through beta-synemin, alpha-dystrobrevin and actin". Journal of Cell Science. 121 (Pt 12): 2062–74. doi:10.1242/jcs.021634. PMID 18505798.
Dopunska literatura[uredi | uredi izvor]
- Snásel J, Pichová I (1997). "The cleavage of host cell proteins by HIV-1 protease". Folia Biologica. 42 (5): 227–30. doi:10.1007/BF02818986. PMID 8997639. S2CID 7617882.
- Rodríguez Del Castillo A, Vitale ML, Trifaró JM (Nov 1992). "Ca2+ and pH determine the interaction of chromaffin cell scinderin with phosphatidylserine and phosphatidylinositol 4,5,-biphosphate and its cellular distribution during nicotinic-receptor stimulation and protein kinase C activation". The Journal of Cell Biology. 119 (4): 797–810. doi:10.1083/jcb.119.4.797. PMC 2289683. PMID 1331119.
- Adams LD, Tomasselli AG, Robbins P, Moss B, Heinrikson RL (Feb 1992). "HIV-1 protease cleaves actin during acute infection of human T-lymphocytes". AIDS Research and Human Retroviruses. 8 (2): 291–5. doi:10.1089/aid.1992.8.291. PMID 1540415.
- Dawson SJ, White LA (maj 1992). "Treatment of Haemophilus aphrophilus endocarditis with ciprofloxacin". The Journal of Infection. 24 (3): 317–20. doi:10.1016/S0163-4453(05)80037-4. PMID 1602151.
- Tomasselli AG, Hui JO, Adams L, Chosay J, Lowery D, Greenberg B, Yem A, Deibel MR, Zürcher-Neely H, Heinrikson RL (Aug 1991). "Actin, troponin C, Alzheimer amyloid precursor protein and pro-interleukin 1 beta as substrates of the protease from human immunodeficiency virus". The Journal of Biological Chemistry. 266 (22): 14548–53. PMID 1907279.
- Shoeman RL, Kesselmier C, Mothes E, Höner B, Traub P (Jan 1991). "Non-viral cellular substrates for human immunodeficiency virus type 1 protease". FEBS Letters. 278 (2): 199–203. doi:10.1016/0014-5793(91)80116-K. PMID 1991513. S2CID 37002682.
- Erba HP, Eddy R, Shows T, Kedes L, Gunning P (Apr 1988). "Structure, chromosome location, and expression of the human gamma-actin gene: differential evolution, location, and expression of the cytoskeletal beta- and gamma-actin genes". Molecular and Cellular Biology. 8 (4): 1775–89. doi:10.1128/mcb.8.4.1775. PMC 363338. PMID 2837653.
- Vandekerckhove J, Schering B, Bärmann M, Aktories K (Jan 1988). "Botulinum C2 toxin ADP-ribosylates cytoplasmic beta/gamma-actin in arginine 177". The Journal of Biological Chemistry. 263 (2): 696–700. PMID 3335520.
- Chou CC, Davis RC, Fuller ML, Slovin JP, Wong A, Wright J, Kania S, Shaked R, Gatti RA, Salser WA (maj 1987). "Gamma-actin: unusual mRNA 3'-untranslated sequence conservation and amino acid substitutions that may be cancer related". Proceedings of the National Academy of Sciences of the United States of America. 84 (9): 2575–9. Bibcode:1987PNAS...84.2575C. doi:10.1073/pnas.84.9.2575. PMC 304700. PMID 3472224.
- Hesterberg LK, Weber K (Jan 1986). "Isolation of a domain of villin retaining calcium-dependent interaction with G-actin, but devoid of F-actin fragmenting activity". European Journal of Biochemistry / FEBS. 154 (1): 135–40. doi:10.1111/j.1432-1033.1986.tb09368.x. PMID 3510866.
- Erba HP, Gunning P, Kedes L (Jul 1986). "Nucleotide sequence of the human gamma cytoskeletal actin mRNA: anomalous evolution of vertebrate non-muscle actin genes". Nucleic Acids Research. 14 (13): 5275–94. doi:10.1093/nar/14.13.5275. PMC 311540. PMID 3737401.
- Fuchs E, Kim KH, Hanukoglu I, Tanese N (1984). "The evolution and complexity of the genes encoding the cytoskeletal proteins of human epidermal cells". Current Problems in Dermatology. 11: 27–44. doi:10.1159/000408662. ISBN 978-3-8055-3752-0. PMID 6686106.
- Gunning P, Ponte P, Okayama H, Engel J, Blau H, Kedes L (maj 1983). "Isolation and characterization of full-length cDNA clones for human alpha-, beta-, and gamma-actin mRNAs: skeletal but not cytoplasmic actins have an amino-terminal cysteine that is subsequently removed". Molecular and Cellular Biology. 3 (5): 787–95. doi:10.1128/mcb.3.5.787. PMC 368601. PMID 6865942.
- Bretscher A, Weber K (Jul 1980). "Villin is a major protein of the microvillus cytoskeleton which binds both G and F actin in a calcium-dependent manner". Cell. 20 (3): 839–47. doi:10.1016/0092-8674(80)90330-X. PMID 6893424. S2CID 568395.
- Pedrotti B, Colombo R, Islam K (1995). "Microtubule associated protein MAP1A is an actin-binding and crosslinking protein". Cell Motility and the Cytoskeleton. 29 (2): 110–6. doi:10.1002/cm.970290203. PMID 7820861.
- Pope B, Maciver S, Weeds A (Feb 1995). "Localization of the calcium-sensitive actin monomer binding site in gelsolin to segment 4 and identification of calcium binding sites". Biochemistry. 34 (5): 1583–8. doi:10.1021/bi00005a014. PMID 7849017.
- Jesaitis AJ, Erickson RW, Klotz KN, Bommakanti RK, Siemsen DW (Nov 1993). "Functional molecular complexes of human N-formyl chemoattractant receptors and actin". Journal of Immunology. 151 (10): 5653–65. PMID 8228254.
- Hawkins M, Pope B, Maciver SK, Weeds AG (Sep 1993). "Human actin depolymerizing factor mediates a pH-sensitive destruction of actin filaments". Biochemistry. 32 (38): 9985–93. doi:10.1021/bi00089a014. PMID 8399167.
- Yu FX, Lin SC, Morrison-Bogorad M, Atkinson MA, Yin HL (Jan 1993). "Thymosin beta 10 and thymosin beta 4 are both actin monomer sequestering proteins". The Journal of Biological Chemistry. 268 (1): 502–9. PMID 8416954.
- Jalaguier S, Mornet D, Mesnier D, Léger JJ, Auzou G (Apr 1996). "Human mineralocorticoid receptor interacts with actin under mineralocorticoid ligand modulation". FEBS Letters. 384 (2): 112–6. doi:10.1016/0014-5793(96)00295-5. PMID 8612804. S2CID 34685894.
Vanjski linkovi[uredi | uredi izvor]
- Lokacija ljudskog genoma ACTG1 i stranica sa detaljima o genu ACTG1 u UCSC Genome Browseru.