Adenililacija

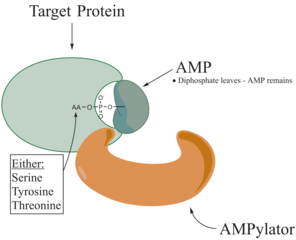
Adenililacija,[1][2] poznatija kao AMPilacija, je proces u kojem je molekula adenozin-monofosfata (AMP) kovalentno vezan za aminokiselinski bočni lanac proteina.[3] Ovo kovalentno dodavanje AMP-a na hidroksilni bočni lanac proteina je posttranslacijska modifikacija.[4] Adenilacija uključuje fosfodiestersku vezu između hidroksilne grupe molekula koji prolazi kroz adenilaciju i fosfatne grupe nukleotid aadenozin-monofosfata (tj. adenilne kiseline). Enzimi koji su sposobni da kataliziraju ovaj proces nazivaju se AMPilatori.
Poznate aminokiseline koje su ciljane u proteinu su tirozin i treonin, a ponekad i serin.[5] Kada se naboji na proteinu podvrgnu promjeni, to utiče na karakteristike proteina, obično mijenjajući njegov oblik, putem interakcija aminokiselina koje ga čine. Ampilacija može imati različite efekte na protein. To su svojstva proteina kao što su stabilnost, enzimska aktivnost, vezivanje kofaktora i mnoge druge funkcionalne sposobnosti. Druga funkcija adenilacije je aktivacija aminokiselina, koju katalizira tRNK aminoacil-sintetaza.[3]Najčešće identificirani proteini koji primaju AMPilaciju su GTPaze i glutamin-sintetaza.
Adenililatori[uredi | uredi izvor]
Enzimi odgovorni za AMPilaciju, zvani AMPilatori ili adenililtransferaza, spadaju u dvije različite porodice, sve ovisno o njihovim strukturnim svojstvima i korištenom mehanizmu. AMPilator je kreiran od dvije katalitske homologne polovine. Jedna je odgovorna za kataliziranje reakcije adenililacije, dok druga katalizira fosforolitsku reakciju deadenilacije[2]. Ove dvije porodice su nalik DNK-β-polimerazi i porodica Fic.[6]
Slična DNK-β-polimerazi je porodica nukleotidiltransferaza.[4] Konkretnije je poznata kao porodica GlnE. Postoji specifičan motiv koji se koristi za razjašnjavanje ove porodice. Motiv se sastoji od trolančanih β-listova koji su dio koordinacije iona magnezija i vezivanja fosfata. Za početak aktivnosti u ovoj porodici neophodan je aspartat.
Fic domen pripada Fido (Fic/Doc) natporodice Fic, što je filamentacija indukovana cAMP domenom, poznatom da izvodi AMPilaciju. Članovi ove porodice proteina nalaze se u svim domenima života na Zemlji. Posreduje se putem mehanizma motiva alfa-heliksa na mjestu vezivanja ATP. Infektivne bakterije koriste ovaj domen da prekinu fagocitozu i uzrokuju ćelijsku smrt. Fic domeni su evolucijski konzervirani domeni I u prokariotima i eukariotima koji pripadaju natporodici domena Fido.[4]
Pokazalo se da su AMPilatori uporedivi s kinazama zbog njihove aktivnosti hidrolize ATP-a i reverzibilnog prijenosa metabolita na hidroksilni bočni lanac proteinskog supstrata. Međutim, AMPilacija katalizira nukleofilni napad na α-fosfatnu grupu, dok kinaza u reakciji fosforilacije cilja na γ-fosfat. Nukleofilni napad AMPilacije dovodi do oslobađanja pirofosfata. A produkti reakcije AMPilacije su AMP-modificirani protein.[5]

Deadenililatori[uredi | uredi izvor]
DeAMPilacija je obrnuta reakcija u kojoj se molekula AMP odvaja od aminokiselinske strane lančanog proteina.
Postoje tri poznata mehanizma za ovu reakciju. Bakterijska GS-ATaza (GlnE) kodira bipartitni protein sa odvojenim N-terminalnim domenima AMPilacije i C-terminalne deAMPilacije čija je aktivnost regulirana PII i povezanim posttranslacijskim modifikacijama. DeAMPilacija njegovog supstrata AMPilirana glutamine-sintetaza se odvija fosforolitskom reakcijom između adenil-tirozina GS i ortofosfata, što dovodi do stvaranja ADP i nemodificirane glutamin-sintetaze.[4]
SidD, protein koji je u ćeliju domaćina uvela patogena bakterija ‘’Legionella pneumophila’’, deAMPilira Rab1 protein domaćina AMPiliran drugim enzimom Legionella pneumophila, AMPilaza SidM. Dok je korist za patogen od uvođenja ova dva antagonistička efektora u domaćina i dalje nejasna, biohemijska reakcija koju provodi SidD uključuje korištenje domena sličnog fosfatazi da katalizira hidrolitsko uklanjanje AMP iz tirozina 77 domaćina Rab1. [7]
U životinjskim ćelijama uklanjanje AMP iz treonina 518 BiP/Grp78 katalizira isti enzim, FICD, koji AMPilira BiP. Za razliku od bakterijske GS-ATaze, FICD izvodi obje reakcije s istim katalititskim domenom.[8]
Klinički značaj[uredi | uredi izvor]
Utvrđeno je da je presinapsnii protein α-sinuklein meta za FICD AMPilaciju. Tokom HypE posredovane adenilacije αSyn, agregacija αSyn smanjuje se i otkriveno je da neurotoksičnost i ER stres smanjuju in vitro. Stoga je adenilacija αSyn možda zaštitni odgovor na ER stres i agregaciju αSyn. Međutim, kako se aSyn i FICD nalaze u različitim odjeljcima, potrebno je provesti daljnja istraživanja koja procjenjuju značaj ovih tvrdnji.[9]
Reference[uredi | uredi izvor]
- ^ Han KK, Martinage A (1992). "Post-translational chemical modification(s) of proteins". The International Journal of Biochemistry. 24 (1): 19–28. doi:10.1016/0020-711x(92)90225-p. PMID 1582530.
- ^ a b Garrett RH, Grisham CM (2007). Biochemistry (3rd izd.). Belmont, CA: Thomas. str. 815–20.
- ^ a b Itzen A, Blankenfeldt W, Goody RS (April 2011). "Adenylylation: renaissance of a forgotten post-translational modification". Trends in Biochemical Sciences. 36 (4): 221–8. doi:10.1016/j.tibs.2010.12.004. PMID 21256032.
- ^ a b c d Woolery AR, Luong P, Broberg CA, Orth K (2010). "AMPylation: Something Old is New Again". Frontiers in Microbiology. 1: 113. doi:10.3389/fmicb.2010.00113. PMC 3095399. PMID 21607083.
- ^ a b Casey AK, Orth K (February 2018). "Enzymes Involved in AMPylation and deAMPylation". Chemical Reviews. 118 (3): 1199–1215. doi:10.1021/acs.chemrev.7b00145. PMC 5896785. PMID 28819965.
- ^ Hedberg C, Itzen A (January 2015). "Molecular perspectives on protein adenylylation". ACS Chemical Biology. 10 (1): 12–21. doi:10.1021/cb500854e. PMID 25486069.
- ^ Chen Y, Tascón I, Neunuebel MR, Pallara C, Brady J, Kinch LN, et al. (2013). "Structural basis for Rab1 de-AMPylation by the Legionella pneumophila effector SidD". PLOS Pathogens. 9 (5): e1003382. doi:10.1371/journal.ppat.1003382. PMC 3656104. PMID 23696742.
- ^ Preissler S, Rato C, Perera L, Saudek V, Ron D (January 2017). "FICD acts bifunctionally to AMPylate and de-AMPylate the endoplasmic reticulum chaperone BiP". Nature Structural & Molecular Biology. 24 (1): 23–29. doi:10.1038/nsmb.3337. PMC 5221731. PMID 27918543.
- ^ Sanyal A, Dutta S, Camara A, Chandran A, Koller A, Watson BG, et al. (May 2019). "Alpha-Synuclein Is a Target of Fic-Mediated Adenylylation/AMPylation: Possible Implications for Parkinson's Disease". Journal of Molecular Biology. 431 (12): 2266–2282. doi:10.1016/j.jmb.2019.04.026. PMC 6554060. PMID 31034889.
