Alkohol


Alkoholi (iz arap. arapski: الكحول ili arapski: الغول, al-kuhul ili al-gaul) jesu hemijski spojevi koji imaju jednu ili više hidroksilnih grupa (-O-H) spojenih na alifatske ugljikove atome.[1] Alkoholi koji se izvode iz alkana nazivaju se alkanoli. Kako bi se odredila tačna razlika između alkohola i karboksilnih kiselina ili poluacetala, određeno je da se atom ugljika (sp3 hibridiziran) može vezati na hidroksi-grupu samo preko atoma ugljika ili vodika. Ako je hidroksi grupa vezana na atom ugljika, a koji je dio aromatskog prstena, takvi spojevi se nazivaju fenoli. Oni se ne ubrajaju u alkohole,[2][3] pošto ove hidroksi grupe reagiraju kiselo analogno karboksi-grupi.
Nomenklatura i podjela[uredi | uredi izvor]

Imena jednostavnijih alkohola se izvode iz imena polaznih alkana i sufiksa (nastavka) -ol. Osim toga, mjesto vezanja OH-grupe pojašnjava se dodatno naznačenim brojem, naprimjer propan-2-ol. Zastarijeli način, kojim su do 1957. označavani alkoholi, jeste "karbinoli" prema prijedlogu Hermanna Kolbea.[4] Ova grupa hemijskih spojeva se dijeli po različitim kriterijima kao što su broj susjednih atoma različitih od vodika, oksidacijski broj, postojanje dvostruke ili trostruke veze među atomima i dužina lanca.
Broj susjednih atoma[uredi | uredi izvor]
Alkoholi se razlikuju po broju susjednih atoma vezanih za atome ugljika, na kojima se nalaze vezane hidroksi-grupe. Kod primarnih alkohola vezana su dva atoma vodika, kod sekundarnih jedan, dok kod tercijarnih alkohola ih nema. Jedan poseban slučaj je metanol, koji pored hidroksi-grupe ima tri atoma vodika.
Oksidacijski broj[uredi | uredi izvor]
Ako je u molekuli alkohola sadržano više od jedne hidroksi funkcionalne grupe, njihov broj se navodi odgovarajućim slogovima iz grčkog jezika (di-, tri-, itd.) prije nastavka -ol, pa se u tom slučaju govori o "višim alkoholima". Naprimjer alkandiol je zapravo etan-1,2-diol (čije je trivijalno ime etilenglikol), dok je alkantriol propan-1,2,3-triol (trivijalnog imena glicerin). Broj prije nastavka -ol odaje i poziciju funkcionalnih grupa. To vrijedi i za jednobrojne (niže) alkohole, naprimjer propan-2-ol ima trivijalno ime izopropanol.
-
Strukturna formula etanola
-
Strukturna formula propan-1,2-diola
-
Strukturna formula propan-1,3-diola
Dvostruke i višestruke veze[uredi | uredi izvor]
Prema postojanju dvostrukih odnosno trostrukih veza u molekuli, alkoholi se dijele na alkanole, alkenole i alkinole, kao i posebne slučajeve, uglavnom nestabilnih, enola.
-
Strukturna formula alil-alkohola (2-propen-1-ol)
-
Strukturna formula butindiola
-
Strukturna formula askorbinske kiseline, primjer jednog endiola
Dužina ugljikovog lanca[uredi | uredi izvor]
Alkoholi se mogu dijeliti i po dužini ugljikovog lanca. Pojam masni alkoholi koristi se za označavanje alkohola sa primarnom OH-grupom koja se nalazi na kraju ravnog ugljikovog lanca, koji je dug od 6 (1-heksanol) pa do 22 atoma ugljika (1-dokozanol).[5] Oni se dobijaju prvenstveno putem redukcije COOH-grupe iz masnih kiselina. Viši primarni alkoholi sa 24 do 36 ugljikovih atoma nazivaju se voštani alkoholi.[3] (sumarne formule CnH2n+1OH gdje je n ≥ 24)
Struktura orbitala[uredi | uredi izvor]
U svim alifatskim alkoholima hidroksi-grupa je spojena na jedan sp3-hibridizirani atom ugljika (C atom sa 4 supstituenta). Poseban slučaj su uglavnom nestabilni enoli, kod kojih je hidroksi-grupa spojena na sp2-hibridizirani atom ugljika.
Fizičke osobine[uredi | uredi izvor]
Niži alkoholi su tečnosti, koji posjeduju karakterističan miris i ljut, prodoran okus. Viši alkoholi su uglavnom čvrste supstance sa vrlo slabo izraženim mirisom. Zbog posjedovanja međumolekularnih veza između vodikovih atoma, u usporedbi sa ugljikovodicima, alkoholi sa istom molekulskom masom imaju relativno visoke tačke topljenja i ključanja.[6] Najvažnija zajednička osobina svih alkohola je njihova hidrofilnost. Ova osobina porastom dužine alkilnog ostatka sve manje dolazi do izražaja, dok raste porastom broja hidroksi grupa. Naročito često se alkoholi sa kratkim lancima koriste kao rastvarači zbog njihovog amfifilnog karaktera.
Visoka tačka ključanja[uredi | uredi izvor]


Kisik ima višu elektronegativnost od vodika i ugljika, tj. on jače privlači elektrone od njih. To dovodi do nesimetričnog rasporeda elektrona duž C-O-H veza, pa se stoga kaže da je to polarna veza kojom se gradi jedan molekularni dipol. Ovi dipoli mogu između sebe graditi takozvane vodikove mostove, kojima se privlačenje između pojedinih molekula drastično pojačava. Zbog toga, alkoholi imaju relativno visoke tačke ključanja u odnosu na homologni niz spojeva iz kojih su izvedeni sa metilnim jedinicama, a koji imaju približno istu molarnu masu. Tako naprimjer nepolarni etan (C2H6) (M = 30) ključa na −89 °C, dok metanol (CH3OH) (M = 32) istu tačku dostiže tek na 65 °C.
Općenito:
- U usporedbi sa alkanima sa istom molarnom masom, alkoholi imaju više tačke ključanja i topljenja, jer između hidroksi grupa (OH-grupa) postoje vodikove veze (mostovi).
- Što je više hidroksi-grupa u molekuli, to se može stvoriti više veza imeđu vodikovih atoma te povećati tačku ključanja tog alkohola.
- Između alkilnih ostataka dodatno se ispoljavaju Van der Waalsove sile. Stoga i tačka ključanja raste porastom dužine alkilnih ostataka.
- Pošto snaga van der Waalsovog djelovanja ne zavisi samo od veličine alkilnog ostatka, nego i njegove površine, jako uvrnute i kuglaste molekule sa hidroksi-grupama u sredini imaju nižu tačku ključanja od ravnih, dužih molekula primarnih alkohola.
Hidrofilnost[uredi | uredi izvor]
OH-grupa je također u mogućnosti graditi vodikove veze sa vodom. Ona time povećava hidrofilnost i rastvorljivost u vodi. Organski alkil-ostaci sami po sebi nisu rastvorljivi u vodi, tj. oni su hidrofobni. Prema tome, rastvorljivost u vodi opada veličinom organskog udjela a raste brojem hidroksi-grupa. Propanol i tert.-butanol pri sobnoj temperaturi još uvijek u svakom omjeru se mogu miješati s vodom, dok svi dugolančani alkoholi se rastvaraju samo u određenim manjim količinama. Veće količine rastvorenih neorganskih soli mogu utjecati na fazno izdvajanje i kod kratkolančanih alkohola.
Općenito:
- Hidroksi-grupa nekog alkohola je polarna zbog neravnomjernog rasporeda naelektrisanja. Prema tome ima istu sposobnost, kao i također polarne molekule vode, da s njima gradi vodikove veze, pa su te grupe odgovorne za dobru rastvorljivost alkohola, naročito onih sa kraćim lancima.
- Što je više hidroksi-grupa u alkoholu, toliko se više može graditi vodikovih veza između alkohola i vode. Stoga porastom broja hidrofilnih hidroksi-grupa u molekuli alkohola raste i njegova rastvorljivost u vodi.
- Ovaj efekat smanjuju nepolarni, hidrofobni alkil-ostaci: što su oni duži time je i rastvorljivost alkohola u vodi slabija.
Kiselost[uredi | uredi izvor]
pKa vrijednost (konstanta disocijacije) alkohola iznosi oko 15. Tako oni u vodenim rastvorima reagiraju gotovo neutralno. Međutim, moguće ih je pomoću neke jake baze deprotonizirati. Deprotonizirani oblik nekog alkohola naziva se alkoholat. Kiselost alkohola opada u nizu od metanola prema primarnim, sekundarnim i tercijarnim alkoholima. Također moguće je alkohole u određenom obimu protonizirati pomoću jakih kiselina:

Alkoholati se industrijski dobijaju prevođenjem odgovarajućih alkohola sa elementarnim natrijem:
Spektroskopija[uredi | uredi izvor]
U infracrvenom dijelu spektra alkohola jasno se mogu prepoznati široke valentne trake OH-grupe u pordučju od 3200 do 3650 cm−1. Širina vrhova nastaje zbog veza između atoma vodika u molekulama vode a u spektrima bezvodnih alkohola te trake se mogu naći u vrlo uskom rasponu od 3620–3650 cm−1.
Hemijske osobine[uredi | uredi izvor]
Reakcija sa koncentriranom sumpornom kiselinom[uredi | uredi izvor]
Na temperaturama ispod 140 °C nastaju estri sumporne kiseline.
Pri oko 140 °C dešava se reakcija kondenzacije u eter.
Iznad temperature od 170 °C primarni alkoholi se dehidratiziraju do alkena. (reakcija eliminacije)
Eliminacija selen-oksida je "blaga" varijanta reakcije eliminacije.
Esterifikacija[uredi | uredi izvor]
Sa karboksilnim kiselinama alkoholi reagiraju do estera uz oslobađanje vode. Ova reakcija se naziva esterifikacija, a kataliziraju je kiseline.
Oksidacija[uredi | uredi izvor]
Primarni alkoholi se oksidiraju do aldehida i karboksilnih kiselina, dok se sekundarni alkoholi oksidiraju do ketona. Tercijarni alkoholi se ne mogu dalje oksidirati, nego kod njih dolazi do uništenja ugljikovog lanca.
| Oksidacija alkohola | ||||
| alkohol | primarni | sekundarni | tercijarni | |
| Proizvod oksidacije I | aldehid | keton | nema reakcije | |
| Proizvod oksidacije II | karboksilna kiselina | nema reakcije | – | |
| primjer: proizvodi oksidacije strukturnih izomera butanola | ||||
| butanol | 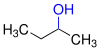 |
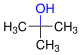
| ||
| Naziv | butan-1-ol | butan-2-ol | 2-metilpropan-2-ol | |
| Proizvod oksidacije I |  |
nema reakcije | ||
| Naziv | butanal (butiraldehid) | butanon (metiletilketon) | – | |
| Proizvod oksidacije II | nema reakcije | – | ||
| Naziv | butanska kiselina | – | – | |
| Funkcionalne grupe su naznačene plavo. | ||||
Za oksidaciju primarnih alkohola do karboksilnih kiselina mogu se koristiti oksidacijska sredstva koja sadrže ion hrom(VI), kao što se naprimjer koriste u Jonesovoj oksidaciji. Nešto manje otrovni reagens bez hroma koristi se i vodeni rastvor rutenij-tetroksida. Oksidacija nekog primarnog alkohola se može odvijati i uz upotrebu određenih spojeva hroma(VI), kao što je Collinsov reagens, samo do stepena aldehida. Od osnovnog značaja je da se koristi bezvodni rastvarač. Ako voda nije prisutna, ne može se odvijati hidratiziranje do geminalnih diola aldehida (aldehidhidrat).[7]
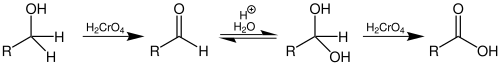
Pošto su rastvorljivi hromati veoma otrovni, a posjeduju i karcinogene i mutagene osobine, razvijene su alternativne metode za oksidaciju alkohola. Jedna od često korištenih metoda je Swernova oksidacija sa aktiviranim dimetilsulfoksidom.[7] Gotovo sve metode prilagođene su oksidaciji sekundarnih alkohola do ketona. Sljedeći pregled pokazuje neke od najvažnijih metoda:
Oksidacija do karboksilnih kiselina/ketona:
- Jonesova oksidacija (hrom(VI)-oksid u sumpornoj kiselini uz prisustva acetona)
- Kalij-dihromat u sumpornoj kiselini
- Rutenij-tetroksid
Oksidacija do aldehida/ketona:
- Collinsov reagens (CrO3·py2 u dihlormetanu)
- Coreyev reagens (piridinijhlorohromat (PCC))
- Cornforthov reagens (piridinijdihromat (PDC))
- Anellijeva oksidacija (kat. TEMPO, steh. NaOCl)
- Dess-Martinova oksidacija (Dess-Martinov perjodinan)
- Leyeva oksidacija (kat. TPAP, steh. NMO)
- Pfitzner-Moffattova oksidacija (DMSO, DCC)
- Swernova oksidacija (DMSO, oksalilhlorid, NEt3)
Za razliku od kiselinskih katalizatora, alkoholi regiraju sa aldehidima do poluacetalena odnosno acetala.
Upotreba[uredi | uredi izvor]
Mnogi alkoholi su važni rastvarači (solventi), ne samo u industriji nego i u domaćinstvima. Prema količinima potrošenih alkohola, najvažniji su metanol, etanol, 2-propanol i n-butanol. U 2011. godini se u svijetu potrošilo oko 6,4 miliona tona alkoholnih rastvarača.[8]
Dokazivanje prisustva[uredi | uredi izvor]
Dodavanje metalnog natrija[uredi | uredi izvor]
Ako se u tečni uzorak alkohola doda natrij, nastat će gasoviti vodik, čiji nastanak se dalje može dokazati njegovim (praskavim) sagorijevanjem. Ova metoda se ubraja u načine dokazivanja alkohola, ali ona nije neupitna i konačna, jer sve protične rastvaračke supstance, naprimjer karboksilne i neorganske kiseline pa i sama voda, također mogu dati sličnu reakciju.
Alkotest[uredi | uredi izvor]
Pretvaranje alkohola sa dihromatima u rastvorima koji sadrže sumpornu kiselinu, pogodno je za kvantitativno dokazivanje alkohola, te se ranije koristilo u cjevčicama alkotestova:
Ovaj princip dokazivanja se zasniva na promjeni boje od žuto-narandžaste (kiseli rastvor dihromata) u zelenu (ioni hroma(III)) te se može izmjeriti spektralno-fotometrijski.[7]
Test cerijem[uredi | uredi izvor]
Postoji i još jedna mogućnost dokazivanja alkohola dodavanjem cerij(IV)-amonijnitrata. U tom postupku u razblaženi rastvor ispitivane supstance dodaje se koncentrirani rastvor cerij(IV)-amonijnitrata. Ako ispitivani uzorak sadrži alkoholnu grupu, on će promijeniti boju u crvenu (ponekad čak i u zelenu). Međutim, ako uzorak sadrži fenole, onda će se iz njega istaložiti smeđi talog.
Razlog nastanka ove obojene reakcije je stvaranje kompleksa, tačnije supstitucija liganda pri čemu je alkohol/fenol koordiniran sa atomom kisika na ion cerija(IV). Putem promjene sfera liganda mijenja se i boja cerija(IV) iz svijetložute u crvenu/zelenu/smeđu. Alkoholi/fenoli koji slabo oksidiraju mogu dati i negativan dokaz prisustva, u kojima se cerij(IV) reducira do cerija(III).
Spisak najvažnijih alkohola[uredi | uredi izvor]
Spisak najvažnijih alkohola (sa tačkama ključanja i topljenja)[uredi | uredi izvor]
| Homologni niz jednobrojnih, primarnih, linearnih, nerazgranatih alkohola | ||||||
|---|---|---|---|---|---|---|
| C-atomi: dvostruka veza | molarna masa u g·mol−1 | sistematski naziv | trivijalni naziv | tačka topljenja u °C | tačka ključanja u °C | rastvorljivost u g·l−1 |
| 1: 0 | 32,0 | metanol | metil-alkohol | −97,8 | 64,7[9] | ∞ |
| 2: 0 | 46,1 | etanol | alkohol, etil-alkohol, "vinski duh" | −114,1 | 78,3[9] | ∞ |
| 3: 0 | 60,1 | propan-1-ol | n-propilalkohol | −126,2 | 97,2[9] | ∞ |
| 4: 0 | 74,1 | butan-1-ol | n-butilalkohol | −89,3 | 117,3[9] | 79 |
| 5: 0 | 88,2 | pentan-1-ol | n-amilalkohol | −78,2 | 138[10] | 23 |
| 6: 0 | 102,2 | heksan-1-ol | n-heksilalkohol | −48,6 | 157,5[10] | 6 |
| 7: 0 | 116,2 | heptan-1-ol | −34,0 | 176[11] | 2 | |
| 8: 0 | 130,2 | oktan-1-ol | −14,9 | 194,5[10] | 0,5 | |
| 9: 0 | 144,3 | nonan-1-ol | −6 [12] | 214–216[13] | 0 | |
| 10: 0 | 158,3 | dekan-1-ol | 7 [14] | 228[11] | 0 | |
| 11: 0 | 172,3 | undekan-1-ol | 15,9[15] | 243[15] | 0 | |
| 12: 0 | 186,3 | dodekan-1-ol | lauril-alkohol | 24 | 259[11] | 0 |
| 13: 0 | 200,4 | tridekan-1-ol | 31,7[15] | 274[15] | 0 | |
| 14: 0 | 214,4 | tetradekan-1-ol | miristil-alkohol | 39−40[15] | 289 | 0 |
| 15: 0 | 228,4 | pentadekan-1-ol | 44 | 270 | 0 | |
| 16: 0 | 242,4 | heksadekan-1-ol | cetilalkohol | 50[15] | 344[15] | 0 |
| … | ||||||
| 18: 0 | 270,5 | oktadekan-1-ol | stearilalkohol | 56–59[15] | 336 | 0 |
| … | ||||||
| 26: 0 | 382,7 | heksakosan-1-ol | ceril-alkohol | 79–81 | 240 (13 Pa) | 0 |
| … | ||||||
| 30: 0 | 438,8 | triakontan-1-ol | miricil-alkohol | 88[15] | 0 | |
| jednobrojni alkoholi: sekundarni i tercijarni, primarni sa razgranatim lancem | ||||||
| broj C atoma | molarna masa u g·mol−1 | sistematsko ime | trivijalno ime | tačka topljenja u °C | tačka ključanja u °C | rastvorljivost u g·l−1 |
| 3 | 60,1 | propan-2-ol | izopropil-alkohol, izopropanol | −88,5 | 82,3[9] | ∞ |
| 4 | 74,1 | butan-2-ol | sekundarni butil-alkohol | −114,7 | 99,5[15] | 125 |
| 4 | 74,1 | 2-metilpropan-1-ol | izobutil-alkohol | −108 | 108[15] | 100 |
| 4 | 74,1 | 2-metilpropan-2-ol | tercijarni butil-alkohol, trimetil-karbinol | 25,5[15] | 82,3[15] | ∞ |
| 5 | 88,2 | pentan-2-ol | sek-n-amil-alkohol | −50 | 118,9[15] | 166 |
| 5 | 88,2 | pentan-3-ol | dietil-karbinol | −8 | 116,1[15] | 55 (30 °C) |
| 5 | 88,2 | 2-metilbutan-1-ol | −70 | 129[15] | 36 | |
| 5 | 88,2 | 3-metilbutan-1-ol | izoamil-alkohol | −117 | 130,8 | 20 |
| 5 | 88,2 | 2-metilbutan-2-ol | −8,4 | 102[15] | ||
| 5 | 88,2 | 3-metilbutan-2-ol | 112,9[15] | |||
| 5 | 83,2 | 2,2-dimetilpropan-1-ol | neo-pentil-alkohol, tercijarni amil-alkohol | −12 | 102 | 125 |
| višebrojni alkoholi | ||||||
| broj C-atoma | molarna masa u g·mol−1 | sistematsko ime | trivijalno ime | tačka topljenja u °C | tačka ključanja u °C | rastvorljivost u g·l−1 |
| 2 | 62,1 | etan-1,2-diol | etilenglikol, 1,2-glikol | −15,6 | 197,2[9] | ∞ |
| 3 | 76 | propan-1,2-diol | propilenglikol | −68 | 188 | ∞ |
| 3 | 76 | propan-1,3-diol | trimetilenglikol | −32 | 215 | ∞ |
| 4 | 90 | butan-1,2-diol | 1,2-butilenglikol | −114 | 192 | ∞ |
| 4 | 90 | butan-1,3-diol | 1,3-butilenglikol | < −50 | 207,5 | ∞ |
| 4 | 90 | butan-1,4-diol | tetrametilenglikol | 16 | 230 | ∞ |
| 4 | 90 | butan-2,3-diol | 2,3-butilenglikol | 34 (mezo) | 183 (mezo) | ∞ |
| 5 | 104 | pentan-1,5-diol | pentametilenglikol | −16 | 241 | ∞ |
| 6 | 118 | heksan-1,6-diol | heksametilenglikol | 39–42 | 253–260 | 5000 |
| 8 | 146 | oktan-1,8-diol | oktametilenglikol | 58–61 | 171–173 (27 hPa) | |
| 9 | 160 | nonan-1,9-diol | nonametilenglikol | 45–46 | 288 | 9 |
| 10 | 174 | dekan-1,10-diol | dekametilenglikol | 72 | 297 | 0,7 |
| 3 | 104 | propan-1,2,3-triol | glicerin, glicerol | 18 | 290 | ∞ |
| ostali alkoholi | ||||||
| broj C-atoma | molarna masa u g·mol−1 | sistematsko ime | trivijalno ime | tačka topljenja u °C | tačka ključanja u °C | rastvorljivost u g·l−1 |
| 5 | 86,13 | ciklopentanol | −19 | 141 | 13[16] | |
| 6 | 100,2 | cikloheksanol | 25,2 | 161,5[9] | 36 | |
| 3: 1 | 58 | prop-2-en-1-ol | alilalkohol | −129 | 97 | ∞ |
| 4: 1 | 71 | but-2-en-1-ol | krotilalkohol | −30 | 118 | 166 |
| 7 | 108,14 | fenilmetanol, (hidroksimetil)benzol | benzilalkohol | −15 | 205,4[9] | 39 |
| 8 | 122,14 | 1-feniletan-1-ol, (1-hidroksietil)benzol (C6H5CH(OH)CH3) | α-feniletilalkohol | 21 | 205 | 0 |
| 8 | 122,14 | 2-feniletan-1-ol, (2-hidroksietil)benzol (C6H5CH2CH2OH) | β-feniletilalkohol | −27 | 221 | 16 |
| 13 | 184,23 | difenilmetanol (C6H5)2CHOH | difeniltrikarbinol, benzhidrol | 69 | 298 | 0 |
| 19 | 260,33 | trifenilmetanol (C6H5)3COH | trifenilkarbinol | 162,5 | >360 | 0 |
| Usporedba fenola i alkohola sa sličnim molarnim masama | ||||||
| broj C-atoma | molarna masa u g·mol−1 | sistematsko ime | trivijalno ime | tačka topljenja u °C | tačka ključanja u °C | rastvorljivost u g·l−1 |
| 6 | 94,1 | fenol | benzenol | 41 | 181,7[9] | 84 |
| 5 | 88,2 | pentan-1-ol | n-amilalkohol | −78,2 | 128,0 | 23 |
| 6 | 102,2 | heksan-1-ol | n-heksilalkohol | −48,6 | 157,1 | 6 |
| 5 | 86,13 | ciklopentanol | −19 | 141 | 13 | |
| 6 | 100,2 | cikloheksanol | 25,2 | 161,5[9] | 36 | |
- Napomene
- * kod tačke ključanja: supstanca se raspada dostizanjem ove temperature. Vrijednosti u zagradama daju tačku ključanja pri pritisku od 20 hPa.
- ∞ kod rastvorljivosti: može se neograničeno miješati s vodom.
Kod pojedinih vrijednosti u nekim izvorima može doći do odstupanja.
Reference[uredi | uredi izvor]
- ^ "Alcohols". u: IUPAC Compendium of Chemical Terminology (“Zlatna knjiga” IUPAC-a). doi:10.1351/goldbook.A00204, verzija: 2.3.1.
- ^ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag, Leipzig 1965, str. 44.
- ^ a b Alkohole, u: Römpp Online. Georg Thieme Verlag, pristupljeno 23. maj 2014
- ^ Science Vision, vol. 3, br. 25, mart 2000. str. 58. (Google knjige)
- ^ Fettalkohole, u: Römpp Online. Georg Thieme Verlag, pristupljeno 20. januara 2013
- ^ Wissenschaft-Online-Lexika: Pojam Alkanol/Alkohol u: Lexikon der Chemie, pristupljeno 1. jula 2008.
- ^ a b c Paula Yurkanis Bruice: Organische Chemie, Pearson Education Inc., 2007, 5. izd., str. 412, 829-830, ISBN 978-3-8273-7190-4.
- ^ Ceresana: Markstudie Lösungsmittel, 2. izd. (UC-3505), april 2012.
- ^ a b c d e f g h i j Siegfried Hauptmann: Organische Chemie, 2. izd., VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, str. 312.
- ^ a b c Hans Beyer, Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 22. izd., 1991, str. 124, ISBN 3-7776-0485-2.
- ^ a b c Hans Rudolf Christensen: Grundlagen der organischen Chemie, Verlag Sauerländer Aarau, 1. izd., 1970, str. 166.
- ^ Unos za CAS br. 143-08-8 u GESTIS bazu podataka, pristupljeno 13. aprila 2008.
- ^ 1-Nonanol (PDF) na stranici Merck, pristupljeno 1. novembra 2010.
- ^ Unos za CAS br. 112-30-1 u GESTIS bazu podataka, pristupljeno 4. januara 2008.
- ^ a b c d e f g h i j k l m n o p q r Robert C. Weast (izd.): CRC Handbook of Chemistry and Physics, 1. studentsko izdanje, 1988, CRC Press Baton Rouge, Florida, ISBN 0-8493-0740-6.
- ^ Unos za ciklopentanol u ChemIDplus bazu podataka (NLM).
Vanjski linkovi[uredi | uredi izvor]
 Alkohol na Wikimedia Commonsu
Alkohol na Wikimedia Commonsu
| Wikicitati imaju citate vezane za: Alkohol |











