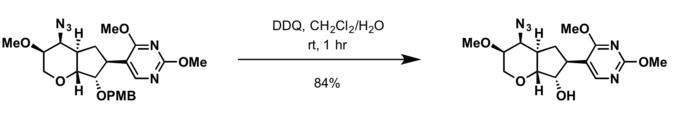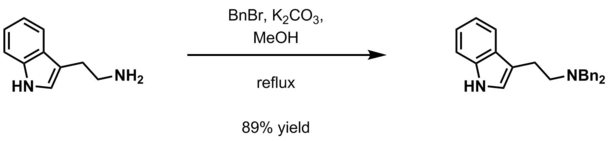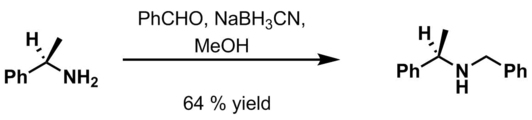Benzil grupa

R = heteroatom, alkil, aril, alil itd. ili ostali supstituenti.
Benzil grupa ili benzil je supstituent ili molekulski fragment koji ima strukturu C6H5CH2–. Benzilska svojstva benzenskog prstena vezana su za CH2 grupu.[1]
Nomenklatura[uredi | uredi izvor]
U IUPAC nomenklaturi prefiks benzil odnosi se na C6H5CH2 supstituent, naprimjer benzil hlorid ili benzil benzoat. Benzil ne treba brkati sa fenil sa formulom C6H5.
Naziv benzilski je upotrijebljen za opis položaja prvog ugljika koji je vezan za benzen ili drugi aromatski prsten. Naprimjer, molekula koja se ponaša kao "benzilski" karbokation. Benzilski slobodni radikal ima formulu C6H5CH•
2. Benzilski karbokation ima formulu C6H5CH+
2, a karbanion: C6H5CH−
2. Nijedna od ovih vrsta ne može nastati u značajnoj količini pod normalnim okolnostima, ali su upotrebljivi u diskusiji o mehanizmima reakcije.
Skraćenice[uredi | uredi izvor]
Skraćenica "Bn" se često upotrebljava za označavanje benzil groupa u nomenklaturi i prikazima strukture hemijskih spojeva. Naprimjer, benzil alkohol može biti predstavljen kao BnOH. Ova skraćenica se ne treba miješati sa "Bz", koja se odnosi n benzoil grupu C6H5C(O)– ili fenil grupu C6H5, skraćeno "Ph".
Reaktivnost benzilskih centara[uredi | uredi izvor]
Poboljšana reaktivnost benzilskih mjesta pripisuje se niskoj energiji razlaganja veze za benzilsku C-H vezu. Naime, veza C6H5CH2−H je oko 10-15% slabija u odnosu na druge vrste C-H veza. Susjedni aromatski prsten stabilizuje benzil radikale. U sljedećoj tabeli su upoređeni podaci o benzilskim C-H vezama u odnosu na njihovu snagu.
| Veza | Veza | Energija razlaganja veze | Kommentar | |
|---|---|---|---|---|
| (kcal/mol) | (kJ/mol) | |||
| C6H5CH2−H | Benzilska C−H veza | 90 | 377 | Benzilske do alilske C−H veze (takve veze pokazuju poboljšanu reaktivnost) |
| H3C−H | Metil C−H veza | 105 | 439 | Jedna od najjačih alifatskih C−H veza |
| C2H5−H | Etil C−H veza | 101 | 423 | Nešto slabija nego H3C−H |
| C6H5−H | Fenil C−H veza | 113 | 473 | Uporediva sa vinil radikalom, rijetka |
| CH2=CHCH2−H | Alilska C–H veza | 89 | 372 | Ovakve veze ispoljavaju poboljšanu reaktivnost |
Najslabija od C−H veza odražava stabilnost benzilnih radikala. Iz povezanih razloga, benzilski supstituenti ispoljavaju poboljšanu reaktivnost kao u oksidaciji, halogenaciji slobodnih radikala ili hidrogenolizi. Kao praktičan primjer može biti kada, u prisutnosti odgovarajućih katalizatora, P-ksilen oksidira isključivo na benzilnim mjestima i daje tereftalnu kiselinu:
- CH3C6H4CH3 + 3 O2 → HO2CC6H4CO2H + 2 H2O.
Ovom metodom, godišnje se proizvedu milioni tona tereftalne kiseline.[2]
Kao zaštitna grupa[uredi | uredi izvor]
Zaštita alkohola[uredi | uredi izvor]

Benzil, skraćeno kao Bn, obično se upotrebljava u organskoj sintezi robusne zaštitne grupe za alkohole i karboksilne kiseline.
Najčešće metode zaštite[uredi | uredi izvor]
- Tretman alkohola jakom bazom, kao što su one u prahu poput: kalij-hidroksid, natrij-hidrid, benzil halid ( BnCl i BnBr).[3][4]
- Monobenzilacija diola može se postići upotrebom Ag2O u dimetilformamidu (DMF) u uslovima povišenih temperatura.[5]
- Primarni alkoholi mogu se selektivno benzilirati u prisustvu fenolnih funkcijskih grupa, upotrebom Cu(acac)2[6]
Najčešći metodi otklanjanja zaštite[uredi | uredi izvor]
Benzil etri mogu se ukloniti pod redukcijskim i oksidacijskim uslovima, kao i upotrebom Lewisovih kiselina.[3]
Redukcijski uslovi[uredi | uredi izvor]
- Za otklanjanje se upotrebljava hidrogenoliza.[7]
- Jednostruki elektronski proces sa Na/NH3 ili Li/NH3
Oksidacijski uslovi[uredi | uredi izvor]
- Benzilske zaštitne grupe mogu se ukloniti upotrebom širokog izbora oksidacijskih agensa, uključujući:
- CrO3/acetatna kiselina na sobnoj temperaturi;
- Ozon;
- N-Bromosukcinimid (NBS);
- N-Jodosukcinimid (NIS);
Na bazi Lewisove kiseline[uredi | uredi izvor]
- Trimetilsilil jodid (Me3SiI) u dihlorometanu na sobnoj temperaturi (selektivnost se postiže pod posebnim uslovima);
Zaštitna p-metoksibenzil grupa[uredi | uredi izvor]
p-Metoksibenzil (PMB) se upotrebljava kao zaštitna grupa za alkohole u organskoj sintezi.
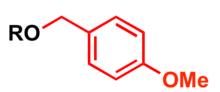
Najčešće zaštitne metode[uredi | uredi izvor]
- Jake baze, kao što su ojačani natrij-hidroksid ili kalij-hidrid i p-metoksibenzil halid (hlorid ili bromid)[8][9];
- 4-metoksibenzil-2,2,2-trihloroacetimidat može se upotrijebiti za instaliranje grupe PMB u prisustvu:
- Scandiij (III) triflata (Sc(OTf)3) u toluenu na 0 °C[10];
- Trifluorometanesulfonatna kiseliina (TfOH) u dihlorometanu na 0 °C[11].
Najčešće metode uklanjanja zaštite[uredi | uredi izvor]
- 2,3-Dihloro-5,6-dicijano-p-benzokvinon (DDQ)[12];
- Uslovi za uklanjanje zaštite benzil grupe su primjenljivi razlaganjem zaštitne grupe PMB.
Zaštita amina[uredi | uredi izvor]

Benzil grupa se dosta primjenjuje kao zaštitna grupa za amine, u organskoj sintezi.
Najčešće metode zaštite amina[uredi | uredi izvor]
- Vodeni kalij-karbonat i benzil halid (BnCl, BnBr) u metanolu[13];
- Benzaldehid, 6 M HCl i NaBH3CN u metanolu[14].
Najčešće metode uklanjanja zaštite amina[uredi | uredi izvor]
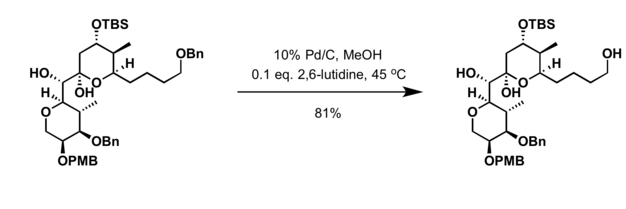
- Hidrogenacija u prisustvu katalizatora paladija[15]
Također pogledajte[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ Carey, F. A.; Sundberg, R. J. (2008). Advanced Organic Chemistry, Part A: Structure and Mechanisms (5th izd.). New York, NY: Springer. str. 806–808, 312–313. ISBN 9780387448978.
- ^ Richard J. Sheehan: Terephthalic Acid, Dimethyl Terephthalate, and Isophthalic Acid; doi: 10.1002/14356007.a26_193.
- ^ a b Wuts, Peter G. M.; Greene, Theodora W. Greene's Protective Groups in Organic Synthesis (4th izd.). Wiley Online Library. doi:10.1002/0470053488. Arhivirano s originala, 25. 1. 2020. Pristupljeno 17. 9. 2016.
- ^ Fukuzawa, Akio; Sato, Hideaki; Masamune, Tadashi (1987-01-01). "Synthesis of (±)-prepinnaterpene, a bromoditerpene from the red alga Yamada". Tetrahedron Letters. 28 (37): 4303–4306. doi:10.1016/S0040-4039(00)96491-8.
- ^ Van Hijfte, Luc; Little, R. Daniel (1985-10-01). "Intramolecular 1,3-diyl trapping reactions. A formal total synthesis of (±)-coriolin". The Journal of Organic Chemistry. 50 (20): 3940–3942. doi:10.1021/jo00220a058. ISSN 0022-3263.
- ^ Sirkecioglu, Okan; Karliga, Bekir; Talinli, Naciye (2003-11-10). "Benzylation of alcohols by using bis[acetylacetonato]copper as catalyst". Tetrahedron Letters. 44 (46): 8483–8485. doi:10.1016/j.tetlet.2003.09.106.
- ^ Smith, Amos B.; Zhu, Wenyu; Shirakami, Shohei; Sfouggatakis, Chris; Doughty, Victoria A.; Bennett, Clay S.; Sakamoto, Yasuharu (2003-03-01). "Total Synthesis of (+)-Spongistatin 1. An Effective Second-Generation Construction of an Advanced EF Wittig Salt, Fragment Union, and Final Elaboration". Organic Letters. 5 (5): 761–764. doi:10.1021/ol034037a. ISSN 1523-7060.
- ^ Marco, José L.; Hueso-Rodríguez, Juan A. (1988-01-01). "Synthesis of optically pure 1-(3-furyl)-1,2-dihydroxyethane derivatives". Tetrahedron Letters. 29 (20): 2459–2462. doi:10.1016/S0040-4039(00)87907-1.
- ^ Takaku, Hiroshi; Kamaike, Kazuo; Tsuchiya, Hiromichi (1984-01-01). "Oligonucleotide synthesis. Part 21. Synthesis of ribooligonucleotides using the 4-methoxybenzyl group as a new protecting group for the 2′-hydroxyl group". The Journal of Organic Chemistry. 49 (1): 51–56. doi:10.1021/jo00175a010. ISSN 0022-3263.
- ^ Trost, Barry M.; Waser, Jerome; Meyer, Arndt (2007-11-01). "Total Synthesis of (−)-Pseudolaric Acid B". Journal of the American Chemical Society. 129 (47): 14556–14557. doi:10.1021/ja076165q. ISSN 0002-7863. PMC 2535803. PMID 17985906.
- ^ Mukaiyama, Teruaki; Shiina, Isamu; Iwadare, Hayato; Saitoh, Masahiro; Nishimura, Toshihiro; Ohkawa, Naoto; Sakoh, Hiroki; Nishimura, Koji; Tani, Yu-ichirou (1999-01-04). "Asymmetric Total Synthesis of Taxol\R". Chemistry – A European Journal (jezik: engleski). 5 (1): 121–161. doi:10.1002/(SICI)1521-3765(19990104)5:13.0.CO;2-O. ISSN 1521-3765.[mrtav link]
- ^ Hanessian, Stephen; Marcotte, Stéphane; Machaalani, Roger; Huang, Guobin (2003-11-01). "Total Synthesis and Structural Confirmation of Malayamycin A: A Novel Bicyclic C-Nucleoside from Streptomyces malaysiensis". Organic Letters. 5 (23): 4277–4280. doi:10.1021/ol030095k. ISSN 1523-7060.
- ^ Kuehne, Martin E.; Xu, Feng (1993-12-01). "Total synthesis of strychnan and aspidospermatan alkaloids. 3. The total synthesis of (±)-strychnine". The Journal of Organic Chemistry. 58 (26): 7490–7497. doi:10.1021/jo00078a030. ISSN 0022-3263.
- ^ Cain, Christian M.; Cousins, Richard P. C.; Coumbarides, Greg; Simpkins, Nigel S. (1990-01-01). "Asymmetric deprotonation of prochiral ketones using chiral lithium amide bases". Tetrahedron. 46 (2): 523–544. doi:10.1016/S0040-4020(01)85435-1.
- ^ Zhou, Hao; Liao, Xuebin; Cook, James M. (2004-01-01). "Regiospecific, Enantiospecific Total Synthesis of the 12-Alkoxy-Substituted Indole Alkaloids, (+)-12-Methoxy-Na-methylvellosimine, (+)-12-Methoxyaffinisine, and (−)-Fuchsiaefoline". Organic Letters. 6 (2): 249–252. doi:10.1021/ol0362212. ISSN 1523-7060.
Vanjski linkovi[uredi | uredi izvor]
| Commons ima datoteke na temu: Benzil grupa |