FAM98A
| FAM98A | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identifikatori | |||||||||||||||||||||||||
| Aliasi | FAM98A | ||||||||||||||||||||||||
| Vanjski ID-jevi | MGI: 1919972 HomoloGene: 41042 GeneCards: FAM98A | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ortolozi | |||||||||||||||||||||||||
| Vrste | Čovjek | Miš | |||||||||||||||||||||||
| Entrez | |||||||||||||||||||||||||
| Ensembl | |||||||||||||||||||||||||
| UniProt | |||||||||||||||||||||||||
| RefSeq (mRNK) | |||||||||||||||||||||||||
| RefSeq (bjelančevina) | |||||||||||||||||||||||||
| Lokacija (UCSC) | Chr 2: 33.53 – 33.6 Mb | Chr 17: 75.84 – 75.86 Mb | |||||||||||||||||||||||
| PubMed pretraga | [3] | [4] | |||||||||||||||||||||||
| Wikipodaci | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Član A porodice sa sličnošću sekvence 98 ili FAM98A, jest gen koji je kod ljudi nalazi na hromosomu 2. U ljdskom genomu kodira protein FAM98A. FAM98A ima dva ljudska paralog: FAM98B I FAM98C. Sva tri karakterizira DUF2465, konzervirani domen za koji se pokazalo da se vezuje za RNK.[5] FAM98A takođe karakterizira glicinom bogatu C-terminalni domen.[6] FAM98A također ima homologe u kičmenjacima i beskičmenjacima i ima udaljene homologe u Choanoflagellata i zelenim algama.
Amiokiselininska sekvenca[uredi | uredi izvor]
Dužina polipeptidnog lanca je 519 aminokiselina, a molkekulska iežina 55.401 Da.[7]
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MECDLMETDI | LESLEDLGYK | GPLLEDGALS | QAVSAGASSP | EFTKLCAWLV | ||||
| SELRVLCKLE | ENVQATNSPS | EAEEFQLEVS | GLLGEMNCPY | LSLTSGDVTK | ||||
| RLLIQKNCLL | LLTYLISELE | AARMLCVNAP | PKKAQEGGGS | EVFQELKGIC | ||||
| IALGMSKPPA | NITMFQFFSG | IEKKKLKETL | AKVPPNHVGK | PLLKKPMGPA | ||||
| HWEKIEAINQ | AIANEYEVRR | KLLIKRLDVT | VQSFGWSDRA | KSQTEKLAKV | ||||
| YQPKRSVLSP | KTTISVAHLL | AARQDLSKIL | RTSSGSIREK | TACAINKVLM | ||||
| GRVPDRGGRP | NEIEPPPPEM | PPWQKRQDGP | QQQTGGRGGG | RGGYEHSSYG | ||||
| GRGGHEQGGG | RGGRGGYDHG | GRGGGRGNKH | QGGWTDGGSG | GGGGYQDGGY | ||||
| RDSGFQPGGY | HGGHSSGGYQ | GGGYGGFQTS | SSYTGSGYQG | GGYQQDNRYQ | ||||
| DGGHHGDRGG | GRGGRGGRGG | RGGRAGQGGG | WGGRGSQNYH | QGGQFEQHFQ | ||||
| HGGYQYNHSG | FGQGRHYTS |
Gen[uredi | uredi izvor]
Lokus[uredi | uredi izvor]
Gen FAM98A kod ljudi nalazi se na poziciji 2p22.3 na – (minus) lancu. Uključujući 5' i 3' UTR, gen obuhvata 15.634 baze i sadrži osam egzona.[8]
iRNK[uredi | uredi izvor]
iRNK je duga 2745 bp i sastoji se od osam egzona. Kodirajuća sekvenca počinje na bazi 75 i nastavlja se do baze 1.631. Repna signalna sekvenca poliA je sekvenca od šest nukleotida 20 baza sa 3' kraja transkripta na bazama 2725-2730, a poliA mjesto je na bazi 2745.[9]
Protein[uredi | uredi izvor]
Primarna sekvenca[uredi | uredi izvor]
FAM98A je dužine 518 aminokiselina sa molekulskom težinom od 55,3 kDa, bez modifikacija. Ostaci 10-329 sastoje se od DUF2465, a ostatak proteina je C-terminal bogat diglicinom. Glicin čini otprilike 20% proteina, sa većinom u posljednjih 200 ostataka.[10]
Posttranslacijske modifikacije[uredi | uredi izvor]
FAM98A ima šest snažno predviđenih mjesta fosforilacije u DUF2465. Predviđeno je da će ova mjesta fosforilirati S169, T178, S236, T243, S276 i S285 pomoću protein-kinaze C.[11] GPS also predicts phosphorylation by protein kinase C at S285 and T178.[12] FAM98A je vjerovatno sumoiliran na pozicijama K183 i K195.[13] Sumoilacija može omogućiti ćeliji da ponovo lokalizira FAM98A između ćelijskog jedra i citoplazme.[14] C-terminal bogat glicinom ima ponavljajuće GRG sekvence, za koje se pokazalo da su podložne metilacijama arginina, bilo simetrično ili asimetrično.[15] Drugi rad objašnjava efekte metilacije arginina na biohemijske funkcije, kao što su aktivacija i represija transkripcije, prerada iRNK, jedarno-citosolno prebacivanje i popravak DNK.[16]
Sekundarna struktura[uredi | uredi izvor]
Predviđeno je da N-kraj ima više alfa-heliksa, iako je C-kraj vjerovatno samo namotan.[17] Alfa-heliksi ne formiraju nikakav kanal, a FAM98A nije transmembranski protein.
Tercijarnana i kvaternarna struktura[uredi | uredi izvor]
Struktura FAM98A je predviđena programom Phyre2. N-terminalna regija sadrži nekoliko alfa-heliksa i C-terminalnu zavojnu regiju koja odgovara glicinom bogatom C-kraju. Ova dva regiona proteina povezana su alfa-spiralom dužine približno 50 ostataka, od ostataka 200-256. Phyre2 je otkrio da je najsličniji protein ljudski protein NDC80 kinetohorski kompleks komponenta, jedarni protein koji se veže za mikrotubule.[18]
Domeni i motivi[uredi | uredi izvor]
FAM98A ima domen nepoznate funkcije 2465 (DUF2465) od aminokiselina 10-329. Unutar DUF2465 postoji heptid (VPDRGGR) blizu C-terminalnog kraja koji je konzerviran kod svih testiranih vrsta. C-terminalni kraj je domen bogat glicinom (glicin čini oko 40% C-terminala) sa GGRGGR ponavljanjima.[10] Na ostacima 149-155, postoji predviđeni jedarni izlazni signal, sa sekvencom ICIALGM (općenito [LIVFM]-X-[LIVFM]-X-[LIVFM]-X-[LIVFM]).[19] Ostaci 173-predviđaju se da je 176 signal jedarne lokalizacije KKLK (K-[K/R]-X-[K/R]).[20]
Homologija[uredi | uredi izvor]
Paralozi[uredi | uredi izvor]
FAM98A ima dva paraloga: FAM98B i FAM98C. FAM98A je najduži od tri paralogna proteinska proizvoda sa po 518 aminokiselina. Sličniji je FAM98B, čiji je C-kraj bogat glicinom mnogo kraći od FAM98A. FAM98C manje je sličan od FAM98B do FAM98A, sve osim što nedostaje C-kraj nakon DUF2465 i sadrži više razlika u aminokiselinskoj sekvenci unutar DUF2465. Eksperimentalno je pokazano da se sva tri proteinska proizvoda nespecifično povezuju sa RNK: FAM98A se veže za iRNK, a FAM98B je ugrađen u kompleks za preradu tRNK.[5]
Ortolozi[uredi | uredi izvor]
Ortolozi za FAM98A pronađeni su kod kičmenjaka. Kod insekata i mehkušaca postoje predviđeni proteini za gen FAM98A. Budući da postoje tri paraloga FAM98 kod ljudi, postoji i zajednički predak ovih gena. Strogi ortolog, gen koji je ortologan FAM98A, a ne cijeloj porodici FAM98, je manje jasan. FAM98A još uvijek nije temeljno proučen, uz činjenicu da mnogi genomi tek treba biti snimljeni, otežava određivanje da li je predviđeni gen FAM98A kod komaraca strogi ortolog (došlo je do podjele FAM98 na FAM98 A, B, C prije nego što se vrsta razišla) ili ako je homolog ("FAM98A" kod komaraca predčki gen FAM98).
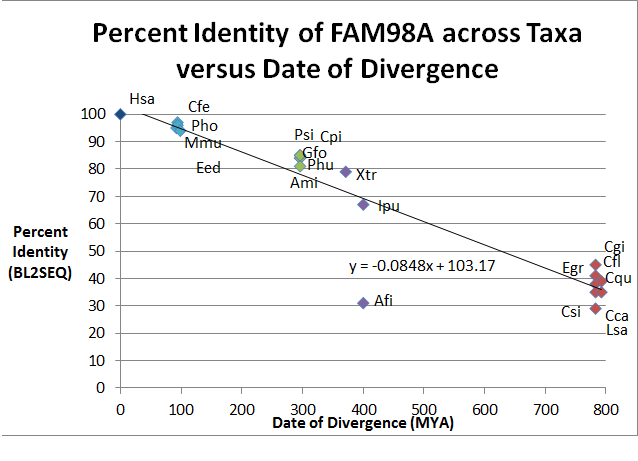
| Broj sekvence | Rod i vrsta (Gsp) | Uobičajeno ime | Datiranje divergencije (milioni godina)
(od Time Tree ) |
Pristupni broj
(iz NCBI ) |
Sekvenca
Length (AA) |
Identitet | Sličnost |
| 1 | Homo sapiens | Čovjek | 0 | 518 | 100 | 100 | |
| 2 | Mus musculus | Miš | 92,3 | 515 | 95 | 96 | |
| 3 | Camelus ferus | Baktrijska kamila | 94,2 | 517 | 97 | 98 | |
| 4 | Pantholops hodgsonii | Tibetska antilopa | 94.2 | 521 | 96 | 97 | |
| 5 | Elephantulus edwardii | Kafezna slonovska rovka | 98,7 | 517 | 94 | 96 | |
| 6 | Geospiza fortis | Srednja prizemna zeba | 296 | 648 | 84 | 88 | |
| 7 | Pseudopodoces humilis | Prizemna sjenica | 296 | 545 | 84 | 88 | |
| 8 | Alligator mississippiensis | Američki aligator | 296 | 556 | 81 | 86 | |
| 9 | Pelodiscus sinensis | Kineska mehkooklopna kornjača | 296 | 549 | 85 | 88 | |
| 10 | Chrysemys picta bellii | Zapadna obojena kornjača | 296 | 549 | 85 | 88 | |
| 11 | Xenopus tropicalis | Zapadna kandžasta žaba | 371,2 | 520 | 79 | 86 | |
| 12 | Anoplopoma fimbria | Samur riba | 400.1 | 353 | 31 | 48 | |
| 13 | Ictalurus punctatus | Kanalski patuljasti som | 400,1 | 543 | 67 | 75 | |
| 14 | Camponotus floridanus | Floridski mrav drvosjek | 782.7 | 516 | 41 | 53 | |
| 15 | Culex quinquefasciatus | Komarac | 782,7 | 498 | 38 | 52 | |
| 16 | Ceratitis capitata | Medna mušica | 782.7 | 454 | 35 | 51 | |
| 17 | Lepeophtheirus salmonis | Lososova vaš | 782,7 | 467 | 29 | 45 | |
| 18 | Crassotrea gigas | Pacifička ostriga | 782,7 | 422 | 45 | 59 | |
| 19 | Clonorchis sinensis | Kineski jetreni metilj | 792,4 | 378 | 35 | 47 | |
| 20 | Echinococcus granulosus | Pasja pantljičara | 792,4 | 1177 | 39 | 56 |
Udaljeni homolozi[uredi | uredi izvor]
Predviđa se da se geni homologni FAM98A pojavljuju u mnogim taksonima unutar Animalia, ali postoje i drugi taksoni izvan koji mogu imati homologne FAM98 gene u svojim genomima. Eukarioti kao što je opistokont Monosiga brevicollis (XP_00174505.1) i Capraspora owczarzaki (XP_004346371.1), a čak i protist Chlorella variabilis (XP_005845167.1), zelena alga, može u genomu imati gen FAM98.[21]
Homologni domeni[uredi | uredi izvor]
Homologni domen u FAM98A je domen DUF2465 (domen nepoznate funkcije 2465). Funkcija ovog domena, kao i samog gena, uglavnom nije poznata, iako je objavljeno da se on prvenstveno vezuje za RNK, ciljajući iRNK u FAM98A i tRNK u FAM98B.[5]
Ekspresija[uredi | uredi izvor]
Promotor[uredi | uredi izvor]
Promotor (GXP_90934) dodijeljen ljudskom transkriptu FAM98A (GXT_24436545)[22] dug je 915 bp, i preklapa se sa transkriptom koji uključuje 243 bp transkripta iRNK. Jedarni respiratorni faktor 1 (NRF1) je transkripcijski faktor za koji je predviđeno sedam mjesta vezanja na promotoru, od kojih su četiri imala sličnost matriksa - optimalni rezultat veći ili jednak 0,085 i dva predviđena transkripcijska faktora sa najvišim rezultatom su NRF1 od 0,204 i 0,199.[23]
Ekspresija gena[uredi | uredi izvor]
U ljudskom transkriptomu velikih razmjera GEO, FAM98A je bio sveprisutno eksprimiran, iako ne ravnomjerno izražen. Tipovi ćelija koji su bili najviše izraženi su mnogi dijelovi mozga (moždana kora,ii000, amigdala, talamus, corpus callosum i hipofiza), testis, materica i glatki mišići.[24] Prema Aceviewu, FAM98A je eksprimiran 3,9 puta više od prosječnog gena. AceView je identifikovao jedanaest transkripata, od kojih su pet bili "dobri", kompletni (i sa N– i C-kraja potpuno prevedeni) proteini. Iz transkripata, očigledno postoje dva glavna dijela FAM98A: prva četiri i druga četiri egzona, a ti dijelovi otprilike odgovaraju tercijarnoj strukturi proteina – N-terminalnog alfa-heliksa do egzona 1-4, i dugi alfa-helisni krak i C-terminal se namotaju na egzone 5-8.[25]
Funkcija i biohemija[uredi | uredi izvor]
Funkcija FAM98A nije eksperimentalno određena, iako je pokazano da vezuje svoj DUF2465 sa iRNK.[5] Kiraga et al. su primijetili da se za nukleinske kiseline vezuju bazni proteini.[26] U stvari, FAM98A (i njegovi ortolozi) imaju nemodifikovanu izoelektričnu tačku od približno 9.[27]
Poznate interakcije[uredi | uredi izvor]
Eksperimentalno je pokazano da FAM98A stupa u interakciju sa UBC, DDX1, C14orf166 i SUMO3, a koeksprimiran je sa DDX1, C14orf166 i RBM25.[28] Ova posljednja tri proteina stupaju u interakciju sa iRNK, kao što se predviđa i za FAM98A. DDX1 je pretpostavljena ATP-ovisna RNK-helikaza u splajsosomu, koja vjerovatno oslobađa RNK iz kompleksa za preradu.[29] C14orf166 RNK-polimeraza II vezujući faktor,[30] a RBM25 regulira alternativnu preradu.[31] Sve ove interakcije sugeriraju da je FAM98A jedarni protein. FAM98A također stupa u interakciju sa SUMO3, koji sumoilira lizine u proteinu, kako bi olakšao transport kroz jedarnu membranu između jedra i citosola.[14] FAM98A također veže nespecifičnu iRNK, što ukazuje na potencijalni iRNK šatl iz jedra u ribosome.[5]
Klinički značaj[uredi | uredi izvor]
U studiji koja se bavila razlikama u nivoima ekspresije određenih gena (uključujući FAM98A) i kod mladih i kod starijih muškaraca sa visokim ili niskim sadržajem proteina, nivoi ekspresije su izmereni kao omjer ishrane sa niskim i visokim sadržajem proteina u svakoj grupi muškaraca ( mladi i stari). FAM98A je imao povećanu ekspresiju u ishrani sa niskim sadržajem proteina i kod mladih i kod starijih muškaraca, 1,01,odnosno1,20. Samo još jedan gen u studiji imao je isti trend povećane ekspresije u ishrani sa niskim sadržajem proteina u obe grupe: THOC4.[32] THOC4, THO kompleks 4 ili Aly/REF faktor eksporta, dimerizira se da formira veći kompleks i prati prerađenu iRNK, pomažući u procesuiranju i eksportu iRNK.[33] U radu se spominje da je pojačana regulacija iRNK kod starijih osoba povezana sa vezivanjem/preradom RNK, signalnim proteinima i degradacijom proteina; zapravo, grupa starijih ima veću ekspresiju FAM98A u ishrani sa niskim sadržajem proteina od mlađih muškaraca.[32]
Pridružene bolesti[uredi | uredi izvor]
Istraživanje na populaciji na Tajvanu otkrilo je povezanost između hipertenzije mladih i dva SNP-a uzvodno od četiri gena na lokusu 2p22.3. Jedan od ova četiri gena bio je FAM98A, iako je potrebno još istraživanja da se potvrdi da je upravo FAM98A gen odgovoran za hipertenziju.[34] Zaista, FAM98A je eksprimiran umjereno visoko (otprilike 75. percentil) u glatkim mišićima i srčanim miocitima.[24]
Reference[uredi | uredi izvor]
- ^ a b c GRCh38: Ensembl release 89: ENSG00000119812 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000002017 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b c d e Dürnberger G, Bürckstümmer T, Huber K, Giambruno R, Doerks T, Karayel E, Burkard TR, Kaupe I, Müller AC, Schönegger A, Ecker GF, Lohninger H, Bork P, Bennett KL, Superti-Furga G, Colinge J (juli 2013). "Experimental characterization of the human non-sequence-specific nucleic acid interactome". Genome Biology. 14 (7): R81. doi:10.1186/gb-2013-14-7-r81. PMC 4053969. PMID 23902751.
- ^ "Pfam: Family: DUF2465 (PF10239)". Pfam. EMBL-EBI. Pristupljeno 5. 5. 2014.
- ^ "UniProt, Q8NCA5" (jezik: engleski). Pristupljeno 12. 11. 2021.
- ^ "Human Gene FAM98A (uc002rpa.1)". Genome. NCBI. Pristupljeno 5. 5. 2014.
- ^ NCBI (National Center for Biotechnology Information) mRNA sequence FAM98A NM_015475.3 https://www.ncbi.nlm.nih.gov/nuccore/NM_015475.3
- ^ a b Brendel, V.; Bucher, P.; Nourbakhsh, I.R.; Blaisdell, B.E.; Karlin, S. (1992). "Methods and algorithms for statistical analysis of protein sequences". Proc. Natl. Acad. Sci. U.S.A. 89 (6): 2002–2006. Bibcode:1992PNAS...89.2002B. doi:10.1073/pnas.89.6.2002. PMC 48584. PMID 1549558.
- ^ Blom N, Sicheritz-Pontén T, Gupta R, Gammeltoft S, Brunak S (juni 2004). "Prediction of post-translational glycosylation and phosphorylation of proteins from the amino acid sequence". Proteomics. 4 (6): 1633–49. doi:10.1002/pmic.200300771. PMID 15174133. S2CID 18810164.
- ^ Xue Y, Ren J, Gao X, Jin C, Wen L, Yao X (septembar 2008). "GPS 2.0, a tool to predict kinase-specific phosphorylation sites in hierarchy". Molecular & Cellular Proteomics. 7 (9): 1598–608. doi:10.1074/mcp.m700574-mcp200. PMC 2528073. PMID 18463090.
- ^ Abgent, a WuXi App Tec company. SUMOplotTM Analysis Program. 2013. http://www.abgent.com/tools
- ^ a b Matunis MJ, Coutavas E, Blobel G (decembar 1996). "A novel ubiquitin-like modification modulates the partitioning of the Ran-GTPase-activating protein RanGAP1 between the cytosol and the nuclear pore complex". The Journal of Cell Biology. 135 (6 Pt 1): 1457–70. doi:10.1083/jcb.135.6.1457. PMC 2133973. PMID 8978815.
- ^ Hyun YL, Lew DB, Park SH, Kim CW, Paik WK, Kim S (juni 2000). "Enzymic methylation of arginyl residues in -gly-arg-gly- peptides". The Biochemical Journal. 348 (3): 573–8. doi:10.1042/0264-6021:3480573. PMC 1221099. PMID 10839988.
- ^ Bedford MT, Clarke SG (januar 2009). "Protein arginine methylation in mammals: who, what, and why" (PDF). Molecular Cell. 33 (1): 1–13. doi:10.1016/j.molcel.2008.12.013. PMC 3372459. PMID 19150423.
- ^ PELE (BPS, D_R, DSC, GGR, GOR, G_G, H_K, K_S, L_G, Q_S, JOI). SDSC Workbench. Board of Trustees of the University of Illinois, 1999.
- ^ Kelley LA, Sternberg MJ (2009). "Protein structure prediction on the Web: a case study using the Phyre server" (PDF). Nature Protocols. 4 (3): 363–71. doi:10.1038/nprot.2009.2. hdl:10044/1/18157. PMID 19247286. S2CID 12497300.
- ^ Fu SC, Imai K, Horton P (septembar 2011). "Prediction of leucine-rich nuclear export signal containing proteins with NESsential". Nucleic Acids Research. 39 (16): e111. doi:10.1093/nar/gkr493. PMC 3167595. PMID 21705415.
- ^ Timmers AC, Stuger R, Schaap PJ, van 't Riet J, Raué HA (juni 1999). "Nuclear and nucleolar localization of Saccharomyces cerevisiae ribosomal proteins S22 and S25". FEBS Letters. 452 (3): 335–40. doi:10.1016/s0014-5793(99)00669-9. PMID 10386617. S2CID 1933493.
- ^ Altschul SF, Madden TL, Schäffer AA, Zhang J, Zhang Z, Miller W, Lipman DJ (septembar 1997). "Gapped BLAST and PSI-BLAST: a new generation of protein database search programs". Nucleic Acids Research. 25 (17): 3389–402. doi:10.1093/nar/25.17.3389. PMC 146917. PMID 9254694.
- ^ Transkript GXT_2827489. Genomatix softver. 2014. http://www.genomatix.de/cgi-bin/[trajno mrtav link]/eldorado/eldorado.pl?s=2ab9d4751cbd873358acdd746c629f61;TRANS=1;TRANSCRIPTID=2827489;ELDORADO_VERSION=E28R1306
- ^ GXP_90934. Genomatix software. 2014. http://www.genomatix.de/cgi-bin/[trajno mrtav link]/eldorado/eldorado.pl?s=99a7e4da5d3118fa8a93fb9a283d710f;PROM_ID=GXP_90934;GROUP=vertebrates;GROUP=others;ELDORADO_VERSION=E28R1306
- ^ a b Nacionalni centar za informacije o biotehnologiji , Nacionalna medicinska biblioteka SAD. Gene Expression Omnibus (GEO) Profili. Analiza velikog obima ljudskog transkriptoma (HG-U133A)".https://www.ncbi.nlm.nih.gov/geo/tools/profileGraph.cgi?ID=GDS596:212333_at
- ^ "Homo sapiens complex locus FAM98A, encoding family with sequence similarity 98, member A." AceView. NCBI.
- ^ Kiraga J, Mackiewicz P, Mackiewicz D, Kowalczuk M, Biecek P, Polak N, Smolarczyk K, Dudek MR, Cebrat S (juni 2007). "The relationships between the isoelectric point and: length of proteins, taxonomy and ecology of organisms". BMC Genomics. 8: 163. doi:10.1186/1471-2164-8-163. PMC 1905920. PMID 17565672.
- ^ Program dr. Luce Toldo, razvijen na http://www.embl-heidelberg.de. promijenio je Bjoern Kindler, kako bi se ispisala i najniža pronađena neto naknada. Dostupno na EMBL WWW Gateway to Isoelectric Point Service "Archived copy". Arhivirano s originala, 26. 10. 2008. Pristupljeno 10. 5. 2014.CS1 održavanje: arhivirana kopija u naslovu (link)
- ^ STRING 9.1. FAM98A. http://string-db.org/newstring_cgi/show_network_section.pl
- ^ "DEAD (Asp-Glu-Ala-Asp) Box Helicase 1". GeneCards.
- ^ "Chromosome 14 Open Reading Frame 166". GeneCards.
- ^ "RNA Binding Motif Protein 25". GeneCards.
- ^ a b Thalacker-Mercer AE, Fleet JC, Craig BA, Campbell WW (novembar 2010). "The skeletal muscle transcript profile reflects accommodative responses to inadequate protein intake in younger and older males". The Journal of Nutritional Biochemistry. 21 (11): 1076–82. doi:10.1016/j.jnutbio.2009.09.004. PMC 2891367. PMID 20149619.
- ^ "Aly/REF Export Factor". GeneCards.
- ^ Yang HC, Liang YJ, Wu YL, Chung CM, Chiang KM, Ho HY, Ting CT, Lin TH, Sheu SH, Tsai WC, Chen JH, Leu HB, Yin WH, Chiu TY, Chen CI, Fann CS, Wu JY, Lin TN, Lin SJ, Chen YT, Chen JW, Pan WH (2009). "Genome-wide association study of young-onset hypertension in the Han Chinese population of Taiwan". PLOS ONE. 4 (5): e5459. Bibcode:2009PLoSO...4.5459Y. doi:10.1371/journal.pone.0005459. PMC 2674219. PMID 19421330.




