GBA (gen)
β-Glukocerebrozidaza ili kisela β-glukozidaza, D-glukozil-N-acilsfingozin glukohidrolaza ili GCasa jest enzim koji je kod ljudi kodiran genom sa hromosoma 1. To je enzim sa aktivnošću glukozilceramidaza (3.2.1.45) koji je neophodan da se hidrolizom rascijepi beta-glukozidna veza glukocerebrozida, međuprodukta u metabolizmu glikolipida, koji je u izobilju u ćelijskim membranama (posebno ćelijama kože).[5] Nalazi se na lizosomima, gdje je vezana sa njihovom membranom.[6]
Aminokiselinska sekvenca[uredi | uredi izvor]
Dužina polipeptidnog lanca je 536 aminokiselina, a molekulska težina 59.716 Da.[7]
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MEFSSPSREE | CPKPLSRVSI | MAGSLTGLLL | LQAVSWASGA | RPCIPKSFGY | ||||
| SSVVCVCNAT | YCDSFDPPTF | PALGTFSRYE | STRSGRRMEL | SMGPIQANHT | ||||
| GTGLLLTLQP | EQKFQKVKGF | GGAMTDAAAL | NILALSPPAQ | NLLLKSYFSE | ||||
| EGIGYNIIRV | PMASCDFSIR | TYTYADTPDD | FQLHNFSLPE | EDTKLKIPLI | ||||
| HRALQLAQRP | VSLLASPWTS | PTWLKTNGAV | NGKGSLKGQP | GDIYHQTWAR | ||||
| YFVKFLDAYA | EHKLQFWAVT | AENEPSAGLL | SGYPFQCLGF | TPEHQRDFIA | ||||
| RDLGPTLANS | THHNVRLLML | DDQRLLLPHW | AKVVLTDPEA | AKYVHGIAVH | ||||
| WYLDFLAPAK | ATLGETHRLF | PNTMLFASEA | CVGSKFWEQS | VRLGSWDRGM | ||||
| QYSHSIITNL | LYHVVGWTDW | NLALNPEGGP | NWVRNFVDSP | IIVDITKDTF | ||||
| YKQPMFYHLG | HFSKFIPEGS | QRVGLVASQK | NDLDAVALMH | PDGSAVVVVL | ||||
| NRSSKDVPLT | IKDPAVGFLE | TISPGYSIHT | YLWRRQ |
Struktura[uredi | uredi izvor]
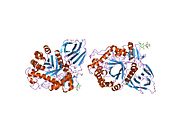
β-Glukocerebrozidaza je član porodice glikozid-hidrolaza 30 i sastoji se od tri različita domena (I-III).[8]
-
Trodimenzijski PyMol prikaz glukocerebrozidaze sa tri istaknuta domena.
-
Trodimenzijski PyMol prikaz glukocerebrozidaze s istaknutim katalitskim ostacima.
Domen I (ostaci 1–27 i 383–414) formira trolančani antiparalelni β-list. Ovaj domen sadrži dva disulfidna mosta koja su neophodna za pravilno savijanje, kao i glikozilirani ostatak (Asn19) koji je neophodan za katalitsku aktivnost in vivo. Domen II (ostaci 30–75 i 431–497) sastoji se od dva β-lista koji liče na imunoglobulinsko savijanje. Domen III (ostaci 76–381 i 416–430) je homologan TIM-barelu i visoko je konzerviran domen među glikozid-hidrolazama.[9] Domen III sadrži aktivno mjesto, koje vezuje supstrat glukocerebrozid u neposrednoj blizini katalitskih ostataka E340 i E235. Domeni I i III su usko povezani, dok su domeni II i III povezani nesređenim linkerom.[8]
Mehanizam[uredi | uredi izvor]
Kristalna struktura ukazuje da β-glukocerebrozidaza vezuje dio glukozu e i susjednu O-glikozidnu vezu glukocerebrozida. Dva alifatska lanca glukocerebrozida mogu ostati povezana sa lizosomskim dvoslojem ili u interakciji sa aktivirajućim proteinom sapozin C.[8]
U skladu s drugim glikozidnim hidrolazama, mehanizam glukocerebrozida hidrolizira pomoću β-glukocerebrozidaze uključujuči kiselina/baznu katalizu pomoću dva glutanatna ostatka (E340 i E235 do a) i dva prethodna. U prvom koraku, E340 izvodi nukleofilni napad na ugljiku O-glikozidne veze, kako bi istisnuo sfingozinski dio, koji je istovremeno protoniran putem E235, dok se oslobađa iz aktivnog mjesta. U drugom koraku, glukoza se hidrolizira iz ostatka E340, kako bi se regenerirao aktivni enzim.[8][10]
Svojstva[uredi | uredi izvor]
β-Glukocerebrozidaza je maksimalno aktivna pri pH 5,5, pH lizosomnog odjeljka.[11] Unutar lizozoma, GCase ostaje povezana s membranom, gdje se vezuje i razgrađuje svoj supstrat glukocerebrozid (GluCer). GCaza zahtijeva aktivirajući protein sapozin C kao i negativno nabijene lipide za maksimalnu katalitsku aktivnost.[12][13] Uloga sapozina C nije poznata; međutim, pokazalo se da veže i lizosomnu membranu i lipidne dijelove GluCer-a, te stoga može regrutirati GluCer na aktivno mjesto enzima.[14][15]
β-Glukocerebrozidaza je specifično i ireverzibilno inhibirana analogom glukoze, konduritol B-epoksidom. Konduritol B-epoksid vezuje se za aktivno mjesto GCase, gdje enzim cijepa svoj epoksidni prsten, formirajući trajnu kovalentnu vezu između enzima i inhibitora.[16]
U početku se smatralo da je GCasa jedan od rijetkih lizosomnih enzima koji ne slijedi manoza-6-fosfatni put za promet u lizosoma.[17] Studija bolesti I-ćelija fibroblasta (u kojoj je fosfotransferaza koja stavlja manoza 6-fosfat na proteine da ih usmjeri na lizosom neispravna) pokazala je ciljanje GCase do lizosoma nezavisno od M6P puta.[18] Pokazalo se da lizosomni transporter i integralni membranski protein LIMP-2 (lizosomni integralni membransku protein 2) vezuju GCase i olakšavaju transport do lizosoma, demonstrirajući mehanizam za M6P-nezavisni promet lizosoma. Ovaj zaključak je doveden u pitanje kada je kristalna struktura GCase u kompleksu sa LIMP-2 pokazala manoza 6-fosfatni dio na LIMP-2, sugerirajući da kompleks također može pratiti uobičajeni manoza-6-fosfatni put.[19]
Klinički značaj[uredi | uredi izvor]
Mutacijeu glukocerebrozidaznom genu uzrokuju Gaucherovu bolest, lizosomsku bolest skladištenja koju karakterizira nakupljanje glukocerebrozida u makrofagima koji infiltriraju mnoge vitalne organe.[20][21]
Mutacije gena za glukocerebrozidazu su takođe povezane sa Parkinsonovom bolešću.[22]
Srodni pseudogen je otprilike 12 kb nizvodno od ovog gena na hromosomu 1. Alternativna prerada rezultira višestrukim varijantama transkripta koje kodiraju isti protein.[23]
Lijekovi[uredi | uredi izvor]
Algluceraza (ceredaza) je bila verzija glukocerebrozidaze koja je sakupljena iz ljudskog placentnog tkiva, a zatim modificirana enzimima.[24] FDA ga je odobrila 1991.[25] i povučen je sa tržišta [26][27] zbog odobrenja sličnih lijekova napravljenih tehnologijom rekombinantne DNK, umjesto da se sakupljaju iz tkiva. Lijekovi napravljeni rekombinantno ne predstavljaju rizik od prenošenja bolesti iz tkiva koje se koristi u berbi i jeftiniji su za proizvodnju.[24]
Rekombinantne glukocerebrozidaze koje se koriste kao lijekovi su:[28]
- Imigluceraza (Cerezim)[24]
- Velagluceraza (Vpriv)[24]
- T-aligluceraza alfa (Elelyso)[29]
Također pogledajte[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ a b c ENSG00000177628 GRCh38: Ensembl release 89: ENSG00000262446, ENSG00000177628 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000028048 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Vielhaber G, Pfeiffer S, Brade L, Lindner B, Goldmann T, Vollmer E, et al. (novembar 2001). "Localization of ceramide and glucosylceramide in human epidermis by immunogold electron microscopy". The Journal of Investigative Dermatology. 117 (5): 1126–36. doi:10.1046/j.0022-202x.2001.01527.x. PMID 11710923.
- ^ Rijnboutt S, Aerts HM, Geuze HJ, Tager JM, Strous GJ (mart 1991). "Mannose 6-phosphate-independent membrane association of cathepsin D, glucocerebrosidase, and sphingolipid-activating protein in HepG2 cells". The Journal of Biological Chemistry. 266 (8): 4862–8. doi:10.1016/S0021-9258(19)67728-8. PMID 1848227.
- ^ "UniProt, P04062" (jezik: en.). Pristupljeno 11. 12. 2021.CS1 održavanje: nepoznati jezik (link)
- ^ a b c d Lieberman RL (2011). "A Guided Tour of the Structural Biology of Gaucher Disease: Acid-β-Glucosidase and Saposin C". Enzyme Research. 2011: 973231. doi:10.4061/2011/973231. PMC 3226326. PMID 22145077.
- ^ Rigden DJ, Jedrzejas MJ, de Mello LV (juni 2003). "Identification and analysis of catalytic TIM barrel domains in seven further glycoside hydrolase families". FEBS Letters. 544 (1–3): 103–11. doi:10.1016/S0014-5793(03)00481-2. PMID 12782298.
- ^ Vocadlo DJ, Davies GJ, Laine R, Withers SG (august 2001). "Catalysis by hen egg-white lysozyme proceeds via a covalent intermediate" (PDF). Nature. 412 (6849): 835–8. Bibcode:2001Natur.412..835V. doi:10.1038/35090602. PMID 11518970. S2CID 205020153.
- ^ Sinclair G, Pfeifer TA, Grigliatti TA, Choy FY (april 2006). "Secretion of human glucocerebrosidase from stable transformed insect cells using native signal sequences". Biochemistry and Cell Biology. 84 (2): 148–56. doi:10.1139/o05-165. PMID 16609695.
- ^ Aerts JM, Sa Miranda MC, Brouwer-Kelder EM, Van Weely S, Barranger JA, Tager JM (oktobar 1990). "Conditions affecting the activity of glucocerebrosidase purified from spleens of control subjects and patients with type 1 Gaucher disease". Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology. 1041 (1): 55–63. doi:10.1016/0167-4838(90)90122-V. PMID 2223847.
- ^ Weiler S, Kishimoto Y, O'Brien JS, Barranger JA, Tomich JM (april 1995). "Identification of the binding and activating sites of the sphingolipid activator protein, saposin C, with glucocerebrosidase". Protein Science. 4 (4): 756–64. doi:10.1002/pro.5560040415. PMC 2143096. PMID 7613473.
- ^ Alattia JR, Shaw JE, Yip CM, Privé GG (oktobar 2006). "Direct visualization of saposin remodelling of lipid bilayers". Journal of Molecular Biology. 362 (5): 943–53. doi:10.1016/j.jmb.2006.08.009. PMID 16949605.
- ^ Tamargo RJ, Velayati A, Goldin E, Sidransky E (juli 2012). "The role of saposin C in Gaucher disease". Molecular Genetics and Metabolism. 106 (3): 257–63. doi:10.1016/j.ymgme.2012.04.024. PMC 3534739. PMID 22652185.
- ^ Ogawa S, Uetsuki S, Tezuka Y, Morikawa T, Takahashi A, Sato K (juni 1999). "Synthesis and evaluation of glucocerebrosidase inhibitory activity of anhydro deoxyinositols from (+)-epi- and (-)-vibo-quercitols". Bioorganic & Medicinal Chemistry Letters. 9 (11): 1493–8. doi:10.1016/S0960-894X(99)00223-1. PMID 10386923.
- ^ Reczek D, Schwake M, Schröder J, Hughes H, Blanz J, Jin X, et al. (novembar 2007). "LIMP-2 is a receptor for lysosomal mannose-6-phosphate-independent targeting of beta-glucocerebrosidase". Cell (jezik: engleski). 131 (4): 770–83. doi:10.1016/j.cell.2007.10.018. PMID 18022370. S2CID 6771697.
- ^ Glickman JN, Kornfeld S (oktobar 1993). "Mannose 6-phosphate-independent targeting of lysosomal enzymes in I-cell disease B lymphoblasts". The Journal of Cell Biology. 123 (1): 99–108. doi:10.1083/jcb.123.1.99. PMC 2119824. PMID 8408210.
- ^ Zhao Y, Ren J, Padilla-Parra S, Fry EE, Stuart DI (juli 2014). "Lysosome sorting of β-glucocerebrosidase by LIMP-2 is targeted by the mannose 6-phosphate receptor". Nature Communications. 5: 4321. Bibcode:2014NatCo...5.4321Z. doi:10.1038/ncomms5321. PMC 4104448. PMID 25027712.
- ^ Mucci JM, Rozenfeld P (2015). "Pathogenesis of Bone Alterations in Gaucher Disease: The Role of Immune System". Journal of Immunology Research. 2015: 192761. doi:10.1155/2015/192761. PMC 4433682. PMID 26064996.
- ^ Stirnemann J, Belmatoug N, Camou F, Serratrice C, Froissart R, Caillaud C, et al. (februar 2017). "A Review of Gaucher Disease Pathophysiology, Clinical Presentation and Treatments". International Journal of Molecular Sciences. 18 (2): 441. doi:10.3390/ijms18020441. PMC 5343975. PMID 28218669.
- ^ Kalia LV, Lang AE (august 2015). "Parkinson's disease". Lancet. 386 (9996): 896–912. doi:10.1016/S0140-6736(14)61393-3. PMID 25904081. S2CID 5502904.
- ^ "Entrez Gene: GBA glucosidase, beta; acid (includes glucosylceramidase)".
- ^ a b c d Deegan PB, Cox TM (2012). "Imiglucerase in the treatment of Gaucher disease: a history and perspective". Drug Design, Development and Therapy. 6: 81–106. doi:10.2147/DDDT.S14395. PMC 3340106. PMID 22563238.
- ^ "Regulatory Matters" (PDF). WHO Drug Information. 5 (3): 123–4. 1991.
- ^ "Enzyme-replacement Therapy for Lysosomal Storage Disorders". Clinical Policy Bulletin Number: 0442. Aetna. 8. 8. 2014.
- ^ "FDA Prescription and Over-the-Counter Drug Product List" (PDF). Additions/Deletions for Prescription Drug Product List. U.S. Food and Drug Administration. mart 2012.
- ^ Grabowski GA (2012). "Gaucher disease and other storage disorders". Hematology. American Society of Hematology. Education Program. 2012: 13–8. doi:10.1182/asheducation.v2012.1.13.3797921. PMID 23233555.
- ^ Yukhananov A (1. 5. 2012). "U.S. FDA approves Pfizer/Protalix drug for Gaucher". Chicago Tribune. Reuters. Arhivirano s originala, 14. 9. 2022. Pristupljeno 2. 5. 2012.
Dopunska literatura[uredi | uredi izvor]
- Horowitz M, Zimran A (1994). "Mutations causing Gaucher disease". Human Mutation. 3 (1): 1–11. doi:10.1002/humu.1380030102. PMID 8118460. S2CID 30605941.
- Tayebi N, Stone DL, Sidransky E (oktobar 1999). "Type 2 gaucher disease: an expanding phenotype". Molecular Genetics and Metabolism (Submitted manuscript). 68 (2): 209–19. doi:10.1006/mgme.1999.2918. PMID 10527671.
- Stone DL, Tayebi N, Orvisky E, Stubblefield B, Madike V, Sidransky E (2000). "Glucocerebrosidase gene mutations in patients with type 2 Gaucher disease". Human Mutation (Submitted manuscript). 15 (2): 181–8. doi:10.1002/(SICI)1098-1004(200002)15:2<181::AID-HUMU7>3.0.CO;2-S. PMID 10649495.
- Caillaud C, Poenaru L (2002). "[Gaucher's and Fabry's diseases: biochemical and genetic aspects]". Journal de la Société de Biologie. 196 (2): 135–40. doi:10.1051/jbio/2002196020135. PMID 12360742.
- Fabrega S, Durand P, Mornon JP, Lehn P (2002). "[The active site of human glucocerebrosidase: structural predictions and experimental validations]". Journal de la Société de Biologie. 196 (2): 151–60. doi:10.1051/jbio/2002196020151. PMID 12360744.
- Alfonso P, Aznarez S, Giralt M, Pocovi M, Giraldo P (2007). "Mutation analysis and genotype/phenotype relationships of Gaucher disease patients in Spain". Journal of Human Genetics. 52 (5): 391–6. doi:10.1007/s10038-007-0135-4. PMID 17427031.
Vanjski linkovi[uredi | uredi izvor]
- GeneReviews/NCBI/UW/NIH entry on Gaucher disease
- Glucocerebrosidase na US National Library of Medicine Medical Subject Headings (MeSH)
Proteopedia Acid-beta-glucosidase