Hipohlorit
| Hipohlorit | |
|---|---|
   | |
| Općenito | |
| Hemijski spoj | Hipohlorit |
| Druga imena | = Hlorat(I) |
| Molekularna formula | ClO– |
| CAS registarski broj | 14380-61-1 |
| SMILES | [O-]Cl |
| InChI | 1S/ClO/c1-2/q-1 |
| Osobine1 | |
| Rizičnost | |
| NFPA 704 | |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Hipohlorit – u hemiji – je ion sa hemijskom formulom ClO−. Ona se kombinira s brojnim kationima i formira hipohlorite , koji se također mogu smatrati solima hipohlorne kiseline. Uobičajeni primjeri uključuju natrij-hipoklorit (kućansko bjelilo) i kalcij-hipoklorit (komponenta praška za izbjeljivanje, bazenski „hlor“). Naziv se može odnositi i na estere hipotetiske hipohlorne kiseline, jer su organski spojevi sa ostatkom ClO– kovalentno vezani za ostatak molekule. Glavni primjer je tert-butil hipoklorit, koji je korisno sredstvo za hloriranje.[1]
Većina hipokloritnih soli su nestabilne u svojim čistim oblicima i normalno se rukuje s njima u vodenim rastvorima. Njihove primarne primjene su kao sredstava za izbjeljivanje, dezinfekciju i obradu vode, ali se također koriste u hemiji za reakcije hloriranja i oksidacija.
Reakcije[uredi | uredi izvor]
Kisela reakcija[uredi | uredi izvor]
Zakiseljavanje hipokloritima stvara hipohlornu kiselinu. Ona stoji u ravnoteži sa plinovitim hlorom, koji može ispariti rastvor. Ravnoteža je podložna Le Chatelierovom principu; stoga visoki pH pokreće reakciju na lijevo trošeći ione H+, promovirajući nesrazmjernost hlora u hloridu i hipokloritu, dok niski pH podstiče reakciju udesno, promovirajući ispuštanje plina hlora.
- 2 H+ + ClO– + Cl– \rightleftarrows Cl2 + H2O.
Hipohlorna kiselina također stoji u ravnoteži sa njenim anhidridom, dihlor-monoksidom.[2]
- 2 HOCl \rightleftarrows Cl2O + H2O K (na 0 °C) = 3,55, e=-33 mol−1
Stabilnost[uredi | uredi izvor]
Hipokloriti su općenito nestabilni i mnogi spojevi postoje samo u otopini. Litij-hipoklorit LiOCl, kalcij-hipoklorit Ca (OCl)2 i barij-hipoklorit Ba(ClO)2 izolirani su kao čisti bezvodni spojevi. Svi su krute tvari. Još nekoliko njih se može proizvesti kao vodene otopine. Općenito, što je veće razrjeđivanje – veća je i njihova stabilnost. Nije moguće odrediti trendove soli zemnoalkalnih metala, jer se mnoge od njih ne mogu formirati. Berilij-hipoklorit nije poznat. Čisti magnezij-hipoklorit se ne može pripremiti; međutim, poznat je čvrsti Mg (OH) OCl.[3] Kalcij-hipoklorit se proizvodi u industrijskim razmjerima i ima dobru stabilnost. Stroncij-hipoklorit, Sr(OCl)2, nije dobro karakteriziran i njegova stabilnost još nije određena.[4]
Hipohloritni ion je nestabilan s obzirom na disproporcionalnost. Nakon zagrijavanja razgrađuje se u smjesu hlorida, kisika i ostalih hlorata:
- 2 ClO– → 2 Cl– + O2
- 3 ClO– → 2 Cl– + ClO3–
Ta reakcija je egzotermna i u slučaju koncentriranih hipoklorita, poput LiOCl i Ca(OCl)2, može dovesti do opasnog otpuštanja toplote i potencijalnih eksplozija.[5][6]
Hipokloriti alkalnog metala smanjuju stabilnost na nižu grupu periodne tablice. Bezvodni litij-hipoklorit stabilan je na sobnoj temperaturi; međutim, natrij-hipoklorit nije pripremljen suhlji od pentahidrata (NaOCl·(H2O)5). Ovo je gore nestabilno 0 °C;[7] iako razrijeđenije otopine koje se susreću kao izbjeljivači u domaćinstvu imaju bolju stabilnost. Kalij-hipoklorit (KOCl) poznat je samo u otopini.[3]
Zabilježeno je da su hipokloriti lantanida također nestabilni, a da su stabilniji u bezvodnim oblicima nego u prisustvu vode.[8] Hipoklorit se koristio za oksidaciju cerija iz +3 u +4 oksidacijsko stanje.[9]
Hipoklorna kiselina sama po sebi nije stabilna u izolaciji, jer se raspada, čime nastaje hlor.
Reakcije s amonijakom[uredi | uredi izvor]
Hipokloriti reagiraju s amonijakom, prvo dajući monohloramin (NH2Cl), zatim dihlormin (NHCl2i na kraju [[dušik-trihlorid] ] (NCl3).
Dobijanje[uredi | uredi izvor]
Hipohloritne soli[uredi | uredi izvor]
Nekoliko hipoklorita može nastati reakcijom disproporcionalnosti između hlora i metalnih hidroksida. Reakcija se izvodi pri sobnoj temperaturi, jer će na višim temperaturama doći do daljnje oksidacije, što će dovesti do stvaranja hlorata. Ovaj se postupak naširoko koristi za industrijsku proizvodnju natrij-hipoklorita (NaClO) i kalcij-hipoklorita (Ca(ClO)2).
- 2 Cl2 + 2 Ca(OH)2 → CaCl2 + Ca(ClO)2 + 2 H2O
Velike količine natrij-hipoklorita također se proizvode elektrokemijski ili u odvojenom hloralkalijskom postupku. U tom procesu se slana otopina elektrolizira i nastaje Cl 2 koji se disocira u vodi kako bi tvorio hipoklorit. Ova se reakcija mora izvoditi u nekiselinskim uvjetima kako bi se spriječilo da plinoviti hlor ishlapi otopinu:
- 2 Cl– → Cl2– + 2 e−
- Cl2 + H2O \rightleftarrows HclO + Cl– + H+
Male količine neobičnijih hipolorita mogu se također stvoriti u postupku zvanom reakcija metateze soli između kalcij-hipoklorita i različitih metalnih sulfata. Ta se reakcija izvodi u vodi i ovisi o stvaranju netopivog kalcij-sulfata, koji će kao talog izdvojiti iz otopine, vodeći reakciju do kraja.
- Ca(ClO)2 + MSO4 → M(ClO)2 + CaSO4
Organski hipohloriti[uredi | uredi izvor]
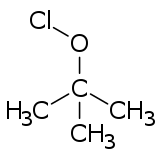
Hipokloritni esteri općenito nastaju iz odgovarajućih alkohola, obradom s bilo kojim od niza reagensa (npr. hlor, hipohlorna kiselina, dihlor-monoksid i raznr zakiseljene hipokloritne soli).[1]
Biohemija[uredi | uredi izvor]
Biosintezaorganohlornih spojeva[uredi | uredi izvor]
Hlorperoksidaze su enzimi koji kataliziraju hloriranje organskih spojeva. Ovaj enzim kombinira anorganske supstrate hlorid i vodik-peroksid dajući ekvivalent Cl+, koji zamjenjuje proton u ugljikovodičnom supstratu:
- R-H + Cl− + H2O2 + H+ → R-Cl + 2 H2O
Izvor "Cl+" je hipohlorna kiselina (HOCl).[11] Mnogi organohlorni spojevi su biosintezirani na ovaj način.
Imunski odgovor[uredi | uredi izvor]
Kao odgovor na infekciju, ljudski imunski sistem stvara male količine hipoklorita u posebnim bijelim krvnim ćelijama, zvanim neutrofilni granulociti.[12] Ti granulociti zahvataju viruse i bakterije u unutarćelijskoj vakuoli, koja se naziva fagosom, gdje se probavljaju.
Dio mehanizma za probavu uključuje enzimski posredovani respiracijski odgovor, koji stvara reaktivne spojeve dobijene kisikom, uključujući superoksid (koji proizvodi NADPH-oksidaza). Superoksid se raspada na kisik i vodik-peroksid, koji se koristi u mijeloperoksidazom kataliziranoj reakciji za pretvaranje hlorida u hipohlorit.[13][14][15]
Otkriveno je i da niske koncentracije hipohlorita djeluju u interakciji sa proteinom toplotnog udara mikroba, stimulirajući njihovu ulogu kao unutarćelijskog kaperona (baš poput jajeta koje je skuhano), koji će eventualno uginuti.[16] Ista studija otkrila je da niski (mikromolarni) nivo hipoklorita inducira Escherichia coli i Vibrio cholerae da aktiviraju zaštitni mehanizam, iako njegove implikacije nisu bile jasne.[16]
Industrijska i kućna upotreba[uredi | uredi izvor]
Hipoklorit, posebno natrijski ("tečni bjelilo", "Javolova voda") i kalcijski ("prašak za beljenje") široko se koriste, industrijski i u domaćinstvima za izbjeljivanje odjeće, posvjetljivanje boje kose i uklanjanje boja. Oni su bili prvi komercijalni proizvodi za izbjeljivanje, razvijeni ubrzo nakon što je ta svojstva 1785. otkrio francuski hemičar Claude Berthollet.
Hipohloriti se takođe široko korista kao dezinfekcijska sredstva i dezoderizatori. Aplikacija je započela ubrzo nakon što je francuski apotekar Labarraque otkrio ta svojstva, oko 1820. godine (još prije Pasteura formulirao svoju germ (klicnu) teoriju klica bolesti ).
Laboratorijska upotreba[uredi | uredi izvor]
Oksidansi[uredi | uredi izvor]
Hipoklorit je najjače oksidacijsko sredstvo hlor-oksijanona. To se može vidjeti usporedbom standardnih potencijala selije pola ćelije; podaci takođe pokazuju da su hlorni oksianioni jači oksidanti u kiselim uslovima.
| Ion | Kiselinska reakcija | E° (V) | Neutrala/bazna reakcija | E° (V) |
|---|---|---|---|---|
| Hipohlorit | H+ + HOCl + e− → 1/2 Cl2(g) + H2O | 1,63 | ClO− + H2O + 2 e− → Cl− + 2OH− | 0,89 |
| Hlorit | 3 H+ + HOClO + 3 e− → 1/2 Cl2(g) + 2 H2O | 1n64 | ClO2−+ 2 H2O + 4 e− → Cl− + 4 OH− | 0.78 |
| Hlorat | 6 H+ + ClO3− + 5 e− → 1/2 Cl2(g) + 3 H2O | 1,47 | ClO3− + 3 H2O + 6 e− → Cl− + 6 OH− | 0,63 |
| Perhlorat | 8 H+ + ClO4− + 7 e− → 1/2 Cl2(g) + 4 H2O | 1.42 | ClO4−+ 4 H2O + 8 e− → Cl− + 8 OH− | 0,56 |
Hipoklorit je dovoljno jak oksidans da pretvara Mn (III) u Mn (V) tokom reakcije Jacobsenova epoksidacija i pretvarajući ga iz Ce3+ u Ce4+[9] This oxidising power is what makes them effective bleaching agents and disinfectants.
U organskoj hemiji hipokloriti mogu se koristiti za oksidaciju primarnog alkohola s u karboksilne kiseline.[17]
Hlorirajući agensi[uredi | uredi izvor]
Hipokloritne soli mogu također služiti kao hlorirajući agensi. Naprimjer, oni pretvaraju fenole u hlorofenole. Kalcij-hipoklorit pretvara piperidin u N -hloropiperidin.
Srodni oksianioni[uredi | uredi izvor]
Hlor može biti jezgro oksoaniona s oksidacijskim stanjima od -1, +1, +3, +5 ili +7. (Element također može pretpostaviti da je oksidacijsko stanje +4 vidljivo u neutralnom spoju hlor-dioksid, ClO2).
| Oksidacijsko stanje hlora | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| Ime | Hlorid | Hipohlorit | Hlorit | Hlorat | Perhlorat |
| Formula | Cl− | ClO− | ClO2− | ClO3− | ClO4− |
| Struktura | 
|

|

|
Također pogledajte[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ a b Mintz, M. J.; C. Walling (1969). "t-Butyl hypochlorite". Organic Syntheses. 49: 9. doi:10.15227/orgsyn.049.0009.
- ^ Inorganic chemistry, Egon Wiberg, Nils Wiberg, Arnold Frederick Holleman, "Hypochlorous acid", p. 442, section 4.3.1
- ^ a b Aylett, founded by A.F. Holleman ; continued by Egon Wiberg ; translated by Mary Eagleson, William Brewer ; revised by Bernhard J. (2001). Inorganic chemistry (1st English ed., [edited] by Nils Wiberg. izd.). San Diego, Calif. : Berlin: Academic Press, W. de Gruyter. str. 444. ISBN 978-0123526519.
- ^ Ropp, Richard (2012). Encyclopedia of the Alkaline Earth Compounds. Newnes. str. 76. ISBN 978-0444595539.
- ^ Ropp, Richard C. (31. 12. 2012). Encyclopedia of the alkaline earth compounds. Oxford: Elsevier Science. str. 75. ISBN 978-0444595539.
- ^ Clancey, V.J. (1975). "Fire hazards of calcium hypochlorite". Journal of Hazardous Materials. 1 (1): 83–94. doi:10.1016/0304-3894(75)85015-1.
- ^ Brauer, G. (1963). Handbook of Preparative Inorganic Chemistry; Vol. 1 (2nd izd.). Academic Press. str. 309.
- ^ Vickery, R. C. (1. 4. 1950). "Some reactions of cerium and other rare earths with chlorine and hypochlorite". Journal of the Society of Chemical Industry. 69 (4): 122–125. doi:10.1002/jctb.5000690411.
- ^ a b V. R. Sastri; et al. (2003). Modern Aspects of Rare Earths and their Complexes (1st izd.). Burlington: Elsevier. str. 38. ISBN 978-0080536682.
- ^ Simpkins, Nigel S.; Cha, Jin K. (2006). "t-Butyl Hypochlorite". Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rb388.pub2. ISBN 0471936235.
- ^ Hofrichter, M.; Ullrich, R.; Pecyna, Marek J.; Liers, Christiane; Lundell, Taina (2010). "New and classic families of secreted fungal heme peroxidases". Appl Microbiol Biotechnol. 87 (3): 871–897. doi:10.1007/s00253-010-2633-0. PMID 20495915.
- ^ Marcinkiewicz, Janusz; Kontny, Ewa (2014). "Taurine and inflammatory diseases". Amino Acids. 46 (1): 7–20. doi:10.1007/s00726-012-1361-4. PMC 3894431. PMID 22810731.
- ^ Harrison, J. E.; J. Schultz (1976). "Studies on the chlorinating activity of myeloperoxidase". Journal of Biological Chemistry. 251 (5): 1371–1374. PMID 176150.
- ^ Thomas, E. L. (1979). "Myeloperoxidase, hydrogen peroxide, chloride antimicrobial system: Nitrogen-chlorine derivatives of bacterial components in bactericidal action against Escherichia coli". Infect. Immun. 23 (2): 522–531. doi:10.1128/IAI.23.2.522-531.1979. PMC 414195. PMID 217834.
- ^ Albrich, JM; McCarthy, CA; Hurst, JK (januar 1981). "Biological reactivity of hypochlorous acid: implications for microbicidal mechanisms of leukocyte myeloperoxidase". Proceedings of the National Academy of Sciences of the United States of America. 78 (1): 210–4. Bibcode:1981PNAS...78..210A. doi:10.1073/pnas.78.1.210. PMC 319021. PMID 6264434.
- ^ a b Jakob, U.; J. Winter; M. Ilbert; P.C.F. Graf; D. Özcelik (14. 11. 2008). "Bleach Activates A Redox-Regulated Chaperone by Oxidative Protein Unfolding". Cell. Elsevier. 135 (4): 691–701. doi:10.1016/j.cell.2008.09.024. PMC 2606091. PMID 19013278. Pristupljeno 19. 11. 2008.
- ^ Warren, Jonathan Clayden, Nick Greeves, Stuart (15. 3. 2012). Organic chemistry (2nd izd.). Oxford: Oxford University Press. str. 195. ISBN 978-0-19-927029-3.

