Koagulacija (krv)
| Koagulacija | |
|---|---|
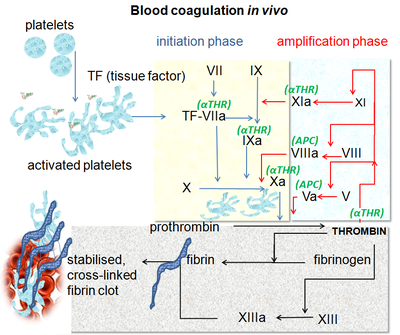 | |
| Putevi koagulacije krvi in vivo pokazuju centralnu ulogu trombina | |
| Frekvencija | Uobičajena |
Koagulacija, također poznata kao zgrušavanje, je proces kojim krv prelazi iz tečnosti u gel, formirajući krvni ugrušak. To potencijalno rezultira hemostazom, prestankom gubitka krvi iz oštećenog suda, nakon čega slijedi popravak. Mehanizam koagulacije uključuje aktivaciju, adheziju i agregaciju trombocita, kao i taloženje i sazrijevanje fibrina.
Koagulacija počinje skoro trenutno nakon povrede endotela koji oblaže krvni sud. Izlaganje krvi subendotelnom prostoru pokreće dva procesa: promjene u trombocitima i izlaganje subendotelnog tkivnog faktora plazmi faktora VII, što na kraju dovodi do stvaranja umreženog fibrina. Trombociti odmah formiraju čep na mjestu povrede; ovo se zove "primarna hemostaza". Sekundarna hemostaza se dešava istovremeno: dodatni faktori koagulacije (zgrušavanja) izvan faktora VII (navedeni u nastavku) reaguju u kaskadi, formirajući fibrinske niti, koji jačaju trombocitni čep.[1]
Poremećaji koagulacije su bolesna stanja koja mogu dovesti do problema sa hemoragijom, modricama ili trombozom.[2]
Koagulacija je visoko konzervirana kroz biološku evoluciju. Kod svih sisara, koagulacija uključuje i ćelijske komponente (trombociti) i proteinkisle komponente (ovdje, faktori koagulacije).[3] Koagulacijski put u ljudi je najopsežnije istražen i najbolje je shvaćen.[4]
Fiziologija[uredi | uredi izvor]

Aktivacija trombocita[uredi | uredi izvor]
Kada je endotel oštećen, normalno izolovani osnovni kolagen izložen je cirkulišućim trombocitima, koji se direktno vezuju za kolagen pomoću površinskih receptora glikoprotein Ia/IIa specifičnih za kolagen. Ovu adheziju dodatno ojačava von Willebrand faktor (vWF), koji se oslobađa iz endotela i iz trombocita; vWF formira dodatne veze između trombocitnog glikoproteina Ib/IX/V i domena A1. ]Ova lokalizacija trombocita u vanćelijskom matriksuekstracelularnom matriksu podstiče interakciju kolagena sa trombocitnimm glikoproteinom VI. Vezivanje kolagena za glikoprotein VI pokreće signalnu kaskadu koja rezultira aktivacijom trombocitnog integrina. Aktivirani integrini posreduju čvrsto vezivanje trombocita za vanćelijski matriks. Ovim procesom se trombociti lijepe na mjesto ozljede.[5]
Aktivirani trombociti oslobađaju sadržaj uskladištenih granula u krvnu plazmu. Granule uključuju ADP, serotonin, faktor aktivacije trombocita (PAF), vWF, trombocitni faktor 4 i [ [Tromboksan A2|tromboksan A2]] (TXA2), koji zauzvrat aktivira dodatne trombocite. Sadržaj granula aktivira kaskadu Gq-vezani proteinski receptor, što rezultira povećanom koncentracijom kalcija u citosolu trombocita. Kalcij aktivira protein-kinazu C, koja zauzvrat aktivira fosfolipazu A2 (PLA2). PLA2 zatim modifikuje integrin membranu glikoprotein IIb/IIIa, povećavajući njen afinitet za vezivanje fibrinogena. Aktivirani trombociti mijenjaju oblik iz sfernog u zvjezdasti, a fibrinogenske poprečne veze sa glikoproteinom IIb/IIIa pomažu u agregaciji susjednih trombocita (završavanje primarne hemostaze).[6]
Koagulacijska kaskada[uredi | uredi izvor]


Koagulacijska kaskada sekundarne hemostaze ima dva početna puta koja dovode do formiranja fibrina. To su "put kontaktne aktivacije" (također poznat kao unutrašnji put) i "put tkivnog faktora" (također poznat kao vanjski put); oba vode do istih temeljnih reakcija koje proizvode fibrin. Ranije se smatralo da su dva puta koagulacijske kaskade podjednako važna, ali je sada poznato da je primarni put za iniciranje koagulacije krvi „tkivni faktor“ (vanjski) put. Putevi su niz reakcija u kojima se zimogen (neaktivni prekursor enzima) serin-proteaza i njen glikoproteinski kofaktor aktiviraju da postanu aktivne komponente koje zatim kataliziraju sljedeće reakcija u kaskadi, što na kraju rezultira umreženim fibrinom. Faktori koagulacije su općenito označeni rimskim brojevimas, s malim slovom a koji označava aktivni oblik.[7]
Faktori koagulacije su općenito enzimi zvani serin-proteaze, koji djeluju cijepanjem nizvodnih proteina. Izuzetak su tkivni faktor, FV, FVIII, FXIII.[8] Tkivni faktori, FV i FVIII su glikoproteini, a faktor XIII je transglutaminaza.[7] Faktori koagulacije cirkulišu kao neaktivni zimogeni. Kaskada koagulacije je stoga klasično podijeljena na tri puta. Putevi tkivnog faktora i aktivacije kontakta aktiviraju konačni zajednički put faktora X, trombina i fibrina.[9]
Put tkivnog faktora (vanjski)[uredi | uredi izvor]
Glavna uloga tkivnog faktora (TF) puta je da generiše "trombinski prasak", proces kojim je trombin, najvažniji sastojak kaskade koagulacije u smislu njegovih povratnih aktivacijskih uloga pušten veoma brzo. FVIIa cirkuliše u većoj količini nego bilo koji drugi aktivirani faktor koagulacije. Proces uključuje sljedeće korake:[7]
- Nakon oštećenja krvnog suda, FVII napušta cirkulaciju i dolazi u kontakt sa tkivnim faktorom izraženim na ćelijama koje nose tkivni faktor (stromal fibroblasti i leukociti), formirajući aktivirani kompleks (TF-FVIIa ).
- TF-FVIIa aktivira FIX i FX.
- FVII se sam aktivira od strane trombina, FXIa, FXII i FXa.
- Aktivacija FX (za formiranje FXa) pomoću TF-FVIIa je skoro odmah inhibirana inhibitor puta tkivnog faktora (TFPI).
- FXa i njegov kofaktor FVa formiraju protrombinaza kompleks, koji aktivira protrombin u trombin.
- Trombin zatim aktivira druge komponente kaskade koagulacije, uključujući FV i FVIII (koji formira kompleks sa FIX), i aktivira i oslobađa FVIII od vezivanja za vWF.
- FVIIIa je kofaktor FIXa, i zajedno čine "tenase" kompleks, koji aktivira FX; i tako se ciklus nastavlja. ("Tenaza" je kontrakcija od "deset" i sufiksa "-ase" koji se koristi za enzime.)
Put aktivacije kontakta (unutrašnji)[uredi | uredi izvor]
Put aktivacije kontakta počinje formiranjem primarnog kompleksa na kolagenu, pomoću kininogena visoke molekularne težine (HMWK), prekalikreina i FXII (Hagemanovog faktora). Prekalikrein se pretvara u kalikrein i FXII postaje FXIIa. FXIIa pretvara FXI u FXIa. Faktor XIa aktivira FIX, koji sa svojim kofaktorom FVIIIa formira tenazni kompleks, koji aktivira FX do FXa. Manju ulogu koju kontaktni aktivacijski put ima u pokretanju formiranja ugruška može se ilustrovati činjenicom da osobe s teškim nedostatkom FXII, HMWK i prekalikreina nemaju poremećaj krvarenja. Umjesto toga, čini se da je sistem kontaktne aktivacije više uključen u upale,[7] i urođenu imunost.[10] Uprkos tome, ometanje puta može pružiti zaštitu od tromboze, bez značajnog rizika od krvarenja.[10]
Konačni zajednički put[uredi | uredi izvor]
Podjela koagulacije na dva puta je proizvoljna, a proizilazi iz laboratorijskih testova u kojima su mjerena vremena zgrušavanja bilo nakon što je zgrušavanje inicirano staklom, unutrašnjim putem; ili je zgrušavanje inicirano tromboplastinom (mješavina tkivnog faktora i fosfolipida), vanjskim putem.
Nadalje, konačna shema zajedničkog puta implicira da se protrombin pretvara u trombin samo kada na njega djeluju unutrašnji ili vanjski putevi, što je previše pojednostavljeno. U stvari, trombin se stvara aktiviranim trombocitima na početku trombocitnog čepa, što zauzvrat podstiče veću aktivaciju trombocita.
Trombin funkcioniše ne samo da pretvara fibrinogen u fibrin, on također aktivira faktore VIII i V i njihov inhibitor protein C (u prisustvu trombomodulina); aktivira i faktor XIII, koji formira kovalentne veze koje poprečno povezuju fibrinske polimere nastale iz aktiviranih monomera.[7]
Kaskada koagulacije održava se u protrombotskom stanju kontinuiranom aktivacijom FVIII i FIX kako bi se formirao tenazni kompleks, sve dok se ne reguliše putem antikoagulansnih puteva.[7]
Shema koagulacije zasnovane na ćelijama[uredi | uredi izvor]
Noviji model mehanizma koagulacije objašnjava zamršenu kombinaciju ćelijskih i biohemijskih događaja koji se dešavaju tokom procesa koagulacije in vivo. Uz prokoagulantne i antikoagulantne proteine plazme, normalna fiziološka koagulacija zahtijeva prisustvo dva tipa ćelija za formiranje koagulacionih kompleksa: ćelije koje eksprimiraju tkivni faktor (obično vanćelijski) i trombocita.
Proces koagulacije odvija se u dvije faze. Prva je faza inicijacije, koja se javlja u ćelijama koje eksprimiraju tkivni faktor. Nakon toga slijedi faza propagacije, koja se javlja na aktiviranim trombocitima. Faza inicijacije, posredovana izlaganjem tkivnom faktoru, odvija se klasičnim vanjskim putem i doprinosi oko 5% proizvodnje trombina. Pojačana proizvodnja trombina događa se klasičnim unutrašnim putem u fazi propagacije; oko 95% trombina generiraće se tokom ove druge faze.[11]
Za funkcioniranje kompleksa potrebni su tenaza i protrombinaza, kalcij i fosfolipidi (sastojci trombocitne membrane) [12] Kalcij posreduje u vezivanju kompleksa, preko terminalnih gama-karboksi ostataka na faktoru Xa i faktoru IXa za fosfolipidne površine izražene trombocitima, kao i prokoagulantne mikročestice ili mikrovezikule izlučene iz njih.[13] Kalcijum je također neophodan i na drugim tačkama kaskade koagulacije. Kalcijevi ioni imaju glavnu ulogu u regulaciji kaskade koagulacije, koja je najvažnija u održavanju hemostaze. Osim aktivacije trombocita, ioni kalcija odgovorni su za potpunu aktivaciju nekoliko faktora koagulacije, uključujući i faktor koagulacije XIII.[14]
Vitamin K[uredi | uredi izvor]
Vitamin K je esencijalni faktor jetrene gama-glutamil karboksilaze, koji dodaje karboksilnu grupu na ostatke glutaminske kiseline na faktorima II, VII, IX i X, kao i protein S , protein C i protein Z. Dodavanjem gama-karboksilne grupe ostacima glutamata na nezrelim faktorima zgrušavanja, sam vitamin K se oksidira. Drugi enzim, vitamin K epoksid-reduktaza (VKORC), reducira vitamin K nazad u njegov aktivni oblik. Vitamin K epoksid-reduktaza je farmakološki važna kao meta antikoagulansa varfarina i srodnih kumarina, kao što su acenokumarol, fenprokumon i dikumarol. Ovi lijekovi stvaraju manjak smanjenog vitamina K, blokiranjem VKORC, čime se inhibira sazrijevanje faktora zgrušavanja. Nedostatak vitamina K iz drugih uzroka (npr. malapsorpcija) ili poremećeni metabolizam vitamina K u bolesti (npr. zatajenje jetre) dovode do stvaranja PIVKA (proteina nastalih u nedostatku vitamina K), koji su djelomično ili potpuno ne-gama karboksilirani, utičući na sposobnost faktora koagulacije da se vežu za fosfolipide.
Regulatori[uredi | uredi izvor]

Pet mehanizama drži pod kontrolom aktivaciju trombocita i kaskadu koagulacije. Abnormalnosti mogu dovesti do povećane sklonosti trombozi:
Protein C[uredi | uredi izvor]
Protein C je glavni fiziološki antikoagulant. To je vitamin K- zavisni enzim serin proteaza koji se aktivira trombinom u aktivirani protein C (APC). Protein C se aktivira u sekvenci koja počinje vezivanjem proteina C i trombina za protein ćelijske površine trombomodulin. Trombomodulin veže ove proteine na način da aktivira protein C. Aktivirani oblik, zajedno sa proteinom S i fosfolipidom kao kofaktorima, razgrađuje FVa i FVIIIa. Kvantitativni ili kvalitativni nedostatak bilo kojeg (proteina C ili proteina S) može dovesti do trombofilije (sklonosti razvoju tromboze). Oslabljeno djelovanje proteina C (aktivirana otpornost na protein C), na primjer koji ima "Leiden" varijantu faktora V ili visoke razine FVIII, također može dovesti do sklonosti trombozi.
Antitrombin[uredi | uredi izvor]
Antitrombin je inhibitor serin-proteaze (serpin) koji razgrađuje serinske proteaze: trombin, FIXa, FXa, FXIa i FXIIa. Stalno je aktivan, ali njegova adhezija na ove faktore se povećava prisustvom heparan sulfat (glikozaminoglikan) ili primenom heparina (različiti heparinoidi povećavaju afinitet prema FXa, trombin , ili oboje). Kvantitativni ili kvalitativni nedostatak antitrombina (urođeni ili stečeni, npr. u proteinuriji) dovodi do trombofilije.
Inhibitor putanje tkivnog faktora (TFPI)[uredi | uredi izvor]
Inhibitor putanje tkivnog faktora (TFPI) ograničava djelovanje tkivnog faktora (TF). Takođe inhibira prekomjernu TF posredovanu aktivaciju FVII i FX.
Plazmin[uredi | uredi izvor]
Plazmin nastaje proteolitskim cijepanjem plazminogena, proteina plazme koji se sintetizira u jetri. Ovo cijepanje katalizira aktivator tkivnog plazminogena (t-PA), koji se sintetiše i izlučuje endotelno. Plazmin proteolitski cijepa fibrin u produkte razgradnje fibrina koji inhibiraju prekomjerno stvaranje fibrina.
Prostaciklin[uredi | uredi izvor]
Prostaciklin (PGI2) oslobađa endotel i aktivira Gs receptore vezane za proteine trombocita. Ovo zauzvrat aktivira adenilil-ciklazu, koja sintetiše cAMP. cAMP inhibira aktivaciju trombocita, smanjenjem citosolnog nivoa kalcija i na taj način inhibira oslobađanje granula koje bi dovelo do aktivacije dodatnih trombocita i koagulacijske kaskade.[15]
Fibrinoliza[uredi | uredi izvor]
Na kraju, krvni ugrušci se reorganiziraju i resorbiraju procesom koji se naziva fibrinoliza. Glavni enzim odgovoran za ovaj proces (plazmin) je reguliran raznim aktivatorima i inhibitorima.[15]
Uloga u imunskom sistemu[uredi | uredi izvor]
Sistem koagulacije preklapa se sa imunskim sistemom. Koagulacija može fizički zarobiti invazivne mikrobe u krvnim ugrušcima. Također, neki proizvodi koagulacijskog sistema mogu doprineti urođenom imunskom sistemu, svojom sposobnošću da povećaju vaskularnu permeabilnost i deluju kao hemotaksijski agens za fagocitne ćelije. Pored toga, neki od proizvoda koagulacijakog sistema su direktno antimikrobni. Naprimjer, beta-lizin, aminokiselina koju trombociti proizvode tokom koagulacije, može uzrokovati lizu mnogih Gram-pozitivnih bakterija, djelujući kao kationski deterdžent.[16] Mnogi upalni proteini akutne faze uključeni su u sistem koagulacije. Uz to, patogene bakterije mogu lučiti agense koji mijenjaju koagulacijski sistem, npr. koagulaza i streptokinaza.
Procjena[uredi | uredi izvor]
Za procjenu funkcije koagulacijskog sistema koriste se brojni testoviSistem koagulacije preklapa se sa imunskim sistemom. Koagulacija može fizički zarobiti invazivne mikrobe u krvnim ugrušcima. Također, neki proizvodi koagulacijskog sistema mogu doprineti urođenom imunskom sistemu, svojom sposobnošću da povećaju vaskularnu permeabilnost i deluju kao hemotaktički agens za fagocitne ćelijes. Pored toga, neki od proizvoda koagulacionog sistema su direktno antimikrobni. Na primjer, beta-lizin, aminokiselina koju trombociti proizvode tokom koagulacije, može uzrokovati lizu mnogih Gram-pozitivnih bakterija djelujući kao kationski deterdžent.[16] Many acute-phase proteins of inflammation are involved in the coagulation system. In addition, pathogenic bacteria may secrete agents that alter the coagulation system, e.g. coagulase and streptokinase.[nedostaje referenca]
- Uobičajeno: aPTT, PT (također se koristi za određivanje INR), fibrinogensko testiranje (često Claussov metod), broj trombocit a, testiranje funkcije trombocita (često pomoću PFA-100), trombodinamičkog testa.
- Ostalo: TCT, vrijeme krvarenja, test miješanja (da li se abnormalnost ispravlja ako je plazma pacijenta pomiješana sa normalnom plazmom), testovi faktora koagulacije, antifosfolipidna antitijela, D-dimer, genetički testovi (npr. faktor V Leiden, protrombin mutacija G20210A), razrijedno vrijeme otrova Russellove zmije (dRVVT), razni trombocitni funkcionalni testovi, tromboelastografija (TEG ili Sonoclot), vrijeme lize euglobulina (ELT).
Kontaktni aktivacijski (unutrašnji) put pokreće se aktivacijom "kontaktnih faktora" plazme, a može se mjeriti aktiviranim parcijalnim tromboplastinskim testom vremena (aPTT).
Put tkivnog faktora (vanjskog) pokreće se oslobađanjem tkivnog faktora (specifičnog ćelijskog lipoproteina), a može se izmjeriti testom protrombinskog vremena (PT). PT rezultati se često prijavljuju kao omjer (INR vrijednost) za praćenje doziranja oralnih antikoagulanasa kao što je varfarin.
Kvantitativni i kvalitativni skrining fibrinogena mjeri se vremenom zgrušavanje trombocita (TCT). Merenje tačne količine fibrinogena u krvi vrši se obično pomoću Claussovog metoda za testiranje fibrinogena. Mnogi analizatori su sposobni da izmjere nivo "izvedenog fibrinogena" iz grafikona ugruška protrombinskog vremena. Ako je faktor koagulacije dio puta kontaktne aktivacije ili tkivnog faktora, nedostatak tog faktora će uticati na samo jedan od testova: dakle hemofilija A, nedostatak faktora VIII, koji je dio puta kontaktne aktivacije, rezultira abnormalno produženim aPTT testom, ali normalnim PT testom. Izuzetak su protrombin, fibrinogen i neke varijante FX, koje se mogu otkriti samo pomoću aPTT ili PT. Ako je prisutan abnormalni PT ili aPTT, izvršit će se dodatno testiranje, kako bi se utvrdilo koji je (ako postoji) faktor prisutan u aberantnoj koncentraciji.
Nedostaci fibrinogena (kvantitativni ili kvalitativni) će uticati na sve skrining testove.
Klinički značaj[uredi | uredi izvor]
Defekti koagulacije mogu uzrokovati krvarenje ili trombozu, a povremeno i jedno i drugo, ovisno o prirodi defekta..[18]

Poremećaji trombocita[uredi | uredi izvor]
Poremećaji trombocita su urođeni ili stečeni. Primjeri kongenitalnih poremećaja trombocita su Glanzmannova trombastenija, Bernard-Soulierov sindrom (abnormalni glikoproteinski Ib-IX-V kompleks), sindrom sivih trombocita (nedostatak alfa granula), i nedostatak delta skladišnog bazena (deficit guste granule). Većina je rijetka. Predisponiraju za krvarenje. Von Willebrandova bolest nastaje zbog nedostatka ili abnormalne funkcije von Willebrandovog faktora i dovodi do sličnog obrasca krvarenja; njeni blaži oblici su relativno česti.
Smanjenje broja trombocita (trombocitopenija) je zbog nedovoljne proizvodnje (npr. mijelodisplazijski sindrom ili drugi poremećaji koštane srži), uništenja od strane imunoskog sistema (imunska trombocitopenija purpura) ili konzumiranja (npr. trombotska trombocitopenija purpura, hemolitsko-uremijski sindrom, paroksizomna noćna hemoglobinurija, diseminirana intravaskularna koagulacija, trombocitopenija izazvana heparinom).[19] Povećanje broja trombocita koje dovodi do povećanog rizika od tromboze naziva se trombocitoza, što može dovesti do stvaranja tromboembolije.
Poremećaji faktora koagulacije[uredi | uredi izvor]
Najpoznatiji poremećaji faktora koagulacije su hemofilija. Tri glavna oblika su hemofilija A (nedostatak faktora VIII), hemofilija B (nedostatak faktora IX ili " Christmasova bolest") i hemofilija C (nedostatak faktora XI, blaga sklonost krvarenju).
Von Willebrandova bolest (koja se ponaša više kao poremećaj trombocita osim u teškim slučajevima), najčešći je nasljedni poremećaj krvarenja i karakterizira se kao naslijeđen autosomno recesivna ili dominantna. Kod ove bolesti postoji defekt von Willebrandovog faktora (vWF), koji posreduje u vezivanju glikoproteina Ib (GPIb) za kolagen. Ovo vezivanje pomaže u posredovanju u aktivaciji trombocita i formiranju primarne hemostaze.
U akutnom ili hroničnom zatajenju jetre, ne postoji dovoljna proizvodnja faktora koagulacije, što može povećati rizik od krvarenja tokom operacije.[20]
Tromboza je patološki razvoj krvnih ugrušaka. Ti se ugrušci mogu osloboditi i postati pokretni, stvarajući embolus ili narasti do takve veličine da začepe krvni sud u kojem se razvio. Krvotok|Kaže se da embolija nastaje kada tromb (krvni ugrušak) postane mobilni embolus i migrira u drugi dio tijela, ometajući cirkulaciju krvi i time oštećujući funkciju organa nizvodno od okluzije. To uzrokuje ishemiju i često dovodi do ishemijskih nekroza tkiva. Većina slučajeva venske tromboze posljedica je stečenih stanja (starija dob, operacija, rak, nepokretnost) ili nasljednih trombofilija (npr. antifosfolipidni sindrom, Leidenski faktor V, i razni drugi genetički nedostaci ili varijante).
Farmakologija[uredi | uredi izvor]
Prokoagulansi[uredi | uredi izvor]
Upotreba adsorbenata hemikalija, kao što su zeoliti drugi hemostatici također se koriste za brzo brtvljenje teških ozljeda (kao što je traumatsko krvarenje sekundarno nakon rana od vatrenog oružja). Trombinsko i fibrinsko ljepilo koriste se hirurški za liječenje krvarenja i trombozne aneurizme. Hemostatski prašak u spreju TC-325 koristi se za liječenje gastrointestinalnog krvarenja.
Dezmopresin se koristi za poboljšanje funkcije trombocita, aktiviranjem arginin-vazopresin receptora 1A.
Koncentrati faktora zgrušavanja koriste se za liječenje hemofilija, za poništavanje učinaka antikoagulansa i za liječenje krvarenja kod osoba s oštećenom sintezom faktora zgrušavanja ili povećanom konzumacijom. Koncentrat protrombinskog kompleksa, krioprecipitat i svježe smrznuta plazma često su korišteni proizvodi faktora koagulacije. Rekombinantno aktivirani ljudski faktor VII sve je popularniji u liječenju velikih krvarenja.
Traneksaminska kiselina i aminokapronska kiselina inhibiraju fibrinolizu i dovode do de facto smanjene stope krvarenja. Prije povlačenja, aprotinin se koristio u nekim oblicima velikih operacija, kako bi se smanjio rizik od krvarenja i potreba za krvnim pripravcima.

Antikoagulansi[uredi | uredi izvor]
Antikoagulansi i lijekovi protiv trombocita su među najčešće korištenim lijekovima. Agensi protiv trombocita uključuju aspirin, dipiridamol, tiklopidin, klopidogrel, ticagrelor i prasugrel; parenteralni inhibitori glikoproteina IIb/IIIa koriste se tokom angioplastika. Od antikoagulansa najčešće se koriste varfarin (i srodni kumarini heparin. Varfarin utiče na faktore zgrušavanja ovisne o vitaminu K (II, VII, IX, X) te protein C i protein S, dok heparin i srodni spojevi pojačavaju djelovanje antitrombina na trombin i faktor Xa. U razvoju je novija klasa lijekova, direktni inhibitori trombina; neki su članovi već u kliničkoj uporabi (kao što je lepirudin). U kliničkoj su uporabi su i drugi malomolekulski spojevi, koji izravno ometaju enzimsko djelovanje određenih faktorka zgrušavanja (direktno djelujući oralni antikoagulansi: dabigatran, rivaroksaban, apiksaban i edoksaban).[21]
Lista faktora koagulacije[uredi | uredi izvor]
| Broj i/ili ime(na) | Funkcija | Pridruženi genetički poremećaji |
|---|---|---|
| Faktor I (fibrinogen) | Stvara fibrinske niti (ugrušak) | Kongenitalna afibrinogenemija, Obiteljska renalna amiloidoza |
| Faktor II (protrombin) | Njegov aktivni oblik (IIa) aktivira trombocite, faktore I, V, VII, VIII, XI, XIII, protein C | Protrombin G20210A, Trombofilija |
| Faktor III (tkivni faktor, tkivni tromboplastin) | Kofaktor faktora VIIa, koji je prije bio poznat kao faktor III | |
| Faktor IV (kalcijev ion) | Potreban za faktore koagulacije da se vežu na fosfolipide, koji su prije bili poznati kao faktor IV | |
| Faktor V (proakcelerin, labilni faktor, Ac-globulin) | Kofaktor faktora X s kojim tvori kompleks protrombinaza | Aktivirana otpornost na protein C |
| Faktor VI | Nedodijeljeno – stari naziv faktora Va | |
| Faktor VII (stabilni faktor, prokonvertin, serumski akcelerator pretvorbe protrombina (SPCA)) | Aktivira faktore IX, X; povećava brzinu katalitske pretvorbe protrombina u trombin | Kongenitalni nedostatak faktora VII |
| Faktor VIII (antihemofilijski faktor A, antihemofiijski faktor (AHF), antihemofilijski globulin (AHG) ) | Kofaktor faktora IX s kojim tvori kompleks tenaza | Hemofilija A |
| Faktor IX (antihemofilijski faktor B, Christmasov faktor, tromboplastinska komponenta plazme (PTC)) | Aktivira faktor X, stvara kompleks tenaza s faktorom VIII | Hemofilija B |
| Faktor X (Stuart-Prowerov faktor, Stuartov faktor) | Aktivira faktor II, stvara kompleks protrombinaza s faktorom V | Kongenitalni nedostatak faktora X |
| Faktor XI (plazma tromboplastinski antecedent (PTA), antihemofilijski faktor C) | Aktivira faktor IX | Hemofilija C |
| Faktor XII (Hagemanov faktor) | Aktivira XI, VII, prekalikrein i plazminogen | Nasljedni angioedem tip III |
| Faktor XIII (faktor stabilizacije fibrina) | Povezuje fibrinske niti | Kongenitalni nedostatak faktora XIIIa/b |
| von Willebrandov faktor | Veže se za VIII, posreduje u adheziji trombocita | von Willebrandova bolest |
| Prekalikrein (Fletcherov faktor) | Aktivira faktor XII i prekalikrein; cijepa HMWK | Nedostatak prekalikreina/Fletcherovog faktora |
| Kallikrein | Aktivira plazminogen | |
| Kininogen visoke molekulske težine (HMWK) (Fitzgeraldov faktor) | Podržava recipročnu aktivaciju faktora XII, XI i prekalikreina | Nedostatak kininogena |
| Fibronektin | Posreduje ćelijsku adheziju | Glomerulopatija s naslagama fibronektina |
| Antitrombin III | Inhibira faktore IIa, Xa, IXa, XIa i XIIa | Nedostatak antitrombina III |
| Heparinski kofaktor II | Inhibira faktor IIa, kofaktor za heparin i dermatan-sulfat ("manji antitrombin") | Nedostatak heparinskog kofaktora II |
| Protein C | Inaktivira faktore Va i VIIIa | Nedostatak proteina C |
| Protein S | Kofaktor za aktivirani protein C (APC, neaktivan kada se veže na C4b-vezujući protein) | Nedostatak proteina S |
| Protein Z | Posreduje adheziju trombina na fosfolipide i stimulira razgradnju faktora X pomoću ZPI | Nedostatak proteina Z |
| Inhibitor proteaze povezan s proteinom Z (ZPI) | Razgrađuje faktore X (u prisutnosti proteina Z) i XI (neovisno) | |
| Plazminogen | Pretvara se u plazmin, lizira fibrin i druge proteine | Nedostatak plazminogena, tip I (lignozni konjunktivitis) |
| α2-antiplazmin | Inhibira plazmin | Nedostatak antiplazmina |
| α2-makroglobulin | Inhibira plazmin, kalikrein i trombin | |
| Aktivator tkivnog plazminogena (tPA) | Aktivira plazminogen | Porodična hiperfibrinoliza i trombofilija |
| Urokinaza | Aktivira plazminogen | Quebečki poremećaj trombocita |
| Inhibitor aktivatora plazminogena-1 (PAI-1) | Inaktivira tPA i urokinazu (endotelni PAI) | Nedostatak inhibitora aktivatora plazminogena-1 |
| Inhibitor aktivatora plazminogena-2 (PAI-2) | Inaktivira tPA i urokinazu (placentni l PAI) | |
| Prokoagulant raka | Patološki aktivator faktora X povezan s trombozom kod kancer a |
Historija[uredi | uredi izvor]
Prva otkrića[uredi | uredi izvor]
Teorije o zgrušavanju krvi postoje od davnina. Fiziolog Johannes Müller (1801. – 1858.) opisao je fibrin, tvar tromba. Njegov topljivi prekursor, fibrinogen, tako je nazvao Rudolf Virchow (1821-1902), a hemijski ga je izolirao Prosper Sylvain Denis (1799-1863). Alexander Schmidt sugerirao je da je pretvorba iz fibrinogena u fibrin rezultat enzimskog procesa i označio je hipotetski enzim "trombin" i njegov prekursor " protrombin".[22][23] Arthus discovered in 1890 that calcium was essential in coagulation.[24][25] Platelets were identified in 1865, and their function was elucidated by Giulio Bizzozero in 1882.[26]
Teoriju da trombin stvara prisustvo tkivnog faktora konsolidirao je Paul Morawitz 1905.[27] U ovoj fazi bilo je poznato da trombokinazu/tromboplastin (faktor III) oslobađaju oštećena tkiva, reagirajući s protrombinom (II), koji zajedno s kalcijem ( IV), stvara trombin, koji pretvara fibrinogen u fibrin (I).[28]
Koagulacijski faktori[uredi | uredi izvor]
Ostali biohemijski faktori u procesu koagulacije uglavnom su otkriveni u 20. stoljeću. Prvi trag o stvarnoj složenosti sistema koagulacije bilo je otkriće "proakcelerina" (u početku, a kasnije nazvanog faktor V) od strane Paula Owrena (1905. – 1990.) 1947. godine. također je pretpostavio da je njegova funkcija stvaranje akcelerina (faktor VI), za koji se kasnije ispostavilo da je aktivirani oblik V (ili Va); dakle, VI sada nije u aktivnoj uporabi.[28]
Faktor VII (također poznat kao akcelerator pretvorbe protrombina u serumu ili prokonvertin, istaložen barij-sulfatom) otkriven je kod mlade pacijentice 1949. i 1951. od strane različitih skupina.
Pokazalo se da faktor VIII ima nedostatak u klinički prepoznatoj, ali etiološki nedokučivoj hemofiliji A; identificiran je 1950-ih i alternativno se naziva antihemofiijski globulin zbog svoje sposobnosti ispravljanja hemofilije A.[28]
Faktor IX otkriven je 1952. kod mladog pacijenta s hemofilijom B po imenu Stephen Christmas (1947. – 1993.). Njegov nedostatak opisali su dr. Rosemary Biggs i profesor R.G. MacFarlane u Oxfordu, UK. Faktor se stoga naziva Christmasov faktor. Christmas je živio u Kanadi i zalagao se za sigurnost transfuzija krvi, sve dok nije podlegao AIDS-u,u dobi od 46 godina. Alternativni naziv za faktor je "komponenta plazmnatskog tromboplastina", koji je dala nezavisna skupina u Kaliforniji.[28]
Hagemanov faktor, sada poznat kao faktor XII, identificiran je 1955. kod asimptomskog pacijenta s produženim vremenom krvarenja po imenu John Hageman. Otkroiće faktora X ili Stuart-Prowerovog faktora, uslijedilo je 1956. godine. Ovaj protein je identificiran kod gospođe Audrey Prower iz Londona, koja je doživotno imala sklonost krvarenju. Godine 1957. jedna je američka grupa identificirala isti faktor kod Rufusa Stuarta. Faktori XI i XIII identificirani su 1953. odnosno 1961. godine.[28] Gledište da je proces koagulacije "kaskada" ili "vodopad" iznijeli su gotovo istodobno MacFarlane [29] u Velikoj Britaniji i Davie i Ratnoff [30] u SAD-u.
Nomenklatura[uredi | uredi izvor]
Tokom godišnjih konferencija (počevši od 1955.) stručnjaka za hemostazu, dogovoreno je korištenje rimskih brojeva, umjesto eponima ili sistemskih naziva. Godine 1962. postignut je konsenzus o numeriranju faktora I–XII.[31] Taj se komitet razvio u današnji Međunarodni komitet za trombozu i hemostazu (ICTH). Dodjeljivanje brojeva prestalo je 1963., nakon imenovanja faktora XIII. Imena Fletcherov faktor i Fitzgeraldov faktor data su daljnjim proteinima povezanim s koagulacijom, odnosno prekalikrein i kininogen visoke molekularne težine.[28]
Faktori III i VI nisu dodijeljeni jer tromboplastin nikada nije identificiran, a zapravo se pokazalo da se sastoji od deset dodatnih faktora; pronađen je i akcelerin da se aktivira faktor V.
Ostalee vrste životinja[uredi | uredi izvor]
Svi sisari imaju vrlo blisko povezan proces zgrušavanja krvi, koristeći kombinirani proces ćelijske i serin-proteaze. Zapravo, moguće je da bilo koji koagulacijski faktor kod sisara "otcijepi" svoj ekvivalentni cilj u bilo kojeg drugog sisara. Jedina životinja koja nije sisar, za koju se zna da koristi serin-proteaze za zgrušavanje krvi je rak potkovičar.[32]
Također pogledajte[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ Furie, Barbara C.; Furie, Bruce (decembar 2005). "Thrombus formation in vivo". The Journal of Clinical Investigation. 115 (12): 3355–62. doi:10.1172/JCI26987. PMC 1297262. PMID 16322780.
- ^ Lillicrap, D.; Key, Nigel; Makris, Michael; Denise, O'Shaughnessy (2009). Practical Hemostasis and Thrombosis. Wiley-Blackwell. str. 1–5. ISBN 978-1-4051-8460-1.
- ^ Michelson, Alan D. (26. 10. 2006). Platelets (2nd ed.) (jezik: English). Elsevier. str. 3–5. ISBN 978-0-08-046586-9. OCLC 909782638. Arhivirano s originala, 10. 5. 2017. Pristupljeno 8. 2. 2022.CS1 održavanje: nepoznati jezik (link)
- ^ Schmaier, Alvin H.; Lazarus, Hillard M. (7. 9. 2011). Concise guide to hematology (jezik: English). Chichester, West Sussex, UK: Wiley-Blackwell. str. 91. ISBN 978-1-4051-9666-6. OCLC 779160978. Arhivirano s originala, 8. 2. 2022. Pristupljeno 8. 2. 2022.CS1 održavanje: nepoznati jezik (link)
- ^ Nigel Key; Michael Makris; et al. (2009). Practical Hemostasis and Thrombosis. Wiley-Blackwell. str. 2. ISBN 978-1-4051-8460-1.
- ^ Watson, M. S.; Pallister, C. J. (22. 10. 2010). Haematology, 2nd Edition (jezik: English). Scion Publishing Limited. str. 334–336. ISBN 978-1-904842-39-2. OCLC 1023165019. Arhivirano s originala, 8. 2. 2022. Pristupljeno 8. 2. 2022.CS1 održavanje: nepoznati jezik (link)
- ^ a b c d e f g Pallister CJ, Watson MS (2010). Haematology. Scion Publishing. str. 336–347. ISBN 978-1-904842-39-2.
- ^ "COAGULATION FACTOR". Clotbase.bicnirrh.res.in. Arhivirano s originala, 11. 12. 2016. Pristupljeno 20. 5. 2018.
- ^ Hoffbrand, A. V.; Pettit, J. E; Moss, P. A. H. (2002). Essential Haematology, 4th Edition (jezik: English). London: Blackwell Science. str. 241–243. ISBN 978-0-632-05153-3. OCLC 898998816. Arhivirano s originala, 8. 2. 2022. Pristupljeno 8. 2. 2022.CS1 održavanje: nepoznati jezik (link)
- ^ a b Long AT, Kenne E, Jung R, Fuchs TA, Renné T (mart 2016). "Contact system revisited: an interface between inflammation, coagulation, and innate immunity". Journal of Thrombosis and Haemostasis. 14 (3): 427–37. doi:10.1111/jth.13235. PMID 26707513.
- ^ Hoffman, M. (august 2003). "Remodeling the blood coagulation cascade". Journal of Thrombosis and Thrombolysis. 16 (1–2): 17–20. doi:10.1023/B:THRO.0000014588.95061.28. PMID 14760207. S2CID 19974377. Arhivirano s originala, 8. 2. 2022. Pristupljeno 8. 2. 2022.
- ^ Palta, A.; Palta, S.; Saroa, R. (2014). "Overview of the coagulation system". Indian Journal of Anaesthesia. 58 (5): 515–523. doi:10.4103/0019-5049.144643. ISSN 0019-5049. PMC 4260295. PMID 25535411.
- ^ Signorelli, Salvatore Santo; Oliveri Conti, Gea; Fiore, Maria; Cangiano, Federica; Zuccarello, Pietro; Gaudio, Agostino; Ferrante, Margherita (26. 11. 2020). "Platelet-Derived Microparticles (MPs) and Thrombin Generation Velocity in Deep Vein Thrombosis (DVT): Results of a Case–Control Study". Vascular Health and Risk Management. 16: 489–495. doi:10.2147/VHRM.S236286. ISSN 1176-6344. PMC 7705281. PMID 33273818.
- ^ Singh, S.; Dodt, J; Volkers, P.; Hethershaw, E.; Philippou, H.; Ivaskevicius, V.; Imhof, D.; Oldenburg, J.; Biswas, A. (5. 8. 2019). "Structure functional insights into calcium binding during the activation of coagulation factor XIII A". Scientific Reports (jezik: engleski). 9 (1): 11324. Bibcode:2019NatSR...911324S. doi:10.1038/s41598-019-47815-z. ISSN 2045-2322. PMC 6683118. PMID 31383913.
- ^ a b Hoffbrand, A. V. (2002). Essential haematology. Oxford: Blackwell Science. str. 243–245. ISBN 978-0-632-05153-3.
- ^ a b Immunology – Chapter One: Innate (non-specific) immunity Arhivirano 21. 10. 2014. na Wayback Machine Gene Mayer, Ph.D. Immunology Section of Microbiology and Immunology On-line. University of South Carolina
- ^ David Lillicrap; Nigel Key; Michael Makris; Denise O'Shaughnessy (2009). Practical Hemostasis and Thrombosis. Wiley-Blackwell. str. 7–16. ISBN 978-1-4051-8460-1.
- ^ Hughes-Jones, N. C.; Wickramasinghe, S. N.; Hatton, Chris (2008). Haematology (jezik: English) (8th izd.). Oxford, England; Hoboken, New Jersey: Wiley-Blackwell Publishers. str. 145–166. ISBN 978-1-4051-8050-4. OCLC 1058077604. Arhivirano s originala, 8. 2. 2022. Pristupljeno 8. 2. 2022.CS1 održavanje: nepoznati jezik (link)
- ^ "Disseminated Intravascular Coagulation". The Lecturio Medical Concept Library. Arhivirano s originala, 12. 7. 2021. Pristupljeno 12. 7. 2021.
- ^ Huber J, Stanworth SJ, Doree C, Fortin PM, Trivella M, Brunskill SJ, et al. (novembar 2019). Cochrane Haematology Group (ured.). "Prophylactic plasma transfusion for patients without inherited bleeding disorders or anticoagulant use undergoing non-cardiac surgery or invasive procedures". The Cochrane Database of Systematic Reviews. 2019 (11): CD012745. doi:10.1002/14651858.CD012745.pub2. PMC 6993082. PMID 31778223.
- ^ Soff GA (mart 2012). "A new generation of oral direct anticoagulants". Arteriosclerosis, Thrombosis, and Vascular Biology. 32 (3): 569–74. doi:10.1161/ATVBAHA.111.242834. PMID 22345595.
- ^ Schmidt A (1872). "Neue Untersuchungen über die Faserstoffgerinnung". Pflügers Archiv für die gesamte Physiologie. 6: 413–538. doi:10.1007/BF01612263. S2CID 37273997.
- ^ Schmidt A. Zur Blutlehre. Leipzig: Vogel, 1892.
- ^ Arthus M, Pagès C (1890). "Nouvelle theorie chimique de la coagulation du sang". Arch Physiol Norm Pathol. 5: 739–46.
- ^ Shapiro SS (oktobar 2003). "Treating thrombosis in the 21st century". The New England Journal of Medicine. 349 (18): 1762–4. doi:10.1056/NEJMe038152. PMID 14585945.
- ^ Brewer DB (maj 2006). "Max Schultze (1865), G. Bizzozero (1882) and the discovery of the platelet". British Journal of Haematology. 133 (3): 251–8. doi:10.1111/j.1365-2141.2006.06036.x. PMID 16643426.
- ^ Morawitz P (1905). "Die Chemie der Blutgerinnung". Ergebn Physiol. 4: 307–422. doi:10.1007/BF02321003. S2CID 84003009.
- ^ a b c d e f Giangrande PL (juni 2003). "Six characters in search of an author: the history of the nomenclature of coagulation factors". British Journal of Haematology. 121 (5): 703–12. doi:10.1046/j.1365-2141.2003.04333.x. PMID 12780784.
- ^ Macfarlane RG (maj 1964). "An enzyme cascade in the blood clotting mechanism, and its function as a biochemical amplifier". Nature. 202 (4931): 498–9. Bibcode:1964Natur.202..498M. doi:10.1038/202498a0. PMID 14167839. S2CID 4214940.
- ^ Davie EW, Ratnoff OD (septembar 1964). "Waterfall sequence for intrinsic blood clotting". Science. 145 (3638): 1310–2. Bibcode:1964Sci...145.1310D. doi:10.1126/science.145.3638.1310. PMID 14173416. S2CID 34111840.
- ^ Wright IS (februar 1962). "The nomenclature of blood clotting factors". Canadian Medical Association Journal. 86 (8): 373–4. PMC 1848865. PMID 14008442.
- ^ Osaki T, Kawabata S (juni 2004). "Structure and function of coagulogen, a clottable protein in horseshoe crabs". Cellular and Molecular Life Sciences. 61 (11): 1257–65. doi:10.1007/s00018-004-3396-5. PMID 15170505. S2CID 24537601.
Dopunska literatura[uredi | uredi izvor]
- Hoffman M, Monroe DM (juni 2001). "A cell-based model of hemostasis". Thrombosis and Haemostasis. 85 (6): 958–65. doi:10.1055/s-0037-1615947. PMID 11434702.
- Hoffman M, Monroe DM (februar 2007). "Coagulation 2006: a modern view of hemostasis". Hematology/Oncology Clinics of North America. 21 (1): 1–11. doi:10.1016/j.hoc.2006.11.004. PMID 17258114.
Vanjski linkovi[uredi | uredi izvor]
| Commons ima datoteke na temu: Koagulacija (krv) |

