Kongenitalna mišićna distrofija
| Kongenitalna mišićna distrofija | |
|---|---|
| Drugi nazivi | Urođena/Prirođena mišićna distrofija |
 | |
| Autosomno recesivni obrazac je općenito način na koji se nasljeđuje CMD | |
| Specijalnost | Medicinska genetika |
| Simptomi | Slabost mišića[1] |
| Uobičajeno pojavljivanje | Prirošena |
| Trajanje | Cjeloživotno |
| Vrste | 17 iipova CMD[1] |
| Uzroci | Nasljeđivanje |
| Dijagnostička metoda | NRI, EMG[2] |
| Diferencijalna dijagnoza | Mišićna distrofija |
| Liječenje | Još uvijek ne postoji lijek; treba pratiti srčanu i respiratornu funkciju |
| Smrtnost | ? |
Kongenitalne mišićne distrofije su autosomne recesivno-naslijedne mišićne bolesti. Oni su grupa heterogenih poremećaja koje karakterizira slabost mišića koja je prisutna pri rođenju i različite promjene na biopsiji mišića koje se kreću od miopatijskih do otvoreno distrofijskih zbog starosti u kojoj se radi biopsija.[1][3]
Znaci i simptomi[uredi | uredi izvor]
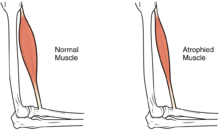
Većina novorođenčadi sa CMD će pokazati progresivnu slabost mišića ili gubitak mišića (atrofiju), iako mogu postojati različiti stepeni i simptomi ozbiljnosti progresije. Slabost se označava kao hipotonija, odnosno nedostatak mišićnog tonusa, zbog čega novorođenče može izgledati nestabilno.[1][4]
Djeca mogu biti spora sa svojim motornim vještinama; kao što je prevrtanje, sjedenje ili hodanje, ili možda neće ni dostići ove životne prekretnice. Neki od rjeđih oblika CMD-a mogu dovesti do značajnih poteškoća u učenju.
Genetika[uredi | uredi izvor]
Kongenitalne mišićne distrofije (CMD) su autosomno recesivno naslijeđene, osim u nekim slučajevima de novo genske mutacije i Ullrichove kongenitalne mišićne distrofije.[5][6] To znači da u većini slučajeva oba roditelja moraju biti nosioci CMD gena da bi se on naslijedio. CMD-ovi su heterogeni i do sada je otkriveno 35 gena koji su uključeni u različite oblike CMD-a koji su rezultat ovih mutacija.[5][7] Postoje različiti oblici CMD, često kategorizirani prema promjenama proteina uzrokovanim atipskim genom.
Jedna grupa oblika je ona kod koje pacijent sa zahvaćenim genima pokazuje defekte gena neophodnih za funkciju vanćelijskog matriksa.[6] Jedan takav oblik je kongenitalna mišićna distrofija sa nedostatkom merozina (MDC1A), koja čini oko jedne trećine svih slučajeva CMD i uzrokovan je mutacijama u LAMA2 genu na hromosomskoj regiji 6q2, koji kodira lamininski-α2 lanac.[7] Laminin -α2 je esencijalni dio proteina kao što su laminin-2 i laminin-4 koji imaju važne funkcije u pokretu mišića, a većina pacijenata sa mutiranim LAMA2 genom nema ekspresiju laminina-α2 u mišićnom tkivu.[7] Drugi oblik u ovoj grupi je Ullrichova kongenitalna mišićna distrofija, koja je uzrokovana mutacijama u genima COL6A1, COL6A2 i COL6A3 koji kodiraju tri alfa lanca koji čine kolagen VI.[8] Collagen VI is important in muscle, tendon, and skin tissue, and functions to attach cells to the extracellular matrix.[8] Kolagen VI je važan u mišićnom, tetivnom i kožnom tkivu i služi za pričvršćivanje ćelija na vanćelijski matriks.[8] Ullrichov CMD može biti uzrokovan i autosomno recesivnim ili autosomno dominantnim mutacijama, iako dominantnim mutacijama su obično de novo.[8] Recesivne mutacije često dovode do potpunog odsustva kolagena VI u vanćelijskom matriksu, dok postoje različiti tipovi dominantnih mutacija koje mogu uzrokovati djelomičnu funkciju kolagena V1.[8]
Drugi oblik CMD-a je kongenitalna mišićna distrofija krute kičme (RSMD1), ili sindrom krute kičme, koji je uzrokovan mutacijama u genu SEPN1 koji kodira selenoprotein N.[7] Tačna funkcija selenoproteina N nije poznata, ali je izražena u grubi endoplazmatski retikulum skeletnih mišića, srca, mozga, pluća i tkiva posteljica, kao i na visokim nivoima u dijafragmi .[7] RSMD1 karakteriše aksijalna i respiratorna slabost, rigidnost kičme i skolioza, te atrofija mišića, a iako je rijedak oblik CMD, SEPN1 mutacije su uočene u drugim kongenitalnim miopatijama.[6]
Neki od najčešćih oblika CMD su distroglikanopatije uzrokovane glikozilacijskim defektima α-distroglikana (α-DG), koji pomaže u povezivanju vanćelijskog matriksa i citoskeleta.[9] Distroglikanopatije su uzrokovane mutacijama u genima koji kodiraju proteine uključene u modifikaciju α-DG, nakon translacije proteina, a ne mutacijama u samom proteinu.[6] Otkriveno je 19 gena koji uzrokuju α-DG- povezane distrofije, sa širokim spektrom uočenih fenotipskih efekata, koje karakteriziraju malformacije mozga zajedno s mišićnom distrofijom.[7][9] Walker– Warburgov sindrom (WWS) je najteži fenotip distroglikanopatije, sa genom POMT1 kao prvim prijavljenim uzročnim genom, iako je bilo 11 dodatnih gena uključenih u WWS. Ovi geni uključuju POMT2, FKRP, FKTN, ISPD, CTDC2, TMEM5, POMGnT1, B3GALnT2, GMPPB, B3GnT1 i SGK196, od kojih su mnogi identifikovani kao uključeni u druge distroglikanopatije.[9] Pacijenti pokazuju slabost mišića i malformacije malog mozga i oka, sa očekivani životni vijek kraći od 1 godine.[6][9]
Dodatni fenotip distroglikanopatije je Fukuyamaina kongenitalna mišićna distrofija (FCMD) uzrokovana mutacijom fukutinskog (FKTN) gena, koji je drugi najčešći tip mišićne distrofije u Japanu nakon Duchenneove mišićne distrofije. Osnivačka mutacija FCMD je umetanje baznog para retrotranspozona od 3 kb u nekodirajuću regiju FKTN, što dovodi do slabosti mišića, abnormalne funkcije oka, napada i intelektualne invalidnosti.][8] Dok je tačna funkcija FKTN nepoznata, FKTN iRNK se eksprimira u fetusima u razvoju CNS, mišićima i očima, i vjerovatno je neophodna za normalan razvoj jer potpuna inaktivacija dovodi do smrti embriona od 7 dana .[7] Još jedan fenotip, bolest mišića-oka-mozga (MEB) je distroglikanopatija najraširenija u Finskoj, a uzrokovana je mutacijama u genima POMGnT1 , FKRP, FKTN, ISPD i TMEM5.[9] Gen POMGnT1 je eksprimiran u istim tkivima kao i FKTN, a čini se da MEB ima sličnu težinu kao i FCMD.[7] Međutim, simptomi jedinstveni za MEB uključuju glaukom, atrofiju optičkih živaca i stvaranje mrežnjača.[6] Najmanje teški fenotip distroglikanopatija je CMD tip 1c (MDC1C), uzrokovan mutacijama u genima FKRP i LARGE, sa fenotipom sličnim MEB i WWS.[9] MDC1C također uključuje mišićni distrofiju udova-pojasa.[9]
Mehanizam[uredi | uredi izvor]
U smislu mehanizma kongenitalne mišićne distrofije, otkriva se da, iako postoji mnogo tipova CMD-a, glikozilacija α-distroglikana i promjene u tim genima koji su uključeni predstavljaju važan dio patofiziologije ovog stanja.[10]
Dijagnoza[uredi | uredi izvor]

Za dijagnozu kongenitalne mišićne distrofije rade se sljedeće pretrage/pregledi:[2]
- Laboratorijska studija (CK nivoa)
- MRI mišića , a posebno mišića cijelog tijela, nedavno je korišten za opisivanje abnormalnosti mišića kod pacijenata sa podtipom CMD-a s primarnim nedostatkom laminina-α2 (merozina).
- EMG
- Genetičko testiranje
Također pogledajte[uredi | uredi izvor]
- Mišićne distrofije
- Ullrichova kongenitalna mišićna distrofija
- Fukuyama kongenitalna mišićna distrofija
Reference[uredi | uredi izvor]
- ^ a b c d Sparks, Susan; Quijano-Roy, Susana; Harper, Amy; Rutkowski, Anne; Gordon, Erynn; Hoffman, Eric P.; Pegoraro, Elena (1. 1. 1993). "Congenital Muscular Dystrophy Overview – RETIRED CHAPTER, FOR HISTORICAL REFERENCE ONLY". u Pagon, Roberta A.; Adam, Margaret P.; Ardinger, Holly H.; Wallace, Stephanie E.; Amemiya, Anne; Bean, Lora J.H.; Bird, Thomas D.; Fong, Chin-To; Mefford, Heather C. (ured.). Congenital Muscular Dystrophy Overview. Seattle (WA): University of Washington, Seattle. PMID 20301468.update 2012
- ^ a b "Congenital Muscular Dystrophy Workup: Laboratory Studies, Imaging Studies, Other Tests". emedicine.medscape.com. Pristupljeno 28. 4. 2016.
- ^ Bertini, Enrico; D'Amico, Adele; Gualandi, Francesca; Petrini, Stefania (1. 12. 2011). "Congenital Muscular Dystrophies: A Brief Review". Seminars in Pediatric Neurology. 18 (4): 277–288. doi:10.1016/j.spen.2011.10.010. ISSN 1071-9091. PMC 3332154. PMID 22172424.
- ^ "Hypotonia: MedlinePlus Medical Encyclopedia". www.nlm.nih.gov. Pristupljeno 28. 4. 2016.
- ^ a b Zambon, Alberto A.; Muntoni, Francesco (1. 10. 2021). "Congenital muscular dystrophies: What is new?". Neuromuscular Disorders (jezik: English). 31 (10): 931–942. doi:10.1016/j.nmd.2021.07.009. ISSN 0960-8966. PMID 34470717 Provjerite vrijednost parametra
|pmid=(pomoć). S2CID 236462260 Provjerite vrijednost parametra|s2cid=(pomoć).CS1 održavanje: nepoznati jezik (link) - ^ a b c d e f Kirschner, Janbernd (1. 1. 2013), Dulac, Olivier; Lassonde, Maryse; Sarnat, Harvey B. (ured.), "Chapter 143 - Congenital muscular dystrophies", Handbook of Clinical Neurology, Pediatric Neurology Part III (jezik: engleski), Elsevier, 113: 1377–1385, doi:10.1016/b978-0-444-59565-2.00008-3, ISBN 9780444595652, PMID 23622361, pristupljeno 11. 5. 2022
- ^ a b c d e f g h Jimenez-Mallebrera, C.; Brown, S. C.; Sewry, C. A.; Muntoni, F. (1. 4. 2005). "Congenital muscular dystrophy: molecular and cellular aspects". Cellular and Molecular Life Sciences (jezik: engleski). 62 (7): 809–823. doi:10.1007/s00018-004-4510-4. ISSN 1420-9071. PMID 15868406. S2CID 24662420.
- ^ a b c d e f Bönnemann, Carsten G. (juli 2011). "The collagen VI-related myopathies: muscle meets its matrix". Nature Reviews Neurology (jezik: engleski). 7 (7): 379–390. doi:10.1038/nrneurol.2011.81. ISSN 1759-4766. PMC 5210181. PMID 21691338.
- ^ a b c d e f g Fu, Xiao-Na; Xiong, Hui (5. 11. 2017). "Genetic and Clinical Advances of Congenital Muscular Dystrophy". Chinese Medical Journal (jezik: engleski). 130 (21): 2624–2631. doi:10.4103/0366-6999.217091. ISSN 0366-6999. PMC 5678264. PMID 29067961.
- ^ Martin, Paul T (2006). "Mechanisms of Disease: congenital muscular dystrophies—glycosylation takes center stage". Nature Clinical Practice Neurology. 2 (4): 222–230. doi:10.1038/ncpneuro0155. ISSN 1745-834X. PMC 2855642. PMID 16932553.
Dopunska literatura[uredi | uredi izvor]
- A, Graziano; F, Bianco; A, D'Amico; I, Moroni; S, Messina; C, Bruno; E, Pegoraro; M, Mora; G, Astrea (1. 3. 2015). "Prevalence of congenital muscular dystrophy in Italy: a population study". Neurology (jezik: engleski). 84 (9): 904–911. doi:10.1212/WNL.0000000000001303. ISSN 0028-3878. PMC 4351663. PMID 25653289.
- Paco, Sonia; Casserras, Teresa; Rodríguez, Maria Angels; Jou, Cristina; Puigdelloses, Montserrat; Ortez, Carlos I.; Diaz-Manera, Jordi; Gallardo, Eduardo; Colomer, Jaume (15. 12. 2015). "Transcriptome Analysis of Ullrich Congenital Muscular Dystrophy Fibroblasts Reveals a Disease Extracellular Matrix Signature and Key Molecular Regulators". PLOS ONE. 10 (12): e0145107. Bibcode:2015PLoSO..1045107P. doi:10.1371/journal.pone.0145107. ISSN 1932-6203. PMC 4686057. PMID 26670220.
- Falsaperla, Raffaele; Praticò, Andrea D.; Ruggieri, Martino; Parano, Enrico; Rizzo, Renata; Corsello, Giovanni; Vitaliti, Giovanna; Pavone, Piero (31. 8. 2016). "Congenital muscular dystrophy: from muscle to brain". Italian Journal of Pediatrics. 42 (1): 78. doi:10.1186/s13052-016-0289-9. ISSN 1824-7288. PMC 5006267. PMID 27576556.
- "Summary of Evidence-based Guideline for PATIENTS and their FAMILIES CONGENITAL MUSCULAR DYSTROPHY". aaan.com. The American Academy of Neurology (AAN). Pristupljeno 5. 12. 2017.
Vanjski linkovi[uredi | uredi izvor]
| Scholia has a topic profile for Kongenitalna mišićna distrofija. |
