Magična kiselina
| Magična kiselina | |
|---|---|
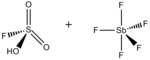 | |
| Općenito | |
| Hemijski spoj | Magična kiselina |
| Molekularna formula | HSbF6SO3 |
| CAS registarski broj | 23854-38-8 |
| SMILES | OS(=O)(=O)F.F[Sb](F)(F)(F)F |
| InChI | 1/FHO3S.5FH.Sb/c1-5(2,3)4;;;;;;/h(H,2,3,4);5*1H;/q;;;;;;+5/p-5/rF5Sb.FHO3S/c1-6(2,3,4)5;1-5(2,3)4/h;(H,2,3,4) |
| Osobine1 | |
| Molarna masa | 316,82 g/mol |
| Agregatno stanje | Tečnost |
| Rizičnost | |
| NFPA 704 | |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Magičnana kiselina (FSO3 H · SbF5) je superkiselina koja se sastoji od mješavine, najčešće u molskom omjeru 1: 1,fluorosumporne kiseline (HSO3 F) i antimon-pentafluorida (SbF5 ). Ovaj sistem konjugovanja Bronsted - Lewisovih superkiselina razvio je George Olah, 1960. u Case Western Reserve University, a koristi se za stabilizaciju karbokationa i hiperkoordiniranih karbonijskih iona u tečnom medijima. Ova kiselina i ostale superkiseline također se koriste za kataliziranje izomerizacije zasićenih ugljikovodika, a dokazano je da protoniraju čak i slabe baze, uključujući metan, ksenon, halogene i molekulski vodik. [1]
Historija[uredi | uredi izvor]
Termin "superkiselina" prvi put se koristi 1927. godine kada je James Bryant Conant otkrio da perhlorna kiselina može da protonizira ketone i aldehide u obliku soli u nevodenom raastvoru.[1] Sam termin je skovao kasnije RJ Gillespie, nakon što je Conant kombinirao sumpornu kiselinu s fluorosumpornom kiselinom, te je ustanovio da je rastvor nekoliko miliona puta kiseliji od sumporne kiseline.[1][2]
Sistem magične kiseline razvio je 1960-ih George Olah, a trebao je biti korišten za proučavanje stabilnih karboksilacija. Gillespie je također koristio kiseli sistem za stvaranje nedostatka elektrona anorganskih kationa. Ime je nastalo nakon božićne zabave 1966. godine, kada je član laboratorija u Olahu stavio parafinsku svijeću u kiselinu, i ustanovio da se ona brzo rastvara. Ispitivanje rastvora s >sup>1H-NMR pokazalo je tert- butil kation, sugerirajući da je parafinski lanac koji formira vosak cijepan, a zatim izomeriziran u relativno stabilnu tercijarnu karboksilaciju. [3] Ime se pojavilo u radu koji je objavio laboratorij Olah.
Svojstva[uredi | uredi izvor]
Struktura[uredi | uredi izvor]
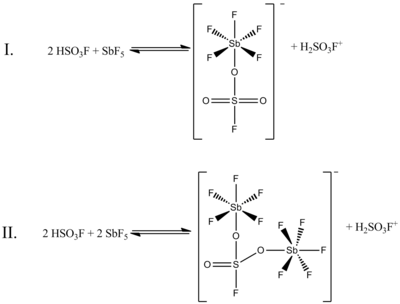
Ako 1: 1 molarni omjer HSO3 F i SbF5 najbolje stvara karbonijeve ione, učinci sistemaa u ostalim molarnim omjerima također su dokumentirani. Kada je omjer SbF5: HSO3 F manji od 0,2, sljedeće dvije ravnoteže, određene 19NMR spektroskopijom, su najistaknutije u otopini:
(U obje ove strukture sumpor ima tetraedarsku koordinaciju, a ne linearnu. Dvostruke veze između sumpora i kisika pravilnije su predstavljene kao jednostruke veze, s formalnim negativnim nabojima na atomima kisika i dva formalna plus naboja na sumporu. Atomi antimona imat će i formalni naboj od minus jedan.) Na gornjoj slici, ravnoteža I čini 80% podataka NMR-a, dok ravnoteža II oko 20%. Kako se odnos dvaju spojeva povećava od 0,4–1,4, pojavljuju se novi NMR signali i povećavaju intenzitet s povećanjem koncentracije SbF5 . Također se smanjuje rezolucija signala, zbog sve veće viskoznosti tečnog sistema. [1]
Jačina[uredi | uredi izvor]
Sve kiseline koje proizvode protone jače od 100%-tne sumporne kiseline smatraju se superkiselinama, a odlikuju ih niske vrijednosti Hammettove funkcije kiselosti. Naprimjer, sumporna kiselina, H2 SO4, ima funkciju Hammettove kiselosti H 0,–12, perhlorna, HclO4, –13, a funkcija magične kiseline od 1: 1., HSO3 F · SbF5, je –23. Smatra se da fluorantimonska kiselina, najjača poznata superkiselina, dostiže ekstrapoliranu H 0 vrijednosti sve do −28.
Upotreba[uredi | uredi izvor]
Promatranja stabilnih karbokacija[uredi | uredi izvor]
Magična kiselina ima malu nukleofilnost, što omogućava povećanje stabilnosti karbokacija u rastvoru. "Klasična" trovalentna karbokacija može se promatrati u kiselom mediju, a otkriveno je da je ravan i sp2– hibridiziran. Budući da je ugljik okružen sa samo šest valentnih elektrona, ima visoku količinu elektrona i elektrofilnosti. Lewisove tačkaste strukture, tako su opisane jer sadrže samo dvoelektronske, dvo-ugljikove veze. Mnogi tercijarni cikloalkilni kationi mogu se formirati i u superkiselinskim rastvorima. Jedan takav primer je 1-metil-1-ciklopentil kation, koji se formira i iz prekursora ciklopentana i cikloheksana. U slučaju cikloheksana, ciklopentil kation nastaje izomerizacijom sekundarne karbokacije do tercijarne, stabilnije karbokacije. Uočeni su i ciklopropilkarbenijski ioni, alkenil kationi i kacij-arenij.
Kako je upotreba sistema magične kiseline postala raširenija, ipak su primijećene karbokacije viših koordinata. Pentakoordinatne karbokacije, također opisane kao neklasični ionei, ne mogu se prikazati pomoću samo dvo-elektronskih, dvocentričnih veza i umjesto toga zahtijevaju dvo-elektronsko, tri (ili više) centralno vezanje. U tim se ionima dva elektrona delokaliziraju na više od dva atoma, čineći ove centre veza toliko nedostatnim u elektronima da omogućavaju zasićenim alkanima da sudjeluju u elektrofilnim reakcijama. Otkriće hiperkoordiniranih karbokacija potaknulo je neklasičnu ionsku polemiku 1950-ih i 60-ih. Zbog sporog vremenskog raspona 1H-NMR, brzo uravnoteženi pozitivni naboji na vodikovim atomima vjerovatno će ostati neprimijećeni. Međutim, IR spektroskopija, Ramanska spektroskopija i 13C NMR korišteni su za istraživanje mostova karbokacijskih sistema. Jedan kontroverzni kation, norbornil kation, uočen je u više medija, a među njima je i magična kiselina.[3]
Premoštavajući metilen-ugljikov atom je pentakoordiniran, sa tri dvoelektronske, dvocentrične veze i jednom dvoelektronskom, trocentralnom vezom s preostalim sp3 orbitalom. Kvantna mehanička izračunavanja su također pokazala da klasični model nije energetski minimum.[3]
Reakcije s alkanima=[uredi | uredi izvor]
Magična kiselina sposobna je da protonira alkane . Naprimjer, metan reagira da formira CH+
CH ion na 140 °C i atmosferski pritisak, iako se neki ugljikovodični ioni veće molekularne težine također formiraju kao nusprodukti. Još jedan nusprodukt reakcije je vodikov plin.
U prisustvu FSO3 D, umjesto SZS3H, pokazano je da atom metana obavlja razmjenu atoma vodika za atom deuterija, a otpušten je HD, a ne H2. Ovo je dokaz koji sugerira da je u tim reakcijama metan zaista baza i da može prihvatiti proton iz kiselog medija da bi formirao CH+
CH . Ovaj ion se zatim deprotonira, što objašnjava izmjenu vodika, ili gubi molekulu vodika da formira CH+
CH– ion karbonija. Ova vrsta je prilično reaktivna i može dati nekoliko novih karbokalizacija, prikazanih u nastavku.[4]
Veći alkani, poput etana, također su reaktivni u magičnoj kiselini i oba izmjenjuju atome vodika i kondenziraju da bi stvorili veće karbokacije, poput protoniranog neopentana. Ovaj ion se tada klonira pri višim temperaturama i reagira na oslobađanje plinovitog vodika i pri nižim temperaturama formira t-amil kation.
Na tom zapažanju, George Olah predlaže da više ne uzimamo kao sinonime nazive alkane" i "parafin". Riječ "parafin" potiče od latinskog parum affinis", što znači „nedostaje afinitet“. Kaže, „Međutim, s određenom nostalgijom dajemo ovu preporuku, jer su "inertni plinovi barem održavali svoju plemenitost" jer je njihova hemijska reaktivnost postala očita, ali upućivanje na „plemenite ugljikovodike“ činilo bi se neprimjerenim." [1]
Kataliza hidroperoksidima[uredi | uredi izvor]
Magična kiselina katalizira reakcije odvajanja tercijarnih hidroperoksida i tercijarnih alkohola. Priroda pokusa korištenih za određivanje mehanizma i činjenica da su se odvijali u superacidnom mediju, omogućila je promatranje formiranih intermedijara karbokacije. Utvrđeno je da mehanizam ovisi o količini korištene magične kiseline. Približno molarna ekvivalentnost uočava se samo u cijepanju O–O, ali s povećanjem viška magičke kiseline, C–O cijepanje konkurira cijepanju O–O. Višak kiseline vjerovatno deaktivira vodik-peroksid nastao u heterolizi C–O.[5]
Magična kiselina također katalizira elektrofilnu hidroksilaciju aromatskih spojeva vodik-peroksidom, što rezultira visokoučinkovitom pripremom monohidroksiliranih proizvoda. Fenoli postoje kao potpuno protonizirane vrste u superkiselinskim tastvorima, a kada se dobiju reakcijom, tada se deaktiviraju prema daljnjem elektrofilnom napadu. Protonirani vodik-peroksid je aktivno sredstvo za hidroksilaciju.[6]
Kataliza sa ozonom[uredi | uredi izvor]
Oksigenirani alkan može katalizirati rastvor magične kiseline SO2 CLF, u prisustvu ozona. Mehanizam je sličan onome kod protolize alkana, s elektrofilnim umetanjem u jednostruke σ veze alkana. Prelazno stanje ugljovodonika i ozona ima oblik pentakoordiniranog iona.[7]
Alkoholi, ketoni i aldehidi oksigeniraju se i elektrofilnim insercijama (umetanjem).[8]
Sigurnost[uredi | uredi izvor]
Kao i za sve jake kiseline, a posebno superkiseline, treba koristiti i odgovarajuću ličnu zaštitnu opremu. Pored obaveznih rukavica i naočara, preporučuje se i upotreba zaštitnog vizura i respiratorja za potpuno lice. Predvidljivo, magična kiselina je visoko toksična nakon gutanja i udisanja, izaziva ozbiljne opekotine na koži i očima, a je toksična je i za vodeni život.
Također pogledajte[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ Olah, G. A. (2005). "Crossing Conventional Boundaries in Half a Century of Research". Journal of Organic Chemistry. 70 (7): 2413–2429. doi:10.1021/jo040285o. PMID 15787527.
- ^ Olah, G. A.; Prakash, S.; Molnar, A.; Sommer, J. (2009). Superacid Chemistry (2nd izd.). New York: John Wiley and Sons. str. 49. ISBN 978-0-471-59668-4.
- ^ a b Olah, G. A. (1973). "Carbocations and Electrophilic Reactions". Angewandte Chemie International Edition. 12 (3): 173–254. doi:10.1002/anie.197301731.
- ^ Olah, G. A.; Schlosberg, R. H. (1968). "Chemistry in Super Acids. I. Hydrogen Exchange and Polycondensation of Methane and Alkanes in FSO3H-SbF5 ("Magic Acid") Solution. Protonation of Alkanes and the Intermediacy of CH+
5 and Related Hydrocarbon Ions.The High Chemical Reactivity of "Paraffins" in Ionic Solution Reactions". Journal of the American Chemical Society. 90 (10): 2726–2727. doi:10.1021/ja01012a066. - ^ Olah, G. A.; Parker, D. G.; Yoneda, Y.; Pelizza, F. (1976). "Oxyfunctionalization of Hydrocarbons. 1. Protolytic Cleavage-Rearrangement Reactions of Tertiary Alkyl Hydroperoxides with Magic Acid". Journal of the American Chemical Society. 98 (8): 2245–2250. doi:10.1021/ja00424a038.
- ^ Olah, G. A.; Ohnishi, R. (1978). "Oxyfunctionalization of hydrocarbons. 8. Electrophilic hydroxylation of benzene, alkylbenzenes, and halobenzenes with hydrogen peroxide in superacids". Journal of Organic Chemistry. 43 (5): 865–867. doi:10.1021/jo00399a014.
- ^ Olah, G. A.; Yonena, N.; Ohnishi, R (1976). "Oxyfunctionalization of hydrocarbons. 6. Electrophilic oxygenation of aliphatic alcohols, ketones, and aldehydes with ozone in superacids. Preparation of bifunctional derivatives". Journal of the American Chemical Society. 98 (23): 7341–7345. doi:10.1021/ja00439a038.
- ^ Olah, G. A.; Yoneda, N.; Parker, D. G. (1976). "Oxyfunctionalization of hydrocarbons. 3. Superacid catalyzed oxygenation of alkanes with ozone involving protonated ozone, O3H+". Journal of the American Chemical Society. 98 (17): 5261–5268. doi:10.1021/ja00433a035.
Vanjski linkovi[uredi | uredi izvor]
| Commons ima datoteke na temu: Magična kiselina |