Maleinska kiselina
| Maleinska kiselina | |
|---|---|
  | |
| Općenito | |
| Hemijski spoj | Maleinska kiselina |
| Druga imena | (Z)-butenedioična kiselina, cis-butenedioična kiselina, malenska kiselina, maleinična kiselina, toksilinska kiselina |
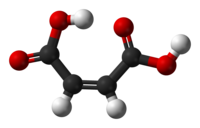
| Molekularna formula | HO2CCHCHCO2H |
| CAS registarski broj | 110-16-7 |
| SMILES | O=C(O)\C=C/C(=O)O |
| InChI | 1/C4H4O4/c5-3(6)1-2-4(7)8/h1-2H,(H,5,6)(H,7,8)/b2-1- |
| Kratki opis | Bijela čvrsta tvar |
| Osobine1 | |
| Gustoća | 1.59 g/cm³ |
| Tačka topljenja | 135 |
| Rastvorljivost | 478.8 g/L na 20 C |
| Rizičnost | |
| NFPA 704 | |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |

Maleinska kiselina ili cis- butendioična kiselina je organski spoj – dikarboksilna kiselina – molekula sa dvije karboksilne grupe. Njena hemijska formula je:
- HO2CCHCHCO2H.
Maleinska kiselina je cis - izomer butendioične kiseline, dok je fumarna kiselina trans izomer. Uglavnom se koristi kao prethodnica fumarne kiseline, a u odnosu na svoj matični maleinski anhidrid, maleinska kiselina ima nekoliko aplikacija.[1][2][3][4]
Fizička svojstva[uredi | uredi izvor]
Maleinska kiselina je manje stabilna molekula od fumarne kiseline. Razlika u toploti sagorijevanja je 22,7 kJ • moli–1. Toplota sagorevanja je -1355 kJ/mol.[5] Topljivija je u vodi od fumarne kiseline. Tačke topljenja maleinske kiseline (135 °C) je također znatno manja nego kodfumarne kiseline (287 °C). Oba svojstva maleinske kiseline se mogu objasniti na račun unutar vodikovih povezivanja, koja se odvija u maleinskoj kiselini na račun intermolekularnih interakcija, a što nije moguće u fumarnoj kiselini iz geometrijskih razloga.[6][7][8][9][10]
Proizvodnja i industrijska primjena[uredi | uredi izvor]
U industriji, maleinska kiselina se dobija hidrolizom maleinske kiseline, a drugi način se proizvodnje je organska oksidacija benzena ili butana
Maleinska kiselina je industrijska sirovina za proizvodnju glikoksilne kiseline putem ozonolize.[11] Može se koristiti i za formirnje dodataka kiselinskih soli, kao što je indakaterol maleat, lijekovima, kako bi ih bolje stabilizirali,
Maleinska kiselina se također koristi za poboljšanje prionjivosti za različite podloge, kao što su najlon i pocinčani metali, npr. pocinčani čelik, na bazi metil metakrilat ljepila.
Izomerizacija u fumarnu kiselinu[uredi | uredi izvor]
Najveći industrijsku upotrebu maleinska kiselina ima u pretvaranju u fumarnu kiselinu. Ova konverzija, jedna od izomerizacija, je katalizirana raznim reagensima, kao što su mineralne kiseline i tiourea. Velika razlika u rastvorljivosti u vodi, pročišćavanje fumarne kiseline ćini lahkim postupkom.
Izomerizacija je popularna tema u školama. Maleinska i fumarna kiselina nespontano se interkonvertiraju, jer rotacija oko ugljik-ugljik dvostruke veze nije energetski povoljna. Međutim, konverzija cis izomera u trans izomer je moguća fotolizom u prisustvu male količine bromina.[12]. Svjetlost pretvara element brom u brom u slobodni radikal, koji napada alken u radikalnoj reakciji sa bromo-alkan radikalom. Tada je moguća rotacija s jednostrukom vezom. Brom radikal se rekombinira i formira fumarnu kiselinu. U drugom načinu (koristi se kao nastavna demonstracija), maleinska kiselina se pretvara u fumarnu kiselinu tokom zagrijavanja maleinske kiseline u rastvoru HCl Reverzibilni smjer toga (H ++) dovodi do slobodne rotacije oko centralne C-C veze i formiranja stabilnije i manje rastvorljiva fumarne kiseline.
Ostale reakcije[uredi | uredi izvor]
Iako se to ne praktikuje komercijalno, maleinska kiselina se može pretvoriti u maleinsku kiselinu dehidracijom, u jabučnoj kiselini hidratacijom, a da se dobije sukcinska kiselina putem hidrogenacije (etanol / paladij na ugljiku) . To reagira s Tionil hloridom ili fosfor pentahloridom dajući hlorid maleinske kiseline (nije moguće izolirati kiselinski mono hlorid). Maleinska kiseline, kao elektrofilna, sudjeluje kao dienofil u mnogim Diels-Alder reakcijama.[6][13]
Maleati[uredi | uredi izvor]
Maleatni ion je ionizirani oblik maleinske kiseline, a koristan je u biohemiji kao inhibitor reakcije transaminaza. Estri maleinske kiseline se nazivaju maleati, naprimjer dimetil maleat.
Koristiti u farmaciji[uredi | uredi izvor]
Mnogi lijekovi se daju kao maleati, npr. karfenazin, hlorfeniramin, pirilamin, metilergonovinom, i tietilperazin.
Reference[uredi | uredi izvor]
- ^ Voet D., Voet J. (1995): Biochemistry, 2nd Ed. Wiley, http://www.wiley.com/college/math/chem/cg/sales/voet.html.
- ^ Bugg T. (1997): An introduction to enzyme and coenzyme chemistry. Blackwell Science, Oxford, ISBN 0-86542-793-3.
- ^ Lindhorst T. (2007): Essentials of carbohydrate chemistry and biochemistry. Wiley-VCH, 3527315284}}
- ^ Robyt F. (1997): Essentials of carbohydrate chemistry. Springer, ISBN 0387949518.
- ^ http://www.southalabama.edu/chemistry/barletta/felthouse.pdf .
- ^ a b Laidler K. J. (1978): Physical chemistry with biological applications. Benjamin/Cummings, Menlo Park, ISBN 0-8053-5680-0.
- ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Ed. (2005): Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-1-8.
- ^ Hunter G. K. (2000): Vital Forces. The discovery of the molecular basis of life. Academic Press, London 2000, ISBN 0-12-361811-8.
- ^ Međedović S., Maslić E., Hadžiselimović R. (2000): Biologija 2. Svjetlost, Sarajevo, ISBN 9958-10-222-6.
- ^ Nelson D. L., Cox M. M. (2013): Lehninger principles of biochemistry. W. H. Freeman and Co., ISBN 978-1-4641-0962-1.
- ^ http://www.dsm.com/en_US/html/dfc/rds_oxidation.htm Arhivirano 30. 11. 2005. na Wayback Machine.
- ^ http://www.uni-regensburg.de/Fakultaeten/nat_Fak_IV/Organische_Chemie/Didaktik/Keusch/D-Mal_Isom-e.htm Arhivirano 27. 11. 2005. na Wayback Machine. (uz video).
- ^ Petrucci R.H., Harwood W.S. and Herring F.G. (2002): General Chemistry, 8th Ed. Prentice-Hall, New York, ISBN 0-13-014329-4.
Vanjski linkovi[uredi | uredi izvor]
| maleinske kiseline na Wikimedia Commonsu. |


