Natrij-nitrat
Ovaj članak ili neki od njegovih odlomaka nije dovoljno potkrijepljen izvorima (literatura, veb-sajtovi ili drugi izvori). |
| Natrij-nitrat | |
|---|---|
 | |
| Općenito | |
| Hemijski spoj | Natrij-nitrat |
| Druga imena | Čilska šalitra, Čilska salitra |
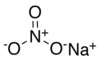
| Molekularna formula | NaNO3 |
| CAS registarski broj | 7631-99-4 |
| Kratki opis | Bijeli prah ili bezbojni kristali |
| Osobine1 | |
| Molarna masa | 84.9947 g/mol |
| Agregatno stanje | čvrsto |
| Gustoća | 2,26 g/cm3 |
| Tačka topljenja | 307 °C |
| Rastvorljivost | 87,4 g/100 mL |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Natrij-nitrat NaNO3 je najvažniji nitrat koji se pojavljuje u prirodi. Prije svega nalazi se u Čileu, pa se zato i naziva čilska šalitra. Manjih nalazišta ima u Egiptu, Maloj Aziji, Kolumbiji i Kaliforniji, ali od tehničkog značaja su samo nalazišta u Čileu.
Dobijanje[uredi | uredi izvor]
Sirova čilska šalitra većinom je veoma onečišćena pijeskom i glinom, te raznim drugim solima (najčešće natrij-hloridom). Osim toga sadrži nešto natrij-, magnezij- i kalcij-sulfata i malim količinama kalcij-jodata, te je siva ili smeđa kamena masa. Iz ovog materijala dobija se natrij-nitrat izluživanjem vrućom vodom. Pri tom se nastali rastvor natrij-nitrata filtrira da se odvoji glineni mulj i zaostali nerastvoreni natrij-hlorid, a zatim hladi pri čemu kristalizira. Dobijeni natrij-nitrat je 98%-tan. Matični lugovi sadrže natrij-jodat i služe za dobijanje joda. U Njemačkoj se natrij-nitrat dobija pretežno iz sode sa nitratnom kiselinom: Na2CO3 + 2 HNO3 → 2 NaNO3 + H2O + CO2
i to tako da se nitrozni otpadni plinovi od oksidacije amonijaka apsorbiraju u rastvoru sode. Pri tom nastali rastvor nitrita i nitrata (Na2CO3 + 2 NO2 → NaNO2 + NaNO3 + CO2) se zakiseli nitratnom kiselinom i oksidira se na zraku u nitrat, koji se sodom neutrališe i upari u vakuumskim isparivačima.
Osobine[uredi | uredi izvor]
Natrij-nitrat kristalizira iz vodenog rastvora u obliku bezbojnih, kockastih romboedara (kubična šalitra), koji imaju talište na 307°C, a kod 380°C počinju se raspadati. U vodi se lahko rastvara i rastvorljivost mu jako raste sa porastom temperature.
Upotreba[uredi | uredi izvor]
Veći dio čilske šalitre služio je prije za gnojivo, ostali dio upotrebljavao se za dobijanje nitratne kiseline i kalijeve šalitre. Danas natrij-nitrat ima značenje samo još kao gnojivo.
| Commons ima datoteke na temu: Natrij-nitrat |

