Nedostatak 21-hidroksilaze
| Kongenitalna hiperplazija nadbubrežne žlijezde zbog nedostatka 21-hidroksilaze (21-OH CAH) | |
|---|---|
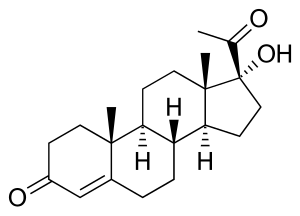 Nedostatak 21-hidroksilaza može dovesti do akumulacije 17α-hidroksiprogesterona
| |
| Klasifikacija i vanjski resursi | |
| ICD-10 | E25.0 |
| ICD-9 | 255.2 |
| OMIM | 201910 |
| DiseasesDB | 1854 |
Kongenitalna hiperplazija nadbubrežne žlijezde zbog nedostatka 21-hidroksilaze u svim njenim oblicima čini preko 95% dijagnostikovanih slučajeva kongenitalne adrenalne hiperplazije (CAH),[1] a CAH se u većini konteksta odnosi na nedostatak 21-hidroksilaze i različite mutacije povezane s oštećenjem enzima mapirane na strukturi proteina.[2]
Prezentacija[uredi | uredi izvor]
Ranopojavna teška CAH sa nedostatkom 21-hidroksilaze[uredi | uredi izvor]
Događaju se dvije najozbiljnije neonatusne posljedice nedostatka 21-hidroksilaze: po život opasne krize trošenja soli u prvom mjesecu života (i za mušku i za žensku djecu) i teška virilizacija ženske djece. Podjela ranog početka CAH na forme koje troše soli i forme jednostavne virilizacije, a koja se zasniva na kapacitetu nadbubrežne žlijezde da proizvodi male količine aldosterona u obliku jednostavne virilize, često nije klinički značajna, jer se kliničke slike preklapaju i svi pacijenti gube so u određenoj mjeri.
Krize trošenja soli kod dojenčadi[uredi | uredi izvor]
Prekomjerne količine nadbubrežnog testosterona imaju mali efekt na genitalije muške novorođenčadi sa teškim CAH. Ako muško dojenče sa CAH ne bude otkriveno skiningom novorođenčeta, izgledat će zdravo i normalno i brzo će biti otpušteno kući svojoj porodici. Međutim, nedostatak aldosterona dovodi do visoke stope gubitka natrija u mokraći. Koncentracije natrija u urinu mogu premašiti 50 mEq/L. Sa ovom brzinom gubitka soli, novorođenče ne može održavati volumen krvi, a hiponatremijska dehidracija počinje da se razvija do kraja prve sedmice života. Izlučivanje kalija i kiselina takođe je poremećeno kada je manjkava aktivnost mineralokortikoida, a hiperkalemija i metabolička acidoza se postepeno razvijaju. Sposobnost održavanja cirkulacije dodatno je ograničena efektom nedostatka kortizola. Rani simptomi su slinjenje i slabo dobijanje na težini, ali većina dojenčadi s teškim CAH ima povraćanje, tešku dehidraciju i cirkulatorni kolaps (cirkulacijski šok) do druge ili treće sedmice života.
Kada se dovede u bolnicu, beba od 1–3 sedmice će biti i premala i dehidrirana. Krvni pritisak može biti nizak. Osnovni metabolički pokazatelji će otkriti hiponatremiju, sa serumskim Na+ tipsdki između 105 i 125 mEq/L. Hiperkalijemija kod ove novorođenčadi može biti ekstremna — nivoi K+ iznad 10 mEq/L nisu neuobičajeni — kao i stepen metaboličke acidoze. Hipoglikemija može biti prisutna. Ovo se naziva kriza trošenja soli i brzo uzrokuje smrt ako se ne liječi. Koliko god ova novorođenčad bila bolesna, brzo reaguju na liječenje hidrokortizonom i intravenskom fiziološkom otopinom, a dekstroza brzo vraća volumen krvi, krvni pritisak i sadržaj natrija u tijelu i preokreće hiperkalemiju. Uz odgovarajući tretman, većina dojenčadi je van životne opasnosti u roku od 24 sata.
Kasnopojavna (neklasična) CAH[uredi | uredi izvor]
Višak androgena dovoljno je blag da virilizacija nije očigledna ili ostaje neprepoznata pri rođenju i u ranom djetinjstvu. Međutim, nivoi androgena su iznad normalnog i polako rastu tokom djetinjstva, proizvodeći primjetne efekte između 2. i 9. godine života.
Pojava stidnih dlaka u srednjem djetinjstvu jest najčešća karakteristika koja vodi do procjene i dijagnoze. Druge prateće karakteristike su vjerovatno visok rast i ubrzano koštano doba (često 3–5 godina unaprijed). Često su prisutne povećana mišićna masa, akne i tjelesni miris odraslih. Kod dječaka penis će biti uvećan. Blago povećanje klitorisa može se javiti kod djevojčica, a ponekad se prepozn i određeni stepen prenatalne virilizacije koji je možda prošao nezapaženo u dojenačkom uzrastu.
Glavni ciljevi liječenja neklasičnog CAH-a su očuvanje što većeg mogućeg rasta i sprječavanje centralnog preuranjenog puberteta ako već nije pokrenut. Ovo su teži izazovi nego kod CAH koji se otkriva u dojenčasdi jer će umjereni nivoi androgena imati nekoliko godina da unaprijede sazrijevanje kostiju i da pokrenu centralni pubertet prije nego što se bolest otkrije.
Dijagnoza neklasične CAH obično se potvrđuje otkrivanjem ekstremnih povišenja 17α-hidroksiprogesterona, zajedno sa umjereno visokim nivoima testosterona. kosintropinski test stimulacije može biti potreban u blagim slučajevima, ali obično su nasumični nivoi 17OHP dovoljno visoki da potvrde dijagnozu.
Povišen 17α-hidroksiprogesteron može aktivirati androgeni put " stražnjih vrata", što dovodi do viška 5α-dihidrotestosterona i drugih moćnih androgena, uz normalne nivoe testosterona.[3][4]
Nedavni dodaci liječenju za očuvanje rasta uključuju inhibiciju aromataze za usporavanje sazrijevanja kostiju, smanjenjem količine testosterona pretvorenog u estradiol i korištenje blokatora estrogena u istu svrhu. Kada se postigne supresija nadbubrežne žlijezde, pacijentu je potrebna pokrivenost steroidima stresa, kao što je gore opisano za značajnu bolest ili ozljedu.
Ostali aleli rezultiraju još blažim stepenom hiperandrogenizma koji možda čak i ne uzrokuje probleme kod muškaraca i možda neće biti prepoznat do adolescencije ili kasnije kod žena. Blagi efekti androgena kod mladih žena mogu uključivati hirzutizam, akne ili anovulaciju (što zauzvrat može uzrokovati neplodnost). Nivo testosterona kod ovih žena može biti blago povišen ili jednostavno iznad prosjeka. Ove kliničke karakteristike su one Kao kod sindroma policistastih jajnika (PCOS), a mali procenat žena sa PCOS-om ima kasnu pojavu CAH kada se ispita.
Dijagnoza kasnopojavne CAH može se posumnjati na osnovu visokog nivoa 17α-hidroksiprogesterona, ali neki slučajevi su toliko blagi da je povišenje vidljivo tek nakon stimulacije kosintropinom. Liječenje može uključivati kombinaciju vrlo niske doze glukokortikoida za smanjenje proizvodnje androgena nadbubrežne žlijezde i bilo kojeg od različitih agenasa koji blokiraju efekte androgena i/ili induciraju ovulaciju.
Kasnopojvnu CAH je prvobitno okarakterizirao francuski biohemičar Jacques Decourt 1957.[5] ali povezanost s blagim nedostatkom 21-hidroksilaze nazvanom neklasični nedostatak 21-hidroksilaze, okarakterizirane različitim simptomima hiperandrogena koji se pojavljuju postnatalno kod muškaraca i žena, prva je opisala Maria New, 1979.[6] New od tada proučavala je načine za smanjenje viška androgena i otkrila da tretman deksametazonom od 0,25 mg oralno svake večeri poništava akne i neredovnu menstruaciju za tri mjeseca, ali hirzutizam zahtijeva do 30 mjeseci.[7][8] Deksametazon ima glukokortikoidnu aktivnost i snažna svojstva supresije ACTH unutar hipotalamo-hipofizno-nadbubrežne osovine.[9][10] Niži ACTH dovodi do smanjene proizvodnje svih steroida, uključujući androgene. Prema Uputstvu za kliničku praksu iz 2018., liječenje glukokortikoidima se ne preporučuje kod asimptomskih osoba; međutim, ako su simptomi viška androgena dovoljni, može se propisati liječenje deksametazonom.[1] Druga opcija liječenja su oralne kontracepcijske pilule.[11][12]
Genetika[uredi | uredi izvor]

Gen CYP 21A2 za enzim P450c21 (također poznat kao 21-hidroksilaza) nalazi se na poziciji 6p21.3,[13]usred gena HLA B i HLA DR koji su lokusi kodiranja glavnog kopleksa histokompatibilnosti (ljudski leukocitni antigen). CYP21A2 je uparen sa nefunkcionalnim pseudogenskim CYP21A1P.[14] Dokumentirani su rezultati abnormalnih alela CYP21A2, koji većinom proizlaze iz rekombinacije homolognih regiona CYP21A2 i CYP21A1P.[14] Manjak 21-hidroksilaze može biti uzrokovan makrodelecijama od oko 30 Kb, što uključuje ne samo većina 5′ regije gena CYP21A2, već i sav C4B gen i 3′ regiju pseudogena CYP21A1P. Duplikacije pseudogena CYP21A1P i gena C4B često su povezane s neklasičnim nedostatkom 21-hidroksilaze. Zbog visokog stepena homologije između gena CYP21A2 i pseudogena CYP21A1P, te složenosti lokusa, istraživanje na molekulskom nivou je teško.[15]
Razlike u preostaloj aktivnosti enzima različitih alela objašnjavaju različite stepene ozbiljnosti bolesti. Nasljeđivanje svih oblika 21-hidroksilaze CAH je autosomno recesivno.[1]
Osobe zahvaćene bilo kojim oblikom bolesti imaju dva abnormalna alela, a oba roditelja su obično heterozigoti (ili nositelji). Kada oba roditelja nose abnormalni alel, svako dijete ima 25% šanse da ima bolest, 50% šanse da bude nositelj, a roditelji i 25% šanse da ima dva normalna gena.[1]
Sada je moguće testirati heterozigotnost mjerenjem porasta 17α-hidroksiprogesterona nakon ACTH stimulacije, ili odnedavno direktnim sekvenciranjem gena.
Do sada je identifikovano više od 200 varijanti koje izazivaju bolesti unutar gena "CYP21A2" koje dovode do nedostatka 21-hidroksilaze[16] ako su najmanje dvije od ovih varijanti prisutne kao dvostruki heterozigoti. Postoji dobra korelacija između genotipa i fenotipa. Kao rezultat toga, genotipizacija CYP21A2 ima visoku dijagnostičku vrijednost. Međutim, genotipizacija gena CYP21A2 podložna je greškama, posebno zbog blisko lociranog i visoko homolognog pseudogena CYP21A1P i složenih duplikacija, delecija i preuređivanja unutar hromosomske regije 6p21.3 . Zato genotipizacija CYP21A2, interpretacija rezultata i adekvatno genetičko savjetovanje pacijenata i njihovih porodica zahtijevaju duboko razumijevanje genetike CYP21A2.[14]
Patofiziologija[uredi | uredi izvor]

Enzim P450c21, koji se obično naziva 21-hidroksilaza (21-OH), ugrađen je u glatki endoplazmatski retikulum ćelija kore nadbubrežnih žlijezda. Katalizira hidroksilaciju 17α-hidroksiprogesterona (17OHP) u 11-deoksikortizol na glukokortikoidnom putu, koji počinje od pregnenolon a i završava kortizolom. Također katalizira hidroksilaciju progesterona u 11-deoksikortikosteron (DOC) na mineralokortikoidnom putu, puta od pregnenolona do aldosterona.
Nedovoljna aktivnost ovog enzima smanjuje efikasnost sinteze kortizola, uz konstantnu hiperplaziju kore nadbubrežne žlijezde i povišenje nivoa ACTH. ACTH stimulira unos holesterola i sintezu pregnenolona. Steroidni prekursori do njega i uključujući progesteron, 17α-hidroksipregnenolon, a posebno 17α-hidroksiprogesteron akumuliraju se u kori nadbubrežne žlijezde i u cirkulirajućoj krvi. Nivoi 17OHP u krvi mogu dostići 10–1000 puta više od normalne koncentracije.
Budući da aktivnost 21-hidroksilaze nije uključena u sintezu androgena, značajan dio velikih količina 17α-hidroksipregnenolona preusmjerava se na sintezu DHEA, androstendiona i testosterona, počevši od trećeg mjeseca fetusnog života kod oba spola.
Sinteza aldosterona također zavisi od aktivnosti 21-hidroksilaze. Iako je fetusna proizvodnja poremećena, to ne uzrokuje prenatalne efekte, jer veza posteljicel omogućava krvi majke da "dijalizira" fetus i održava ravnotežu elektrolita i volumen krvi.
Dijagnoza[uredi | uredi izvor]
Budući da je CAH autosomno recesivna bolest, većina djece sa CAH se rađa od roditelja koji nisu svjesni rizika i nemaju porodičnu anamnezu. Svako dijete će imati 25% šanse da se rodi sa bolešću.[1]
Klasifikacija[uredi | uredi izvor]
Stanje se može klasificirati u "potrošnja soli", "jednostavnu virilizaciju" i "neklasične" oblike.[1]
| Tip | Efekti spolnog steroida | Ostali efekti |
|---|---|---|
| Ozbiljni nedostatak 21-hidroksilaze uzrokuje CAH trošenja soli | Najčešći uzrok su dvosmislene genitalije zbog prenatalne virilizacije genetički ženskih (XX) novorođenčadi. | Povraćanje opasno po život i dehidracija koji se javljaju u prvih nekoliko sedmica života. Nivoi aldosterona i kortizola su smanjeni. |
| Umjereni nedostatak 21-hidroksilaze naziva se jednostavno virilizirajuća CAH | Obično se prepoznaje kao uzrok virilizacije djece u prepubertetskoj dobi. | Kortizol je smanjen, ali aldosteron nije. |
| Još blaži oblici nedostatka 21-hidroksilaze nazivaju se neklasični CAH | Može izazvati androgene efekte i neplodnost kod adolescenata i odraslih žena. | Ne smanjuju se razine ni aldosterona ni kortizola. |
Tipovi koji troše sol i jednostavni virilizirajući tipovi grupišu se ponekad kao "'klasični'".[17]
Liječenje[uredi | uredi izvor]
Od 2018. godine, Smjernice za kliničku praksu savjetuju da kliničari nastave smatrati prenatalnu terapiju eksperimentalnom.[1]
Budući da period tokom kojeg se genitalije fetusa mogu virilizirati počinje oko šeest sedmica nakon začeća, prenatalni tretman kako bi se izbjegla virilizacija mora se započeti do 6.–7. sedmice.[1]
Primjena deksametazona u prenatalnom liječenju[uredi | uredi izvor]
Nadbubrežne žlijezde ženskih fetusa sa CAH počinju proizvoditi višak androgena do 9. sedmice gestacije. Najvažniji aspekti virilizacija (urogenitalno zatvaranje i falusni ureter) dešava se između 8. i 12. sedmice. Teoreijski, ako bi se fetusu moglo dopremiti dovoljno glukokortikoida da smanji proizvodnju testosterona nadbubrežne žlijezde do 9. sedmice virilizacija bi se mogla spriječiti i izbjeći teška odluka o vremenu operacije.
Izazov prevencije teške virilizacije djevojčica je dvostruk: otkrivanje CAH-a na početku trudnoće i isporuka efektivne količine glukokortikoida fetusu bez nanošenja štete majci.Prvi problem još nije u potpunosti riješen, ali se pokazalo da ako trudnica uzme dovoljno deksametazona, taj može proći kroz placentu da potisne funkciju nadbubrežne žlijezde fetusa.
Još uvijek nema programa koji otkrivaju rizik u porodicama koje još nisu imale dijete sa CAH. Za porodice koje žele da izbegnu virilizaciju drugog djeteta, sadašnja strategija je da počnu da uzimaju deksametazon čim se potvrdi trudnoća, iako je u tom periodu šansa da je trudnoća devojčica sa CAH samo 12,5%. Majka uzima deksametazon svaki dan dok se ne može sa sigurnošću utvrditi da li nosi oboljelu djevojčicu. Da li je fetus oboljela djevojčica može se utvrditi analizom horionskih resica u 9.–11. sedmici gestacije ili amniocentezom u periodu između 15. i 18. sedmice gestacije. U svakom slučaju spol fetusa može se brzo odrediti, a ako je fetus muškog spola, deksametazon se može prekinuti. Ako je ženskog, fetusna DNK se analizira kako bi se utvrdilo da li nosi neki od poznatih abnormalnih alela gena CYP21. Ako je tako, deksametazon se nastavlja do kraja trudnoće u dozi od oko 1 mg dnevno.
Većina majki koje su slijedile ovaj plan liječenja imale su barem blage kušingoidne efekte glukokortikoida, ali su rodile kćeri čije su genitalije mnogo manje virilizirane.
Deksametazon se koristi kao neetiketirani rani prenatalni tretman za simptome CAH kod ženskih fetusa, ali ne liječi osnovni kongenitalni poremećaj. Švedsko kliničko ispitivanje iz 2007. pokazalo je da liječenje može uzrokovati kognitivne i etološke defekte, ali mali broj ispitanika znači da se studija ne može smatrati definitivnom. Američka studija iz 2012. nije pokazala negativne kratkoročne ishode, ali jeste "nižu kognitivnu obradu kod CAH djevojčica i žena s dugotrajnom izloženošću DEX-u".[18] Primjena prenatalnog deksametazona bila je predmet kontroverzi oko pitanja zvanog informirani pristanak i zbog toga što liječenje mora prethoditi kliničkoj dijagnozi CAH kod ženskog fetusa,[19] posebno zato što in utero deksametazon može uzrokovati metaboličke probleme koji nisu evidentni tek kasnije u životu; švedske klinike obustavile su zapošljavanje za takva istraživanja 2010.[20]
Liječenje je također izazvalo zabrinutost u LGBT i bioetičkim zajednicama nakon objavljivanja eseja na forumu Hastings Centra i istraživanja u Journal of Bioethical Inquiry, koje je otkrilo da prenatalni tretman poduziman da se ženskim fetusima spriječi da postanu lezbejke nakon rođenja, odnosno da mogu povećati vjerovatnoću da se upuste u "tradicionalno" žensko ponašanje i karijere, te da budu više zainteresirani za rađanje i podizanje djece. Citirajući poznati pokušaj muškarca koji koristi svoje znanje o „bratskom redu rođenja i muškoj seksualnoj orijentaciji“ da izbjegne da ima homoseksualnog sina koristeći surogat, esejisti (profesor Alice Dreger sa Medicinskog fakulteta Feinberškog Univerziteta Northwestern, profesorica Ellen Feder sa američkog univerziteta i advokat Anne Tamar-Mattis) sugeriraju da prenatalni "dex" tretmani predstavljaju prvi poznati pokušaj korištenja in utero protokols za smanjenje učestalosti homoseksualnosti i biseksualnosti kod ljudi.[21][22] Istraživanja o korištenju prenatalnih hormonskih tretmana za sprječavanje homoseksualnosti sežu do ranih 1990-ih ili ranije.[23]
Pošto je CAH recesivan gen, i majka i otac moraju biti recesivni nosioci CAH da bi dijete imalo CAH. Zbog napretka moderne medicine, ovi parovi sa recesivnim CAH genima imaju opciju da spreče CAH kod svojih potomaka putem preimplantacijska genetička dijagnoza (PGD). U PGD-u, jajna stanica se oplođuje izvan ženinog tijela u petrijevoj posudi (IVF). Trećeg dana, kada se embrion razvio od jedne ćelije do otprilike četiri do šest ćelija, jedna od tih ćelija se uklanja iz embrija bez njegovog oštećenja. Embrion nastavlja da raste do 5. dana kada je ili zamrznut ili implantiran u majku. U međuvremenu, uklonjena ćelija se analizira kako bi se utvrdilo da li embrion ima CAH. Ako se utvrdi da embrion ima CAH, roditelji mogu donijeti odluku da li žele da se implantira majci ili ne.
Studijske metaanalize koje podržavaju upotrebu deksametazona na fetusima pod rizikom od CAH otkrila je da se "manje od jedne polovine od jednog procenta objavljenih 'studija' ove intervencije smatra dovoljno visokokvalitetnim da pruži značajne podatke. Čak su i ove četiri studije bile niskog kvaliteta ... na način toliko klizav da su prekršile profesionalne standarde medicinske etike"[22] i "nije bilo podataka o dugotrajnom praćenju fizičkih i metaboličkih ishoda kod djece izložene deksametazonu".[24]
Dugotrajno upravljanje CAH-om[uredi | uredi izvor]
Lečenje dojenčadi i dece sa CAH je složeno i zahteva dugotrajnu negu u pedijatrijskoj endokrinološkoj klinici. Nakon što je dijagnoza potvrđena i bilo kakva kriza trošenja soli izbjegnuta ili poništena, glavni problemi upravljanja uključuju:
- Pokretanje i praćenje hormonske zamjene
- Pokrivenost stresom, prevencija kriza, edukacija roditelja
- Rekonstruktivna hirurgija
- Optimiziranje rasta
- Optimizacija supresije androgena i plodnosti kod žena sa CAH
Hormonska zamjena[uredi | uredi izvor]
Primarni ciljevi hormonske zamjene su zaštita od nadbubrežne insuficijencije i suzbijanje prekomjerne proizvodnje androgen nadbubrežne žlijezde.
Glukokortikoidi se daju svoj djeci i odraslima sa svim osim s najblažim i najnovijim oblicima CAH. Glukokortikoidi pružaju pouzdanu zamjenu za kortizol, čime se smanjuju nivoi ACTH. Smanjenje ACTH također smanjuje stimulans za kontinuiranu hiperplaziju i prekomjernu proizvodnju androgena. Drugim riječima, nadomjestak glukokortikoida je primarnI metod za smanjenje prekomjerne proizvodnje androgena nadbubrežne žlijezde kod oba spola. Brojni glukokortikoidi dostupni su za terapijsku upotrebu. Hidrokortizon ili tekući prednizolon preferiraju se u dojenčadi i djetinjstvu, a prednizon ili deksametazon su često pogodniji za odrasle.
Doziranje glukokortikoida počinje se obično na nižem kraju fiziološke zamjene (6–12 mg/m2), ali se prilagođava tokom djetinjstva, kako bi se spriječio i rast supresije od prevelike količine glukokortikoida i bijega androgena iz premale zamjene. Nivoi 17α-hidroksiprogesterona, testosterona, androstendion a i drugih nadbubrežnih steroida prate se za dodatne informacije, ali se možda neće u potpunosti normalizirati čak ni uz optimalno liječenje. Međutim, sadašnji metodi terapije glukokortikoidima mogu dovesti do nefizioloških doza koje, pored problema uzrokovanih prekomjernim izlaganjem androgenima, mogu štetiti zdravlju. Različiti klinički rezultati, osim steroida, zahtijevaju redovno praćenje. Negativne posljedice su prvenstveno posljedica nefiziološke zamjene glukokortikoida.[25]
Mineralokortikoidi se zamjenjuju kod svih novorođenčadi sa trošenjem soli i kod većine pacijenata s povišenim nivoima renina. Fludrokortizon je jedini farmaceutski dostupan mineralokortikoid i obično se koristi u dozama od 0,05 do 2 mg dnevno. Radi optimizacije doze, prate se nivoi elektrolita, renina i krvnog pritiska.
Incidencija[uredi | uredi izvor]
Prema većini studija, globalna incidencija klasičnih oblika kreće se od oko 1/14.000 do 1/18.000 rođenja, na osnovu programa skrininga novorođenčadi i nacionalnih registra slučajeva, ali ova situacija je češća u malim genetički izolovanim populacijama s malim genskim fondovima.[1] Incidencija neklasičnih oblika je 1/200 do 1/1.000 na osnovu različitih procjena, a viša je i u grupama ljudi s visokom stopom brakova u srodstvu, do 1/50.[1][26][7]
Također pogledajte[uredi | uredi izvor]
- Urođene greške metabolizma steroida
- Kongenitalna adrenalna hiperplazija
- Adrenalna insuficijencija
- Poremećaji seksualnog razvoja
- Interseksualnost, pseudohermafroditizam i dvosmislene genitalije
- 21-Hidroksilaza
Reference[uredi | uredi izvor]
- ^ a b c d e f g h i j Speiser PW, Arlt W, Auchus RJ, Baskin LS, Conway GS, Merke DP, et al. (November 2018). "Congenital Adrenal Hyperplasia Due to Steroid 21-Hydroxylase Deficiency: An Endocrine Society Clinical Practice Guideline". The Journal of Clinical Endocrinology and Metabolism. 103 (11): 4043–4088. doi:10.1210/jc.2018-01865. PMC 6456929. PMID 30272171.
- ^ Neves Cruz J, da Costa KS, de Carvalho TA, de Alencar NA (March 2020). "Measuring the structural impact of mutations on cytochrome P450 21A2, the major steroid 21-hydroxylase related to congenital adrenal hyperplasia". Journal of Biomolecular Structure & Dynamics. 38 (5): 1425–1434. doi:10.1080/07391102.2019.1607560. PMID 30982438. S2CID 115195169.
- ^ Fiet J, Gueux B, Raux-DeMay MC, Kuttenn F, Vexiau P, Brerault JL, et al. (March 1989). "Increased plasma 21-deoxycorticosterone (21-DB) levels in late-onset adrenal 21-hydroxylase deficiency suggest a mild defect of the mineralocorticoid pathway". primary. The Journal of Clinical Endocrinology and Metabolism. 68 (3): 542–7. doi:10.1210/jcem-68-3-542. PMID 2537337.
- ^ Sumińska M, Bogusz-Górna K, Wegner D, Fichna M (June 2020). "Non-Classic Disorder of Adrenal Steroidogenesis and Clinical Dilemmas in 21-Hydroxylase Deficiency Combined with Backdoor Androgen Pathway. Mini-Review and Case Report". International Journal of Molecular Sciences. 21 (13): 4622. doi:10.3390/ijms21134622. PMC 7369945. PMID 32610579.
- ^ Decourt J, Jayle MF, Baulieu E (May 1957). "[Clinically late virilism with excretion of pregnanetriol and insufficiency of cortisol production]" [Clinically late virilism with excretion of pregnanetriol and insufficiency of cortisol production]. Annales d'Endocrinologie (jezik: francuski). 18 (3): 416–22. PMID 13470408.
- ^ New MI, Lorenzen F, Pang S, Gunczler P, Dupont B, Levine LS (February 1979). ""Acquired" adrenal hyperplasia with 21-hydroxylase deficiency is not the same genetic disorders as congenital adrenal hyperplasia". The Journal of Clinical Endocrinology and Metabolism. 48 (2): 356–9. doi:10.1210/jcem-48-2-356. PMID 218988.
- ^ a b New MI (November 2006). "Extensive clinical experience: nonclassical 21-hydroxylase deficiency". The Journal of Clinical Endocrinology and Metabolism. 91 (11): 4205–14. doi:10.1210/jc.2006-1645. PMID 16912124.
- ^ Trapp CM, Oberfield SE (March 2012). "Recommendations for treatment of nonclassic congenital adrenal hyperplasia (NCCAH): an update". Steroids. 77 (4): 342–6. doi:10.1016/j.steroids.2011.12.009. PMC 3638754. PMID 22186144.
- ^ Glucocorticoid Therapy and Adrenal Suppression. MDText.com. 2000.
- ^ Rabhan NB (December 1968). "Pituitary-adrenal suppression and Cushing's syndrome after intermittent dexamethasone therapy". Annals of Internal Medicine. 69 (6): 1141–8. doi:10.7326/0003-4819-69-6-1141. PMID 4881892.
- ^ Matthews D, Cheetham T (March 2013). "What is the best approach to the teenage patient presenting with nonclassical congenital adrenal hyperplasia: should we always treat with glucocorticoids?". Clinical Endocrinology. 78 (3): 338–41. doi:10.1111/cen.12065. PMID 23039910. S2CID 24131309.
- ^ Witchel SF, Azziz R (2010). "Nonclassic congenital adrenal hyperplasia". International Journal of Pediatric Endocrinology. 2010: 625105. doi:10.1155/2010/625105. PMC 2910408. PMID 20671993.
- ^ Trakakis E, Loghis C, Kassanos D (March 2009). "Congenital adrenal hyperplasia because of 21-hydroxylase deficiency. A genetic disorder of interest to obstetricians and gynecologists". Obstetrical & Gynecological Survey. 64 (3): 177–89. doi:10.1097/OGX.0b013e318193301b. PMID 19228439. S2CID 37242194.
- ^ a b c Baumgartner-Parzer S, Witsch-Baumgartner M, Hoeppner W (July 2020). "EMQN best practice guidelines for molecular genetic testing and reporting of 21-hydroxylase deficiency". European Journal of Human Genetics. 28 (10): 1341–1367. doi:10.1038/s41431-020-0653-5. PMC 7609334. PMID 32616876. S2CID 220295067.
- ^ Espinosa Reyes TM, Collazo Mesa T, Lantigua Cruz PA, Agramonte Machado A, Domínguez Alonso E, Falhammar H (November 2020). "Molecular diagnosis of patients with congenital adrenal hyperplasia due to 21-hydroxylase deficiency". BMC Endocrine Disorders. 20 (1): 165. doi:10.1186/s12902-020-00643-z. PMC 7653887. PMID 33168061.
- ^ Concolino P (October 2019). "Issues with the Detection of Large Genomic Rearrangements in Molecular Diagnosis of 21-Hydroxylase Deficiency". Molecular Diagnosis & Therapy. 23 (5): 563–567. doi:10.1007/s40291-019-00415-z. PMID 31317337. S2CID 197543506.
- ^ Forest MG, Tardy V, Nicolino M, David M, Morel Y (June 2005). "21-Hydroxylase deficiency: an exemplary model of the contribution of molecular biology in the understanding and management of the disease". Annales d'Endocrinologie. 66 (3): 225–32. doi:10.1016/s0003-4266(05)81754-8. PMID 15988383.
- ^ Meyer-Bahlburg HF, Dolezal C, Haggerty R, Silverman M, New MI (July 2012). "Cognitive outcome of offspring from dexamethasone-treated pregnancies at risk for congenital adrenal hyperplasia due to 21-hydroxylase deficiency". European Journal of Endocrinology. 167 (1): 103–10. doi:10.1530/EJE-11-0789. PMC 3383400. PMID 22549088.
- ^ Elton C (2010-06-18). "A Prenatal Treatment Raises Questions of Medical Ethics". Time. Arhivirano s originala, June 21, 2010. Pristupljeno 2010-07-05.
- ^ Hirvikoski T, Nordenström A, Wedell A, Ritzén M, Lajic S (June 2012). "Prenatal dexamethasone treatment of children at risk for congenital adrenal hyperplasia: the Swedish experience and standpoint". The Journal of Clinical Endocrinology and Metabolism. 97 (6): 1881–3. doi:10.1210/jc.2012-1222. PMID 22466333.
- ^ Dreger A, Feder EK, Tamar-Mattis A (2010-06-29). "Preventing Homosexuality (and Uppity Women) in the Womb?". Bioethics Forum, a service of the Hastings Center. Pristupljeno 2010-07-05.
- ^ a b Dreger A, Feder EK, Tamar-Mattis A (September 2012). "Prenatal Dexamethasone for Congenital Adrenal Hyperplasia: An Ethics Canary in the Modern Medical Mine". Journal of Bioethical Inquiry. 9 (3): 277–294. doi:10.1007/s11673-012-9384-9. PMC 3416978. PMID 22904609.
- ^ Meyer-Bahlburg H (1990). "Will Prenatal Hormone Treatment Prevent Homosexuality?". Journal of Child and Adolescent Psychopharmacology. 1 (4): 279–283. doi:10.1089/cap.1990.1.279.
- ^ Mercè Fernández-Balsells M, Muthusamy K, Smushkin G, Lampropulos JF, Elamin MB, Abu Elnour NO, et al. (October 2010). "Prenatal dexamethasone use for the prevention of virilization in pregnancies at risk for classical congenital adrenal hyperplasia because of 21-hydroxylase (CYP21A2) deficiency: a systematic review and meta-analyses". Clinical Endocrinology. 73 (4): 436–44. doi:10.1111/j.1365-2265.2010.03826.x. PMID 20550539. S2CID 29694687.
- ^ Nordenström A, Lajic S, Falhammar H (March 2021). "Clinical outcomes in 21-hydroxylase deficiency". Current Opinion in Endocrinology, Diabetes and Obesity. 28 (3): 318–324. doi:10.1097/MED.0000000000000625. PMID 33741777. S2CID 232298877.
- ^ Hannah-Shmouni F, Morissette R, Sinaii N, Elman M, Prezant TR, Chen W, et al. (November 2017). "Revisiting the prevalence of nonclassic congenital adrenal hyperplasia in US Ashkenazi Jews and Caucasians". Genetics in Medicine. 19 (11): 1276–1279. doi:10.1038/gim.2017.46. PMC 5675788. PMID 28541281. S2CID 4630175.
Vanjski linkovi[uredi | uredi izvor]
- GeneReviews/NCBI/NIH/UW entry on 21-Hydroxylase-Deficient Congenital Adrenal Hyperplasia
- OMIM entry on 21-Hydroxylase-Deficient Congenital Adrenal Hyperplasia
Šablon:Poremećaji nadbubrežne žlijezde Šablon:Kvarovi metabolizma holesterola i steroida
