Neoplazma
| Neoplazma | |
|---|---|
| Drugi nazivi | Tumor, karcinociti |
 | |
| Kolektomijski uzorak koji sadrži malignu neoplazmu, odnosno invazivni primjer kolektomija (tumor nalik krateru, crvenkast, nepravilnog oblika) | |
| Specijalnost | Onkologija |
| Simptomi | Kvržica |
| Komplikacije | Rak |
| Uzroci | Zračenje, faktor okoline, određene infekcije |
Neoplazma[1][2] je tip abnormalnog i prekomjernog rasta tkiva. Proces do kojeg dolazi do formiranja ili stvaranja neoplazme naziva se neoplazija. Rast neoplazme je nekoordiniran s rastom normalnog okolnog tkiva i nastavlja nenormalno rasti, čak i ako se izvorni okidač ukloni.[3][4][5] This abnormal growth usually forms a mass, when it may be called a tumor.[6]
ICD-10 klasifikuje neoplazme u četiri glavne grupe: benigne neoplazme, in situ neoplazme, maligne neoplazme i neoplazme nesigurnog ili nepoznatog ponašanja.[7] Maligne neoplazme su takođe jednostavno poznate kao kanceri ili rakovi i u fokusu su onkologije.
Prije abnormalnog rasta tkiva, kao neoplazije, ćelije često prolaze kroz abnormalni obrazac rasta, kao što su metaplazija ili displazija.[8] However, metaplasia or dysplasia does not always progress to neoplasia and can occur in other conditions as well.[3] Riječ potiče od starogrčkog νέος - neo = novi + πλάσμα - plazma = formiranje, stvaranje.
Tipovi[uredi | uredi izvor]
Šablon:-plazija Neoplazma može biti benigna, potencijalno maligna ili maligna (rak).[9]
- Benigni tumori uključuju miome materice, osteofite i melanocitne nevuse (kožni madeži). Oni su ograničeni i lokalizovani i ne pretvaraju se u rak.[8]
- Potencijalno maligne neoplazme uključuju karcinom in situ. Oni su lokalizovani, ne napadaju i ne uništavaju, ali se vremenom mogu transformisati u rak.
- Maligne neoplazme se obično nazivaju rakom. Napadaju i uništavaju okolno tkivo, mogu formirati metastaze i, ako se ne liječe ili ne reaguju na lečenje, općenito će se pokazati fatalnim.
- Sekundarna neoplazma se odnosi na bilo koju klasu kanceroznog tumora koji je ili metastatski izdanak primarnog tumora, ili naizgled nepovezani tumor čija se učestalost povećava nakon određenih tretmana raka kao što su hemoterapija ili radioterapija.
- Retko može postojati metastatska neoplazma bez poznatog mjesta primarnog karcinoma i to se klasifikuje kao rak nepoznatog primarnog porijekla.
Klonalnost[uredi | uredi izvor]
Neoplazmatski tumori su često heterogeni i sadrže više od jednog tipa ćelija, ali njihov početak i nastavak rasta obično zavise od jedne populacije neoplazijskih ćelija. Pretpostavlja se da su ove ćelije monoklonske – to jest da su izvedene iz iste ćelije,[10] i svi nose istu genetičku ili epigenetičku anomaliju – evidentnu klonalnost. Za limfoidne neoplazme, npr. limfom i leukemija, klonalnost se dokazuje amplifikacijom jednog preuređivanja njihovog imunoglobulinskog gena (za B-ćelijske lezije) ili T-ćelijskog receptora gena (za lezije T-ćelija). Smatra se da je demonstracija klonalnosti neophodna za identifikaciju proliferacije limfoidnih ćelija kao neoplazmatskih.[11]
Primamljivo je definirati neoplazme kao klonske ćelijske proliferacije, ali demonstracija klonalnosti nije uvijek moguća. Stoga, klonalnost nije potrebna u definiciji neoplazije.
Neoplazma vs tumor[uredi | uredi izvor]
Riječ "tumor" dolazi od latinske riječi za "otok", što je jedan od kardinalnih znakova upala. Termin se prvobitno odnosio na bilo koji oblik otok, neoplazmatski ili ne. U modernom engleskom jeziku, tumor se koristi kao sinonim za neoplazmu (čvrsta ili tekućinom ispunjena cistasta lezija koja može, ali ne mora biti formirana abnormalnim rastom neoplazmatskih ćelija) koja izgleda uvećano.[12][13] Neke neoplazme ne formiraju tumor - to uključuje leukemiju i većinu oblika karcinoma in situ. Tumor takođe nije sinonim za kancer. Dok je rak po definiciji maligni, tumor može biti benigni, prekancerogen ili maligni.
Termini masa i čvorić često se koriste kao sinonim za tumor. Općenito govoreći, međutim, izraz tumor koristi se bez obzira na fizičku veličinu lezije.[3] Konkretnije, termin masa se često koristi kada lezija ima maksimalni promjer od najmanje 20 milimetara (mm) u najvećem smjeru, dok se izraz čvor obično koristi kada je veličina lezije manja od 20 mm u njegova najveća dimenzija (25,4 mm = 1 inč).[3]
Uzroci[uredi | uredi izvor]

Tumori kod ljudi nastaju kao rezultat akumuliranih genetičkih i epigenetičkih promjena unutar pojedinačnih ćelija, koje uzrokuju da se nekontrolirano dijelie i šire.[14] Neoplazma može biti uzrokovana abnormalnom proliferacijom tkiva, koja može biti izazvana genetičkim mutacijama. Međutim, ne uzrokuju svi tipovi neoplazmi tumorski rast tkiva (kao što su leukemija ili karcinom in situ) i istaknute su sličnosti između neoplazmatskih izraslina i regenerativnih procesa, npr. dediferencijacija i brza vanjska proliferacija ćelija.[15]
Rast tumora je proučavan pomoću matematike i mehanike kontinuuma. Vaskularni tumori kao što su hemangiomi i limfangiomi (nastali iz krvnih ili limfnih sudova) se stoga posmatraju kao amalgami čvrstog skeleta formiranog od ljepljivih ćelija i organske tekućine koja ispunjava prostore u kojima ćelija može rasti.[16] U okviru ovog tipa modela mogu se baviti mehaničkim naprezanjima i deformacijama i razjasniti njihov uticaj na rast tumora i okolnog tkiva i vaskulature. Nedavni rezultati eksperimenata koji koriste ovaj model pokazuju da je aktivni rast tumora ograničen na vanjske rubove tumora i da ukrućenje osnovnog normalnog tkiva također inhibira rast tumora..[17]
Benigna stanja koja nisu povezana s abnormalnom proliferacijom tkiva (kao što su lojne ciste mogu se, međutim, predstaviti kao tumori, ali nemaju maligni potencijal. Ciste dojke (koje se obično javljaju tokom trudnoća i u drugim periodima) su još jedan primjer, kao i druge inkapsulirane otekline žlijezda (tiroidna, nadbubrežna žlijezda, pankreas).
Inkapsulirani hematomi, inkapsulirano nekrotsko tkivo (od ujeda insekta, stranog tijela ili drugog štetnog mehanizma), keloid (diskretni rast ožiljnog tkiva) i granulomi također se mogu pojaviti kao tumori.
Diskretna lokalizirana proširenja normalnih struktura (mokraćovoda, krvnih sudova, unutar- ili vanjetrenih bilijarnih kanala, plućnih inkluzija ili gastrointestinalne duplikacije) zbog opstrukcija ili suženja odljeva, ili abnormalnih veza, također se mogu pojaviti kao tumor . Primjeri su arteriovenske fistule ili aneurizme (sa ili bez tromboze), bilijarne fistule ili aneurizme, sklerozirajući holangitis, cisticerkoza ili hidatidne ciste, crijevne duplikacije i plućne inkluzije kao što se vidi kod cistaste fibroze. Može biti opasno za biopsiju niz tipova tumora kod kojih bi curenje njihovog sadržaja potencijalno bilo katastrofalno. Kada se naiđd na takve tipove tumora, koriste se dijagnostički modaliteti kao što su ultrazvuk, CT skeniranje, MRI, angiogram i skeniranje nuklearne medicine prije (ili tokom) biopsije ili hirurške eksploracije/ekcizije u pokušaju da se izbjegnu tako teške komplikacije.
Maligne neoplazme[uredi | uredi izvor]
Oštećenje DNK[uredi | uredi izvor]

Oštećenje DNK smatra se primarnim osnovnim uzrokom malignih neoplazmi poznatih kao karcinomi.[18] Njegova centralna uloga u progresiji do raka ilustrovana je na slici u ovom odeljku, u okviru pri vrhu. (Središnje karakteristike oštećenja DNK, epigenetske promene i manjkave popravke DNK u progresiji do raka prikazane su crvenom bojom.) Oštećenje DNK je vrlo često. Prirodna oštećenja DNK (uglavnom zbog ćelijskog metabolizma i svojstava DNK u vodi na tjelesnim temperaturama) javljaju se po stopi od više od 60.000 novih oštećenja, u prosjeku, po ljudskoj ćeliji, dnevno]]. Dodatna oštećenja DNK mogu nastati zbog izlaganja egzogenim agensima. Duhanski dim uzrokuje povećana egzogena oštećenja DNK, a ova oštećenja DNK su vjerovatni uzrok raka pluća zbog pušenja.[19] UV zračenjesunčevog svjetla uzrokuje oštećenje DNK koje je važno za melanom.[20] Infekcija Helicobacter pylori proizvodi visoke razine reaktivnih vrsta kisika koje oštećuju DNK i doprinose nastanku raka želuca.[21] Žučne kiseline, u visokim nivoima u debelom crijevu ljudi koji jedu hranu s visokim udjelom masti, također uzrokuju oštećenje DNK i doprinose raku debelog crijeva.[22] Katsurano et al. pokazali su da su makrofagi i neutrofili u upaljenom epitelu debelog crijeva izvor reaktivnih vrsta kisika koji uzrokuju oštećenja DNK koja iniciraju tumorigenezu debelog crijeva.[23] Neki izvori oštećenja DNK navedeni su u poljima na vrhu slike u ovom odeljku.
Pogođeni mutacijom zametne linije koja uzrokuje nedostatak bilo kojeg od 34 popravka DNK gena (pogledajte članak Poremećaj nedostatka popravke DNK) su pod povećanim rizikom od raka. Neke mutacije zametne linije u genima za popravak DNK uzrokuju do 100% doživotne šanse za rak (npr. mutacije p53).[24] Ove mutacije zametne linije označene su u polju lijevo od slike sa strelicom koja pokazuje njihov doprinos nedostatku popravke DNK.
Oko 70% malignih neoplazmi nemaju nasljednu komponentu i nazivaju se "sporadičnim karcinomom".[25] Samo manjina sporadičnih karcinoma ima nedostatak u popravku DNK zbog mutacije gena za popravku DNK. Međutim, većina sporadičnih karcinoma ima nedostatak u popravci DNK zbog epigenetičkih promjena koje smanjuju ili utišaju ekspresiju gena za popravak DNK. Naprimjer, od 113 uzastopnih kolorektumskih karcinoma, samo četiri su imala misense mutaciju u genu za popravak DNK MGMT, dok je većina imala smanjenu ekspresiju MGMT zbog metilacije regiona promotora MGMT (epigenetička promena).[26] Pet izvještaja predstavlja dokaze da između 40% i 90% kolorektumskih karcinoma ima smanjenu ekspresiju MGMT zbog metilacije promotorske regije MGMT.[27][28][29][30][31]
Slično tome, od 119 slučajeva kolorektumskog karcinoma sa nedostatkom neusklađenosti kod kojih je nedostajala ekspresija gena za popravak DNK PMS2, PMS2 je bio deficitaran u 6 slučajeva zbog mutacija u genu PMS2, dok je u 103 slučaja ekspresija PMS2 bila manjkava jer je njegov partner MLH1 bio potisnut zbog metilacija na promotoru (PMS2 protein je nestabilan u odsustvu MLH1).[32] In the other 10 cases, loss of PMS2 expression was likely due to epigenetic overexpression of the microRNA, miR-155, which down-regulates MLH1.[33]
U daljnjim primjerima, epigenetski defekti su pronađeni na frekvencijama između 13%-100% za gene za popravak DNK BRCA1, WRN, FANCB, FANCF , MGMT, MLH1, MSH2, MSH4, ERCC1, XPF, NEIL1 i ATM . Ovi epigenetički defekti su se javili kod različitih karcinoma (npr. dojke, jajnika, kolorektuma i glave i vrata). Dva ili tri nedostatka u ekspresiji ERCC1, XPF ili PMS2 javljaju se istovremeno u većini od 49 karcinoma debelog crijeva koje su procijenili Facista et al.[34] Epigenetske promjene koje uzrokuju smanjenu ekspresiju gena za popravku DNK prikazane su u središnjoj kutiji na trećem nivou od vrha slike u ovom dijelu, a posljedični nedostatak popravke DNK prikazan je na četvrtom nivou.
Kada je ekspresija gena za popravak DNK smanjena, oštećenja DNK akumuliraju se u ćelijama na višem nivou od normalnog, a ta oštećenja uzrokuju povećanu učestalost mutacija ili epimutacija. Stope mutacija se snažno povećavaju u ćelijama defektnim u popravkama neslaganja DNK[35][36] ili u homolognorekombinacijskoj popravci (HRR).[37]
Tokom popravka dvostrukih lanaca DNK ili drugih oštećenja DNK, nepotpuno očišćena mjesta popravka mogu uzrokovati epigenetičko utišavanje gena.[38][39] Nedostaci popravke DNK (nivo 4 na slici) uzrokuju povećana oštećenja DNK (nivo 5 na slici), što rezultira povećanim somatskim mutacijama i epigenetičkim promjenama (nivo 6 na slici).
Defekti polja, normalno tkivo koje se pojavljuje sa višestrukim promjenama (o čemu se govori u odeljku ispod), uobičajeni su prethodnici razvoja poremećenog i nepravilno proliferirajućeg klona tkiva u malignoj neoplazmi. Takvi defekti polja (drugi nivo od dna slike) mogu imati višestruke mutacije i epigenetičke promjene.
Kada se rak formira, obično ima nestabilnost genoma. Ova nestabilnost je vjerovatno posljedica smanjene popravka DNK ili prekomjernog oštećenja DNK. Zbog takve nestabilnosti, rak nastavlja da se razvija i proizvodi potklonove. Naprimjer, rak bubrega, uzorkovan u 9 područja, imao je 40 sveprisutnih mutacija, pokazujući heterogenost tumora (tj. prisutna je u svim područjima raka), 59 mutacija koje dijele neka (ali ne sva područja), i 29 “privatnih” mutacija prisutnih samo u jednom od područja raka.[40]
Defekti polja[uredi | uredi izvor]
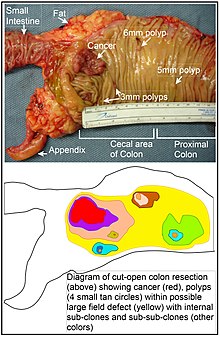
Korišteni su i različiti drugi termini da se opiše ovaj fenomen, uključujući "efekat polja", "kancerizaciju polja" i "polje karcinogeneza". Termin "kancerizacija polja" prvi put je upotrijebljen 1953. da opiše područje ili "polje" epitela koje je bilo preduvjetovano (u to vrijeme) uglavnom nepoznatim procesima, kako bi ga predisponiralo za razvoj raka.[41]
Defekti polja su važni u napredovanju raka.[42][43] Međutim, u većini istraživanja raka, kako je istakao Rubin,[44] „Ogromna većina studija u istraživanju raka rađena je na dobro definiranim tumorima in vivo, ili na diskretnim neoplaszmatskim žarištima in vitro. Ipak, postoje dokazi da se više od 80% somatskih mutacija pronađenih u mutatorskom fenotipu ljudskih kolorektumskih tumora javlja prije početka terminalne klonalne ekspanzije.[45] Similarly, Vogelstein et al.[46] ističu da se više od polovine somatskih mutacija identifikovanih u tumorima dogodilo u preneoplazijskoj fazi (u defektu polja), tokom rasta naizgled normalnih ćelija. Isto tako, epigenetičke promjene prisutne u tumorima su se mogle pojaviti u preneoplazijskim defektima polja.
Prošireni pogled na efekt polja nazvan je "etiološki efekt polja", koji obuhvata ne samo molekularne i patološke promjene u preneoplazmatskim ćelijama, već i utjecaje egzogenih faktora okoline i molekulske promjene u lokalnom mikrookruženju u neoplazijskoj evoluciji od početka tumora do smrti pacijenta.[47]
U eksperimentalnoj procjeni nedostataka specifičnog popravka DNK kod karcinoma, pokazalo se da se mnogi specifični nedostaci popravke DNK javljaju u defektima polja koji okružuju te tipove raka. Tabela u nastavku daje primjere za koje se pokazalo da je nedostatak popravka DNK kod raka uzrokovan epigenetičkom promjenom, a nešto niže frekvencije s kojima je isti epigenetički uzrokovan nedostatak popravka DNK pronađen u okolnom defektu polja.
| Rak | Gen | Učestalost u raku | Učestalost u defektu polja | Referenca |
|---|---|---|---|---|
| Kolorektumski | MGMT | 46% | 34% | [27] |
| Kolorektumski | MGMT | 47% | 11% | [29] |
| Kolorektumski | MGMT | 70% | 60% | [48] |
| Kolorektumski | MSH2 | 13% | 5% | [29] |
| Kolorektumski | ERCC1 | 100% | 40% | [34] |
| Kolorektumski | PMS2 | 88% | 50% | [34] |
| Kolorektumski | XPF | 55% | 40% | [34] |
| Glava i vrat | MGMT | 54% | 38% | [49] |
| Glava i vrat | MLH1 | 33% | 25% | [50] |
| Glava i vrat | MLH1 | 31% | 20% | [51] |
| Želudac | MGMT | 88% | 78% | [52] |
| Želudac | MLH1 | 73% | 20% | [53] |
| Jednjak | MLH1 | 77%-100% | 23%-79% | [54] |
Neki od malih polipa u defektu polja prikazanom na fotografiji otvorenog segmenta debelog crijeva mogu biti relativno benigne neoplazme. Od polipa manjih od 10 mm, pronađenih tokom kolonoskopije i praćenih ponovljenim kolonoskopijama tokom 3 godine, 25% je bilo nepromijenjeno u veličini, 35% je regresiralo ili smanjilo veličinu, dok je 40% poraslo u veličini.[55]
Nestabilnost genoma[uredi | uredi izvor]
Poznato je da karcinomi pokazuju nestabilnost genoma ili fenotip mutatora.[56] DNK koja kodira protein unutar jedra je oko 1,5% ukupne genomske DNK.[57] Unutar ove DNK koja kodira protein (zvana egzom), prosječan rak dojke ili debelog crijeva može imati oko 60 do 70 mutacija koje mijenjaju proteine, od kojih oko 3 ili 4 mogu biti mutacije „pokretači“, a preostale mogu biti “putničke” mutacije.[46] Međutim, prosječan broj mutacija sekvence DNK u cijelom genomu (uključujući regije koje ne kodiraju proteine) unutar tkiva raka dojke uzorak je oko 20.000.[58] U prosječnom uzorku tkiva melanoma (gdje melanomi imaju višu frekvenciju egzomskih mutacija[46]) ukupan broj mutacija sekvence DNK je oko 80.000.[59] Ovo se upoređuje s vrlo niskom učestalošću mutacija od oko 70 novih mutacija u cijelom genomu između generacija (od roditelja do djeteta) kod ljudi.[60][61]
Visoke frekvencije mutacija u ukupnim nukleotidnim sekvencama unutar karcinoma sugeriraju da je često rana promjena u defektima polja koja dovode do raka (npr. žuto područje na dijagramu u ovom odjeljku) nedostatak u popravci DNK. Facista et al.[34] pokazali su da veliki defekti polja oko karcinoma debelog crijeva (koji se protežu na oko 10 cm sa svake strane raka) često imaju epigenetičke defekte u 2 ili 3 proteina za popravak DNK (ERCC1, XPF ili PMS2) u cijelom području defekta polja. Nedostaci u popravci DNK uzrokuju povećane stope mutacija.[35][36][37] Nedostatak u popravci DNK, sam po sebi, može dozvoliti da se oštećenja DNK akumuliraju i sklona greškama sinteza translezije, nakon nekih od tih oštećenja može dovesti do mutacija. Osim toga, neispravan popravak ovih nakupljenih oštećenja DNK može dovesti do epimutacija. Ove nove mutacije ili epimutacije mogu pružiti proliferativnu prednost, stvarajući defekt polja. Iako mutacije/epimutacije u genima za popravak DNK same po sebi ne daju selektivnu prednost, one se mogu nositi kao putnici u ćelijama kada steknu dodatne mutacije/epimutacije koje pružaju proliferativnu prednost.
Etimologija[uredi | uredi izvor]
Termin "neoplazma" je sinonim za "tumor". „Neoplazija“ označava proces stvaranja neoplazmi/tumora, a proces se naziva „neoplazijski“ proces. Sama riječ "neoplastika" dolazi od grčkog "neo" "nov" i "plastika" "formiran, oblikovan".
Termin „tumor“ potiče od latinske imenice „tumor“ „oteklina“, konačno od glagola „tumēre“ „nabubriti“. U British Commonwealthu se obično koristi pravopis tumor, dok se u SAD-u riječ obično piše tumour.
U svom medicinskom smislu, "tumor" tradicionalno znači nenormalno oticanje mesa. Rimski medicinski enciklopedista Celsus (c. 30. pne–38. ne) opisao je četiri kardinalna znaka akutne upale kao tumor, dolor, calor i rubor (otok, bol, povećana toplota i crvenilo). (Njegova rasprava, De Medicina, bila je prva medicinska knjiga štampana 1478. nakon pronalaska pokretne štamparske mašine.)
U savremenom engleskom jeziku, riječ tumor se često koristi kao sinonim za cistastu izraslinu (ispunjenu tekućinom) ili čvrstu neoplazmu (kancerogenu ili nekanceroznu).[62] sa drugim oblicima oteklina koji se često nazivaju "otok".[63]
Srodni termini se često javljaju u medicinskoj literaturi, gdje su imenice tumefakcija i tumescencija (izvedene od pridjeva tumescent)[64] su trenutni medicinski izrazi za ne-neoplastične otekline. Ova vrsta otoka najčešće je uzrokovana upalom uzrokovanom traumom, infekcijom i drugim faktorima.
Međutim, tumori mogu biti uzrokovani drugim uvjetima osim prekomjernog rasta neoplazijskih ćelija. Ciste (kao što su lojne ciste) se takođe nazivaju tumorima, iako nemaju neoplazmatske ćelije. Ovo je standard u terminologiji medicinskog obračuna (posebno kada se utvrđuje za rast čija patologija tek treba da se utvrdi).
Također pogledajte[uredi | uredi izvor]
Referenca[uredi | uredi izvor]
- ^ "neoplasm". Lexico UK English Dictionary. Oxford University Press. Arhivirano s originala, 28. 4. 2021.
- ^ Šablon:Cite Dictionary.com
- ^ a b c d Birbrair A, Zhang T, Wang ZM, Messi ML, Olson JD, Mintz A, Delbono O (juli 2014). "Type-2 pericytes participate in normal and tumoral angiogenesis". Am. J. Physiol., Cell Physiol. 307 (1): C25–38. doi:10.1152/ajpcell.00084.2014. PMC 4080181. PMID 24788248.
- ^ Cooper GM (1992). Elements of human cancer. Boston: Jones and Bartlett Publishers. str. 16. ISBN 978-0-86720-191-8.
- ^ Taylor, Elizabeth J. (2000). Dorland's Illustrated medical dictionary (29th izd.). Philadelphia: Saunders. str. 1184. ISBN 978-0721662541.
- ^ Stedman's medical dictionary (28th izd.). Philadelphia: Lippincott Williams & Wilkins. 2006. str. Neoplasm. ISBN 978-0781733908.
- ^ "II Neoplasms". International Statistical Classification of Diseases and Related Health Problems 10th Revision (ICD-10) Version for 2010. World Health Organization. Pristupljeno 19. 6. 2014.
- ^ a b Abrams, Gerald. "Neoplasia I". Arhivirano s originala, 31. 10. 2015. Pristupljeno 23. 1. 2012.
- ^ "Cancer - Activity 1 - Glossary, page 4 of 5". Arhivirano s originala, 9. 5. 2008. Pristupljeno 8. 1. 2008.
- ^ "Medical Definition of Clone". Arhivirano s originala, 25. 10. 2012. Pristupljeno 2. 12. 2022.
- ^ Lee ES, Locker J, Nalesnik M, Reyes J, Jaffe R, Alashari M, Nour B, Tzakis A, Dickman PS (januar 1995). "The association of Epstein-Barr virus with smooth-muscle tumors occurring after organ transplantation". N. Engl. J. Med. 332 (1): 19–25. doi:10.1056/NEJM199501053320104. PMID 7990861.
- ^ "Pancreas Cancer: Glossary of Terms". Arhivirano s originala, 5. 6. 2010. Pristupljeno 8. 1. 2008.
- ^ "Tumor". Dorland's Illustrated Medical Dictionary (31st izd.). Saunders. 2007. ISBN 978-1-84972-348-0.
- ^ Tammela, Tuomas; Sage, Julien (2020). "Investigating Tumor Heterogeneity in Mouse Models". Annual Review of Cancer Biology. 4 (1): 99–119. doi:10.1146/annurev-cancerbio-030419-033413. PMC 8218894 Provjerite vrijednost parametra
|pmc=(pomoć). PMID 34164589 Provjerite vrijednost parametra|pmid=(pomoć). - ^ Asashima M, Oinuma T, Meyer-Rochow VB (1987). "Tumors in amphibia". Zoological Science. 4: 411–425.
- ^ Ambrosi D, Mollica F (2002). "On the mechanics of a growing tumor". International Journal of Engineering Science. 40 (12): 1297–316. doi:10.1016/S0020-7225(02)00014-9.
- ^ Volokh KY (septembar 2006). "Stresses in growing soft tissues". Acta Biomater. 2 (5): 493–504. doi:10.1016/j.actbio.2006.04.002. PMID 16793355.
- ^ Kastan MB (2008). "DNA damage responses: mechanisms and roles in human disease: 2007 G.H.A. Clowes Memorial Award Lecture". Mol. Cancer Res. 6 (4): 517–24. doi:10.1158/1541-7786.MCR-08-0020. PMID 18403632.
- ^ Cunningham FH, Fiebelkorn S, Johnson M, Meredith C (novembar 2011). "A novel application of the Margin of Exposure approach: segregation of tobacco smoke toxicants". Food Chem. Toxicol. 49 (11): 2921–33. doi:10.1016/j.fct.2011.07.019. PMID 21802474.
- ^ Kanavy HE, Gerstenblith MR (decembar 2011). "Ultraviolet radiation and melanoma". Semin Cutan Med Surg. 30 (4): 222–8. doi:10.1016/j.sder.2011.08.003. PMID 22123420.
- ^ Handa O, Naito Y, Yoshikawa T (2011). "Redox biology and gastric carcinogenesis: the role of Helicobacter pylori". Redox Rep. 16 (1): 1–7. doi:10.1179/174329211X12968219310756. PMC 6837368. PMID 21605492.
- ^ Bernstein C, Holubec H, Bhattacharyya AK, Nguyen H, Payne CM, Zaitlin B, Bernstein H (august 2011). "Carcinogenicity of deoxycholate, a secondary bile acid". Arch. Toxicol. 85 (8): 863–71. doi:10.1007/s00204-011-0648-7. PMC 3149672. PMID 21267546.
- ^ Katsurano M, Niwa T, Yasui Y, Shigematsu Y, Yamashita S, Takeshima H, Lee MS, Kim YJ, Tanaka T, Ushijima T (januar 2012). "Early-stage formation of an epigenetic field defect in a mouse colitis model, and non-essential roles of T- and B-cells in DNA methylation induction". Oncogene. 31 (3): 342–51. doi:10.1038/onc.2011.241. PMID 21685942.
- ^ Malkin D (april 2011). "Li-fraumeni syndrome". Genes Cancer. 2 (4): 475–84. doi:10.1177/1947601911413466. PMC 3135649. PMID 21779515.
- ^ Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, Pukkala E, Skytthe A, Hemminki K (juli 2000). "Environmental and heritable factors in the causation of cancer--analyses of cohorts of twins from Sweden, Denmark, and Finland". N. Engl. J. Med. 343 (2): 78–85. doi:10.1056/NEJM200007133430201. PMID 10891514.
- ^ Halford S, Rowan A, Sawyer E, Talbot I, Tomlinson I (juni 2005). "O(6)-methylguanine methyltransferase in colorectal cancers: detection of mutations, loss of expression, and weak association with G:C>A:T transitions". Gut. 54 (6): 797–802. doi:10.1136/gut.2004.059535. PMC 1774551. PMID 15888787.
- ^ a b Shen L, Kondo Y, Rosner GL, Xiao L, Hernandez NS, Vilaythong J, Houlihan PS, Krouse RS, Prasad AR, Einspahr JG, Buckmeier J, Alberts DS, Hamilton SR, Issa JP (septembar 2005). "MGMT promoter methylation and field defect in sporadic colorectal cancer". J. Natl. Cancer Inst. 97 (18): 1330–8. doi:10.1093/jnci/dji275. PMID 16174854.
- ^ Psofaki V, Kalogera C, Tzambouras N, Stephanou D, Tsianos E, Seferiadis K, Kolios G (juli 2010). "Promoter methylation status of hMLH1, MGMT, and CDKN2A/p16 in colorectal adenomas". World J. Gastroenterol. 16 (28): 3553–60. doi:10.3748/wjg.v16.i28.3553. PMC 2909555. PMID 20653064.
- ^ a b c Lee KH, Lee JS, Nam JH, Choi C, Lee MC, Park CS, Juhng SW, Lee JH (oktobar 2011). "Promoter methylation status of hMLH1, hMSH2, and MGMT genes in colorectal cancer associated with adenoma-carcinoma sequence". Langenbecks Arch Surg. 396 (7): 1017–26. doi:10.1007/s00423-011-0812-9. PMID 21706233. S2CID 8069716.
- ^ Amatu A, Sartore-Bianchi A, Moutinho C, Belotti A, Bencardino K, Chirico G, Cassingena A, Rusconi F, Esposito A, Nichelatti M, Esteller M, Siena S (april 2013). "Promoter CpG island hypermethylation of the DNA repair enzyme MGMT predicts clinical response to dacarbazine in a phase II study for metastatic colorectal cancer". Clin. Cancer Res. 19 (8): 2265–72. doi:10.1158/1078-0432.CCR-12-3518. PMID 23422094.
- ^ Mokarram P, Zamani M, Kavousipour S, Naghibalhossaini F, Irajie C, Moradi Sarabi M, et al. (maj 2013). "Different patterns of DNA methylation of the two distinct O6-methylguanine-DNA methyltransferase (O6-MGMT) promoter regions in colorectal cancer". Mol. Biol. Rep. 40 (5): 3851–7. doi:10.1007/s11033-012-2465-3. PMID 23271133. S2CID 18733871.
- ^ Truninger K, Menigatti M, Luz J, Russell A, Haider R, Gebbers JO, et al. (maj 2005). "Immunohistochemical analysis reveals high frequency of PMS2 defects in colorectal cancer". Gastroenterology. 128 (5): 1160–71. doi:10.1053/j.gastro.2005.01.056. PMID 15887099.
- ^ Valeri N, Gasparini P, Fabbri M, Braconi C, Veronese A, Lovat F, et al. (april 2010). "Modulation of mismatch repair and genomic stability by miR-155". Proc. Natl. Acad. Sci. U.S.A. 107 (15): 6982–7. Bibcode:2010PNAS..107.6982V. doi:10.1073/pnas.1002472107. PMC 2872463. PMID 20351277.
- ^ a b c d e Facista A, Nguyen H, Lewis C, Prasad AR, Ramsey L, Zaitlin B, et al. (2012). "Deficient expression of DNA repair enzymes in early progression to sporadic colon cancer". Genome Integr. 3 (1): 3. doi:10.1186/2041-9414-3-3. PMC 3351028. PMID 22494821.
- ^ a b Narayanan L, Fritzell JA, Baker SM, Liskay RM, Glazer PM (april 1997). "Elevated levels of mutation in multiple tissues of mice deficient in the DNA mismatch repair gene Pms2". Proc. Natl. Acad. Sci. U.S.A. 94 (7): 3122–7. Bibcode:1997PNAS...94.3122N. doi:10.1073/pnas.94.7.3122. PMC 20332. PMID 9096356.
- ^ a b Hegan DC, Narayanan L, Jirik FR, Edelmann W, Liskay RM, Glazer PM (decembar 2006). "Differing patterns of genetic instability in mice deficient in the mismatch repair genes Pms2, Mlh1, Msh2, Msh3 and Msh6". Carcinogenesis. 27 (12): 2402–8. doi:10.1093/carcin/bgl079. PMC 2612936. PMID 16728433.
- ^ a b Tutt AN, van Oostrom CT, Ross GM, van Steeg H, Ashworth A (mart 2002). "Disruption of Brca2 increases the spontaneous mutation rate in vivo: synergism with ionizing radiation". EMBO Rep. 3 (3): 255–60. doi:10.1093/embo-reports/kvf037. PMC 1084010. PMID 11850397.
- ^ O'Hagan HM, Mohammad HP, Baylin SB (2008). Lee JT (ured.). "Double strand breaks can initiate gene silencing and SIRT1-dependent onset of DNA methylation in an exogenous promoter CpG island". PLOS Genet. 4 (8): e1000155. doi:10.1371/journal.pgen.1000155. PMC 2491723. PMID 18704159.
- ^ Cuozzo C, Porcellini A, Angrisano T, Morano A, Lee B, Di Pardo A, Messina S, Iuliano R, Fusco A, Santillo MR, Muller MT, Chiariotti L, Gottesman ME, Avvedimento EV (juli 2007). "DNA damage, homology-directed repair, and DNA methylation". PLOS Genet. 3 (7): e110. doi:10.1371/journal.pgen.0030110. PMC 1913100. PMID 17616978.
- ^ Gerlinger M, Rowan AJ, Horswell S, Larkin J, Endesfelder D, Gronroos E, et al. (mart 2012). "Intratumor heterogeneity and branched evolution revealed by multiregion sequencing". N. Engl. J. Med. 366 (10): 883–92. doi:10.1056/NEJMoa1113205. PMC 4878653. PMID 22397650.
- ^ Slaughter DP, Southwick HW, Smejkal W (septembar 1953). "Field cancerization in oral stratified squamous epithelium; clinical implications of multicentric origin". Cancer. 6 (5): 963–8. doi:10.1002/1097-0142(195309)6:5<963::AID-CNCR2820060515>3.0.CO;2-Q. PMID 13094644. S2CID 6736946.
- ^ Bernstein C, Bernstein H, Payne CM, Dvorak K, Garewal H (februar 2008). "Field defects in progression to gastrointestinal tract cancers". Cancer Lett. 260 (1–2): 1–10. doi:10.1016/j.canlet.2007.11.027. PMC 2744582. PMID 18164807.
- ^ Nguyen H, Loustaunau C, Facista A, Ramsey L, Hassounah N, Taylor H, Krouse R, Payne CM, Tsikitis VL, Goldschmid S, Banerjee B, Perini RF, Bernstein C (2010). "Deficient Pms2, ERCC1, Ku86, CcOI in field defects during progression to colon cancer". J Vis Exp (41): 1931. doi:10.3791/1931. PMC 3149991. PMID 20689513.
- ^ Rubin H (mart 2011). "Fields and field cancerization: the preneoplastic origins of cancer: asymptomatic hyperplastic fields are precursors of neoplasia, and their progression to tumors can be tracked by saturation density in culture". BioEssays. 33 (3): 224–31. doi:10.1002/bies.201000067. PMID 21254148. S2CID 44981539.
- ^ Tsao JL, Yatabe Y, Salovaara R, Järvinen HJ, Mecklin JP, Aaltonen LA, Tavaré S, Shibata D (februar 2000). "Genetic reconstruction of individual colorectal tumor histories". Proc. Natl. Acad. Sci. U.S.A. 97 (3): 1236–41. Bibcode:2000PNAS...97.1236T. doi:10.1073/pnas.97.3.1236. PMC 15581. PMID 10655514.
- ^ a b c Vogelstein B, Papadopoulos N, Velculescu VE, Zhou S, Diaz LA, Kinzler KW (mart 2013). "Cancer genome landscapes". Science. 339 (6127): 1546–58. Bibcode:2013Sci...339.1546V. doi:10.1126/science.1235122. PMC 3749880. PMID 23539594.
- ^ Lochhead P, Chan AT, Nishihara R, Fuchs CS, Beck AH, Giovannucci E, Ogino S (2014). "Etiologic field effect: reappraisal of the field effect concept in cancer predisposition and progression". Mod Pathol. 28 (1): 14–29. doi:10.1038/modpathol.2014.81. PMC 4265316. PMID 24925058.
- ^ Svrcek M, Buhard O, Colas C, Coulet F, Dumont S, Massaoudi I, et al. (novembar 2010). "Methylation tolerance due to an O6-methylguanine DNA methyltransferase (MGMT) field defect in the colonic mucosa: an initiating step in the development of mismatch repair-deficient colorectal cancers". Gut. 59 (11): 1516–26. doi:10.1136/gut.2009.194787. PMID 20947886. S2CID 206950452.
- ^ Paluszczak J, Misiak P, Wierzbicka M, Woźniak A, Baer-Dubowska W (februar 2011). "Frequent hypermethylation of DAPK, RARbeta, MGMT, RASSF1A and FHIT in laryngeal squamous cell carcinomas and adjacent normal mucosa". Oral Oncol. 47 (2): 104–7. doi:10.1016/j.oraloncology.2010.11.006. PMID 21147548.
- ^ Zuo C, Zhang H, Spencer HJ, Vural E, Suen JY, Schichman SA, Smoller BR, Kokoska MS, Fan CY (oktobar 2009). "Increased microsatellite instability and epigenetic inactivation of the hMLH1 gene in head and neck squamous cell carcinoma". Otolaryngol Head Neck Surg. 141 (4): 484–90. doi:10.1016/j.otohns.2009.07.007. PMID 19786217. S2CID 8357370.
- ^ Tawfik HM, El-Maqsoud NM, Hak BH, El-Sherbiny YM (2011). "Head and neck squamous cell carcinoma: mismatch repair immunohistochemistry and promoter hypermethylation of hMLH1 gene". Am J Otolaryngol. 32 (6): 528–36. doi:10.1016/j.amjoto.2010.11.005. PMID 21353335.
- ^ Zou XP, Zhang B, Zhang XQ, Chen M, Cao J, Liu WJ (novembar 2009). "Promoter hypermethylation of multiple genes in early gastric adenocarcinoma and precancerous lesions". Hum. Pathol. 40 (11): 1534–42. doi:10.1016/j.humpath.2009.01.029. PMID 19695681.
- ^ Wani M, Afroze D, Makhdoomi M, Hamid I, Wani B, Bhat G, Wani R, Wani K (2012). "Promoter methylation status of DNA repair gene (hMLH1) in gastric carcinoma patients of the Kashmir valley". Asian Pac. J. Cancer Prev. 13 (8): 4177–81. doi:10.7314/APJCP.2012.13.8.4177. PMID 23098428.
- ^ Agarwal A, Polineni R, Hussein Z, Vigoda I, Bhagat TD, Bhattacharyya S, Maitra A, Verma A (2012). "Role of epigenetic alterations in the pathogenesis of Barrett's esophagus and esophageal adenocarcinoma". Int J Clin Exp Pathol. 5 (5): 382–96. PMC 3396065. PMID 22808291.
- ^ Hofstad B, Vatn MH, Andersen SN, Huitfeldt HS, Rognum T, Larsen S, Osnes M (septembar 1996). "Growth of colorectal polyps: redetection and evaluation of unresected polyps for a period of three years". Gut. 39 (3): 449–56. doi:10.1136/gut.39.3.449. PMC 1383355. PMID 8949653.
- ^ Schmitt MW, Prindle MJ, Loeb LA (septembar 2012). "Implications of genetic heterogeneity in cancer". Ann. N. Y. Acad. Sci. 1267 (1): 110–6. Bibcode:2012NYASA1267..110S. doi:10.1111/j.1749-6632.2012.06590.x. PMC 3674777. PMID 22954224.
- ^ Lander ES, Linton LM, Birren B, Nusbaum C, Zody MC, Baldwin J, Devon K, Dewar K, Doyle M, FitzHugh W, et al. (februar 2001). "Initial sequencing and analysis of the human genome" (PDF). Nature. 409 (6822): 860–921. Bibcode:2001Natur.409..860L. doi:10.1038/35057062. PMID 11237011.
- ^ Yost SE, Smith EN, Schwab RB, Bao L, Jung H, Wang X, Voest E, Pierce JP, Messer K, Parker BA, Harismendy O, Frazer KA (august 2012). "Identification of high-confidence somatic mutations in whole genome sequence of formalin-fixed breast cancer specimens". Nucleic Acids Res. 40 (14): e107. doi:10.1093/nar/gks299. PMC 3413110. PMID 22492626.
- ^ Berger MF, Hodis E, Heffernan TP, Deribe YL, Lawrence MS, Protopopov A, et al. (maj 2012). "Melanoma genome sequencing reveals frequent PREX2 mutations". Nature. 485 (7399): 502–6. Bibcode:2012Natur.485..502B. doi:10.1038/nature11071. PMC 3367798. PMID 22622578.
- ^ Roach JC, Glusman G, Smit AF, Huff CD, Hubley R, Shannon PT, et al. (april 2010). "Analysis of genetic inheritance in a family quartet by whole-genome sequencing". Science. 328 (5978): 636–9. Bibcode:2010Sci...328..636R. doi:10.1126/science.1186802. PMC 3037280. PMID 20220176.
- ^ Campbell CD, Chong JX, Malig M, Ko A, Dumont BL, Han L, et al. (novembar 2012). "Estimating the human mutation rate using autozygosity in a founder population". Nat. Genet. 44 (11): 1277–81. doi:10.1038/ng.2418. PMC 3483378. PMID 23001126.
- ^ Tumor in Medical Encyclopedia
- ^ "Swelling". MedlinePlus Medical Encyclopedia. 14. 10. 2012.
- ^ "tumescence". Oxford English Dictionary (Online izd.). Oxford University Press. (Subscription or participating institution membership required.)
Vanjski linkovi[uredi | uredi izvor]
