Organofosforni spoj
Organofosforni spojevi su organski spojevi koj sadrže fosfor.[1] Primarno se koriste u suzbijanju štetočina, kao alternativi hloriranim ugljovodicima koji opstaju u životnoj sredini. Neki organofosforni spojevi su visoko efikasna insekticidi, iako su neka izuzetno toksična za ljude, uključujući nervne agens sarin i VX.[2]
Hemija organofosfornih spojeva je odgovarajuća nauka o njihovim svojstvima i reaktivnosti. Fosfor je, poput dušika, u grupi 15 periodnog sistema, pa tako fosforni spojevi i spojevi dušika imaju mnoga slična svojstva.[3][4][5] Definicija organofosfornih spojeva je različita, što može dovesti do zabune. U industrijskoj hemiji i hemiji životne sredine, organofosforni spoj mora sadržavati samo organski supstituent, ali ne mora imati direktnu vezu fosfor-ugljik (PC). Stoga je veliki dio pesticida (npr. malation), često uključen u ovu klasu spojeva.
Fosfor može imati razna oksidaciono stanja, a organofosforni spojevi su klasicirani na osnovu toga što su derivati fosfora (V) u odnosu na fosfor (III), koji su pretežne klase spojeva. U opisnoj, ali samo povremeno korištenoj nomenklaturi, fosforni spopjevi se identificiraju pomoću koordinacionog broja σ i valencije λ . U ovom sistemu fosfin je σ3λ3spoj.
Glavne kategorije organofosfornih (V) spojeva[uredi | uredi izvor]
Fosfatni estri i amidi[uredi | uredi izvor]
Fosfatni estri imaju opću strukturu P (= O) (ILI)3 obilježje P (V). Takve vrste su od tehnološke važnosti kao usporivači gorenja i plastifikatori. Bez P-C veze, ov jspojevi, u tehničkom smislu, nisu organofosforni, već estri fosforne kiseline. Mnogi se derivati nalaze u prirodi, kao što je fosfatidilholin. Estri fosfata sintetiziraju se pomoću alkoholiza fosfornog oksihlorida. Poznati su razni miješani derivati amido-alkoksa, jedan medicinski značajan primjer je lijek protiv raka ciklofosfamid. Također derivati koji sadrže tiofosforilnu skupinu (P = S) uključuju pesticid malation. Organofosfati pripremljeni u najvećoj mjeri su cink-ditiofosfati, kao aditivi za motorna ulja. Nekoliko miliona kilograma ovog koordinacionog kompleksa proizvedi se godišnje reakcijom fosfornog pentasulfida sa alkoholima.
Fosfonske i fosfinske kiseline i njihovi esteri[uredi | uredi izvor]
Fosfonati su estri fosfonske kiseline i imaju opću formulu RP(= O) (OR')2. Fosfonati imaju brojne tehničke primjene, a poznati član je glifosat, poznatiji kao Roundup. S formulom (HO)2P(O)CH2NHCH2CO2H, ovaj derivat glicin jedana je među najčešće korištenim herbicidima. Bisfosfonati su klasa lijekova za liječenje osteoporoze. Agens nervnog plina sarin, koji sadrži i C-P i F-P veze, je fosfonat.
Fosfinati imaju dvije P-C veze, sa općom formulom R2P(= O)(OR '). Komercijalno važan član je herbicid Glufozinat. Slično gore navedenom glifosatu, ima strukturu CH3P(O)(OH)CH2CH2CH(NH2)CO2 H.
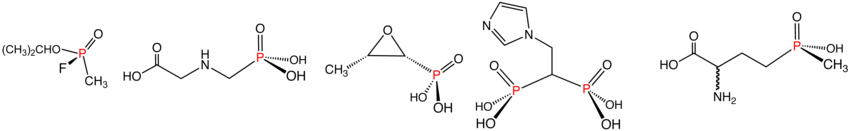
Ilustrativni primeri fosfonata i fosfinata prikazanim redosledom: Sarin (fosfonat), glifosat (fosfonat), fosfomicin (fosfonat), zoledronska kiselina (fosfonat) i glufozinat (fosfinat).
U vodenoj otopini fosfonske kiseline ionizuju dajući odgovarajuće organofosfonate.
Glavni metod za sintezu ovih spojeva je Reakcija Michaelis – Arbuzov. Naprimjer, dimetilmetilfosfonat (vidi gornju sliku) nastaje preuređivanjem trimetilfosfita, koji je kataliziran sa metil-jodidom. U Horner-Wadsworth-Emmonsovoj reakciji i Seyferth-Gilbertovoj homologaciji fosfonati se koriste u reakcijama sa karbonil spojevima. Kabachni-Fieldsova reakcija je metod za pripremu aminofosfonata. Ovi spojevi sadrže vrlo inertnu vezu između fosfora i ugljika. Zbog toga se hidroliziraju, dajući derivate fosfonske i fosfinske kiseline, ali ne i fosfat.
=Fosfinski oksidi, imidi i halkogenidi[uredi | uredi izvor]
Fosfinovi oksidi (oznaka σ4λ5) imaju opću strukturu R3P=O sa formalnim oksidacionim stanjem V. Oblik fosfinovih oksida ima vodikove veze i neki su zato topljivi u vodi. P=O veza je vrlo polarna sa dipolnim momentom od 4,51 D za trifenilfosfin-oksid. Spojevi koji se odnose na fosfin-okside uključuju fosfin imid (R3PNR ') i srodne halkogenide (R 3PE, gdje je E = S, Se, Te). Ovi spojevi su neki od termički najstabilnijih organofosfornih spojeva.
Soli fosfonija i fosforani[uredi | uredi izvor]
Spojevi s formulom [PR4+]X– sadrže fosfonijeve soli. Ove vrste su jedinjenja tetraedarnog fosfora (V). Iz komercijalne perspektive, najvažniji član je tetrakis (hidroksimetil) fosfonij hlorid, [P (CH2OH)4]Cl, koji se koristi kao usporivač vatre u tekstilu. Godišnje se od hlorida i srodnog sulfata proizvede približno 2 miliona kg. Nastaju reakcijom fosfina sa formaldehidom u prisustvu mineralne kiseline: PH3 + HX + 4 CH2O → [P(CH2OH)4+]X− Razne soli fosfonija mogu se pripremiti alkilacijom i arilacijom organofosfina:
- PR3 + R'X → [PR3R'+]X−
Metilacija trifenilfosfina prvi je korak u pripremi Wittigovog reagensa.

Ilustrativni fosforni (V) spojevi: fosfonijev ion P(CH2OH)4+,dvije rezonantne strukture za Wittigov reagens Ph3PCH2 i pentafenilfosforan, rijetki pentaorganofoforni spoj.
Roditeljski fosforan (σ5λ5) je PH5, što je nepoznato. Srodni spojevi koji sadrže i halogenide i organske supstituente na fosforu prilično su česti. Oni sa pet organskih supstituenata su rijetki, iako je poznat P(C6H5)5, izvedeni iz P(C6H5)4+ reakcijom sa fenillitijem. Fosfor ilidi su nezasićeni fosforani, poznati kao Wittigov reagens, npr. CH2P(C6H5)3. Ovi spojevi sadrže tetraedarni fosfor (V) i smatraju se srodnicima fosfinovih oksida. Oni su također izvedeni iz fosfonijumovih soli, ali deprotonacijom, a ne alkilacijom.
Glavne kategorije organofosfornih (III) spojeva[uredi | uredi izvor]
Fosfiti, fosfoniti i fosfiniti[uredi | uredi izvor]
Fosfiti, koji se ponekad nazivaju i fosfitni esteri, imaju opću strukturu P(OR)3, sa oksidacionim stanjem +3. Takve vrste nastaju alkoholizmom fosfor-trihlorida:
- PCl3 + 3 ROH → P(OR)3 + 3 HCl
Reakcija je općenita, stoga je poznat velik broj takvih vrsta. Fosfiti se koriste u [[Perkowa] eakcija]] i Michaelis-Arbuzovljeva reakcija. Oni također služe kao ligandi u organometalnoj hemiji. Međuprodukti između fosfita i fosfina su fosfoniti (P(OR)2R') i fosfinit (P(OR)R'2) . Takve vrste nastaju reakcijama alkoholize odgovarajućih fosfinskih i fosfonskih hlorida ((PCIR'2) i PCl2R').
Fosfini[uredi | uredi izvor]
Matični spoj fosfina je PH3, zvani fosfin u SAD-u i Britanskom Komonveltu, ali fosfan na drugim mestima.[6] Zamjena jednog ili više vodikovih centara organskim supstituentima (alkil, aril) daje PH3−xRx, organofosfin, koji se obično naziva fosfini.

Razni redukovani organofosforni spojevi:
kompleks organofosfinskog pincerskog liganda,
hiralni difosfin koji se koristi u homogenoj katalizi,
primarni fosfin PhPH2 i
fosfor (I) spoj (PPh)5.
Poređenje fosfina i amina[uredi | uredi izvor]
Atom fosfora u fosfinima ima formalno stanje oksidacije –3 (σ3λ3) i fosforni su analozi amina. Poput amina, fosfini imaju trigonsku piramidnu molekulsku geometriju, iako često sa manjim uglovima C-E-C (E = N, P), barem u odsustvu sternih efekata. C-P-C ugao veze je 98,6 ° za trimetilfosfin, povećavajući se na 109,7° kada se metilne grupe zamenjuju sa terc –butil grupu. Kada se koriste kao ligandi, sterna masa tercijarnih fosfina procjenjuje se prema njihovom uglu konusa. Prepreka da se dogodi za piramidnu inverziju je također mnogo veća od inverzije dušika, pa se fosfini sa tri različita supstituenta mogu razgraditi u termički stabilni optički izomer. Fosfini su često manje bazni od odgovarajućih amina, naprimjer, sam fosfonijev ion ima pKa –14 u odnosu na 9,21 za amonijev ion; trimetilfosfonij ima pKa od 8,65, u odnosu na 9,76 za trimetilamonij. Međutim, trifenilfosfin (pKa 2,73) osnovniji je od trifenilamina (pKa −5), uglavnom zato što usamljeni par dušika u NPh3 djelimično je delokaliziran u tri fenilna prstena. Dok je usamljeni par na dušiku delokaliziran u pirolu, usamljeni par na atomu fosfora u fosfornom ekvivalentu pirola (fosfola) nije. Reaktivnost fosfina poklapa se sa reakcijom amina s obzirom na nukleofilnost u stvaranju fosfonijevih soli s općom strukturom PR4+X< sup>–. Ovo se svojstvo koristi u Appelovoj reakciji za pretvaranje alkohola u alkil-halogenide. Fosfini se lahko oksiduju do odgovarajućih fosfinovih oksida, dok se aminski oksidi stvaraju manje lahko. Djelimično iz ovog razloga, fosfini se u prirodi vrlo rijetko susreću.
Sintetski putevi[uredi | uredi izvor]
Iz komercijalne perspektive, najvažniji fosfin je trifenilfosfin, kojeg se godišnje proizvede nekoliko miliona kilograma. Priprema se iz reakcije hlorobenzena, PCl3 i natrija. Fosfini više specijalizirane prirode obično se pripremaju drugim putevima.[7] Fosforni halogenidi prolaze Nukleofilno premještanje u organometalnim reagensima, kao što je Grignardov reagens. Suprotno tome, neke sinteze povlače nukleofilno premještanje ekvivalenata fosfidnih aniona ("R2P−") putem aril- i alkil halida. Primarni (RPH2) i sekundarni fosfini (RRPH and R2PH) dodati u alkene u prisustvu jake baze (npr. KOH u DMSO). Primjenjuju se pravilo Markovnikova. Slične reakcije se dešavaju u alkinima.[8] Baza nije potrebna za alkene s nedostatkom elektrona (npr. derivati akrilonitrila) i alkina.
Pod uslovima slobodnih radikala P-H veze primarnih i sekundarnih fosfina dodaju se preko alkena. Takve se reakcije odvijaju sa regiohemijom protiv pravila Markovnikova. AIBN ili organski peroksid koriste se kao inicijatori. Tercijarni fosfinski oksidi i sulfidi mogu se reducirati pomoću hlorosilana i drugih reagensa.
Reakcije[uredi | uredi izvor]
Organofosfini su nukleofili i ligandi. Dvija glavna načina primjene su kao reagenasa u Wittigovoj reakciji i kao potpora fosfinskom ligandu u homogenoj katalizi. O njihovoj nukleofilnosti svjedoče njihove reakcije s alkil-halogenidima da bi se dobila fosfonijeva so. Fosfini su nukleofilni katalizatori u organskoj sintezi, kao što su npr. Rauhut-Currier reakcija i Baylis-Hillmanova reakcija. Fosfini su redukciono sredstvo, kao što je prikazano u Staudingerovoj redukciji za pretvaranje organskih azida u amine i u Mitsunobuovoj reakciji za pretvaranje alkohola u estere. U tim procesima, fosfin se oksidira u fosfor (V). Utvrđeno je i da fosfini reduciraju aktivirane karbonilne grupe, naprimjer redukcija α-keto estera u α-hidroksi ester u shemi 2.[9] U predloženom mehanizmu reakcije, prvi je proton posuđen iz metilne grupe u trimetilfosfinu (trifenilfosfin ne reaguje).
Primarni i sekundarni fosfini[uredi | uredi izvor]
Pored ostalih reakcija povezanih s fosfinima, one koje nose P-H skupine pokazuju dodatnu reaktivnost povezanu s P-H vezama. Lahko se deprotoniraju, koristeći jake baze dajući fosfidne anione. Primarni i sekundarni fosfini se uglavnom pripremaju redukcijom srodnih halogenida ili fosfornih estera I halida, ali fosfonati se takođe mogu redukovati u primarne fosfine, naprimer:[10]

Gore prikazani binaftil primarni fosfin pokazuje izvanrednu stabilnost u zraku, što se pripisuje visokom stepenu konjugacija u binaftilnoj kičmi.[11] The same explanation was used to explain the air-stability of the first highly fluorescent primary phosphine, BodPH2.[12]
Fosfaalkeni i fosfaalkini[uredi | uredi izvor]
Spojevi sa višestrukim vezama ugljičnog fosfora (III) nazivaju se fosfaalkeni (R2C=PR) i fosfaalkini (RC≡P). Po strukturi su slični, ali ne i po reaktivnosti, imini (R2C=NR), odnosno nitrilI (RC≡N). U spoju fosforin, jedan atom ugljika u benzenu zamenjen je fosforom. Tipovi ove vrste su relativno rijetki, ali su iz tog razloga zanimljive istraživačima. Općenita metoda za sintezu fosfaalkena je 1,2-eliminacija pogodnih prekursora, inicirana termički ili pomoću baze kao što je DBU, DABCO ili trietilamin:
Termoliza Me2PH generira CH2=PMe, nestabilnu vrstu u zgusnutoj fazi.
Organofosforni (0), (I) i (II) spojevi[uredi | uredi izvor]
Spojevi u kojima fosfor postoji u formalnom oksidacijskom stanju manjem od III su neuobičajeni, ali primjeri su poznati za svaku klasu. Vrste organskog fosfora (0) mogu se ilustrovati aduktima karbena, [P (NHC)]2, gdje je NHC N-heterociklični karben.[13] S formulama (RP)n odnosno (R2P)2, generiraju se spojevi fosfora (I) i (II), redukcijom srodnih organofosfornih (III) hlorida:
Difosfeni, s formulom R2P2, formalno sadrže dvostruke veze fosfor-fosfor. Ove vrste fosfora (I) su rijetke, ali su stabilne pod uvjetom da su organski supstituenti dovoljno veliki da spriječe povezivanje. Poznati su mnogi miješani valentni spojevi, npr. kavez difosfena, sa formulom P7(CH3)3.
Također pogledajte[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ Merriam-Webster, Merriam-Webster's Unabridged Dictionary, Merriam-Webster, arhivirano s originala, 25. 5. 2020, pristupljeno 22. 1. 2021.
- ^ Lewis, Robert Alan (1998). Lewisʼ Dictionary of Toxicology. CRC Lewis. str. 763. ISBN 978-1-56670-223-2. Pristupljeno 18. 7. 2013.
- ^ Dillon, K. B.; Mathey, F.; Nixon, J. F. (1997) Phosphorus. The Carbon Copy; John Wiley & Sons, ISBN 0-471-97360-2
- ^ Quin, L. D. (2000) A Guide to Organophosphorus Chemistry; John Wiley & Sons, ISBN 0-471-31824-8
- ^ Racke, K.D. (1992). "Degradation of organophosphorus insecticides in environmental matrices", pp. 47–73 in: Chambers, J.E., Levi, P.E. (eds.), Organophosphates: Chemistry, Fate, and Effects. Academic Press, San Diego, ISBN 0121673456.
- ^ {Gold-Book-Ref |title=phosphanes |file=P04548}}
- ^ Downing, J.H.; Smith, M.B. (2003). "Phosphorus Ligands". Comprehensive Coordination Chemistry II. 2003: 253–296. doi:10.1016/B0-08-043748-6/01049-5. ISBN 9780080437484.
- ^ Arbuzova, S. N.; Gusarova, N. K.; Trofimov, B. A. (2006). "Nucleophilic and free-radical additions of phosphines and phosphine chalcogenides to alkenes and alkynes". Arkivoc. v (5): 12–36. doi:10.3998/ark.5550190.0007.503.
- ^ Zhang, W.; Shi, M. (2006). "Reduction of activated carbonyl groups by alkyl phosphines: formation of α-hydroxy esters and ketones". Chemical Communications. 2006 (11): 1218–1220. doi:10.1039/b516467b.
- ^ Hiney, Rachel M.; Higham, Lee J.; Müller-Bunz, Helge; Gilheany, Declan G. (2006). "Taming a Functional Group: Creating Air-Stable, Chiral Primary Phosphanes". Angewandte Chemie International Edition. 45 (43): 7248–7251. doi:10.1002/anie.200602143. PMID 17022105.
- ^ https://pubs.acs.org/doi/full/10.1021/om200070a
- ^ https://www.onlinelibrary.wiley.com/doi/10.1002/anie.201108416[mrtav link]
- ^ Wang, Yuzhong; Xie, Yaoming; Wei, Pingrong; King, R. Bruce; Schaefer, Iii; Schleyer, Paul v. R.; Robinson, Gregory H. (2008). "Carbene-Stabilized Diphosphorus". Journal of the American Chemical Society. 130 (45): 14970–1. doi:10.1021/ja807828t. PMID 18937460.
Vanjski linkovi[uredi | uredi izvor]
- organophosphorus chemistry @ users.ox.ac.uk Arhivirano 27. 4. 2006. na Wayback Machine; @ www.chem.wisc.edu
- NMR predictor for organophosphorus compound chemical shifts from Alan Brisdon's Research Group Link






