Razlika između verzija stranice "Pirol"
| [pregledana izmjena] | [pregledana izmjena] |
No edit summary |
|||
| Red 1: | Red 1: | ||
{{Infokutija hemijski spoj |
{{Infokutija hemijski spoj |
||
| Strukturna formula = [[Datoteka:Pyrrole-2D-full.svg |250px|thumb|Strukturna formula pirola u kojoj je aromatičnost označena isprekidanom vezom]] <br> [[Datoteka:Pyrrole-2D-numbered.svg |250px|]][[Datoteka:Pyrrole-CRC-MW-3D-balls-A.png|thumb|250px|[[Model štap i lopta]] molekule pirola]][[Datoteka:Pyrrole-CRC-MW-3D-vdW.png|thumb|[[Model popune prostora]] molekule pirola]] |
|||
| Strukturna formula = [[Datoteka:Pyrrole-2D-full.svg|180px]] |
|||
| Hemijski spoj = Pirol |
| Hemijski spoj = Pirol |
||
| Druga imena = Azol |
| Druga imena = Azol |
||
| Sumarna formula = {{Chem|C|4|H|5|N|}} |
|||
| CAS registarski broj =109-97-7 |
| CAS registarski broj =109-97-7 |
||
| SMILES = N1C=CC=C1<br> c1cc[nH]c1 |
| SMILES = N1C=CC=C1<br> c1cc[nH]c1 |
||
| Red 17: | Red 17: | ||
| Viskoznost = 0,001225 Pa s |
| Viskoznost = 0,001225 Pa s |
||
| Dipolni moment = |
| Dipolni moment = |
||
| NFPA 704 = {{NFPA 704|H = 2|F = 2| R = 0}} |
| NFPA 704 = {{NFPA 704 |H = 2 |F = 2| R = 0}} |
||
}} |
}} |
||
'''Pirol''' ([[grčki jezik|grč.]] πυρρός - ''pyrόs'' = crven kao vatra + [alkoh]ol) je [[heterociličnost|heterociklični]] [[Aromatičnost|aromatski]] [[organski spoj]], petočlani prsten sa [[hemijska formula|formulom]] [[ugljik|C]]<sub>4</sub>[[vodik|H]]<sub>4</sub>[[dušik|N]]H.<ref>{{cite book |
'''Pirol''' ([[grčki jezik|grč.]] πυρρός - ''pyrόs'' = crven kao vatra + [alkoh]ol) je [[heterociličnost|heterociklični]] [[Aromatičnost|aromatski]] [[organski spoj]], petočlani prsten sa [[hemijska formula|formulom]] [[ugljik|C]]<sub>4</sub>[[vodik|H]]<sub>4</sub>[[dušik|N]]H.<ref>{{cite book |
||
| Red 33: | Red 34: | ||
Piroli su komponente više složenih makrociklusa, uključujući [[porfirin]]e [[hem]]a, [[hlorin]]e, bakteriohlorine, [[hlorofil]] i [[porfirin]]ogene.<ref name="Jonas Jusélius and Dage Sundholm 2000 2145–2151">{{cite journal | title = The aromatic pathways of porphins, chlorins and bacteriochlorins |first1=Jonas |last1=Jusélius |first2=Dage |last2=Sundholm | journal = Phys. Chem. Chem. Phys. | year = 2000 | volume = 2 | pages = 2145–2151 | doi = 10.1039/b000260g | issue = 10}}{{open access}}</ref> |
Piroli su komponente više složenih makrociklusa, uključujući [[porfirin]]e [[hem]]a, [[hlorin]]e, bakteriohlorine, [[hlorofil]] i [[porfirin]]ogene.<ref name="Jonas Jusélius and Dage Sundholm 2000 2145–2151">{{cite journal | title = The aromatic pathways of porphins, chlorins and bacteriochlorins |first1=Jonas |last1=Jusélius |first2=Dage |last2=Sundholm | journal = Phys. Chem. Chem. Phys. | year = 2000 | volume = 2 | pages = 2145–2151 | doi = 10.1039/b000260g | issue = 10}}{{open access}}</ref> |
||
==Svojstva== |
|||
Pirol je bezbojna hlapljiva tekućina koja lahko potamni nakon izlaganja zraku, a obično se neposredno prije upotrebe prečisti [[destilacija|\destilacijom]]. <ref>{{cite book | title = Purification of Laboratory Chemicals | edition = 5th |last1=Armarego |first1=Wilfred L. F. |last2=Chai |first2=Christina L. L. | year = 2003 | publisher = Elsevier | pages = 346}}</ref> Pirol je 5-očlani [[aromatičnost|aromatski]] heterociklus, poput [[furan]]a i [[tiofen]]a. Za razliku od njih, dipolan je, pri čemu je pozitivni kraj na strani heteroatoma, sa dipolnim momentom od 1,58 [[Debej (jedinica)|D]]. U CDCl<sub>3</sub>, ima hemijske pomake na 6,68 (H2, H5) i 6,22 (H3, H4). |
|||
Pirol je slabo bazni, sa konjugatnom kiselinom p''K''<sub>a</sub> od −3.8. Većina termodinamično stabilnih pirolskik kationa (C<sub>4</sub>H<sub>6</sub>N<sup>+</sup>) formira se putem protonacije na poziciji 2. Substitucijs pirola alkilnim spojevima daje mnogo baznije molekule —naprimjer, tetrametilpirol ima konjugatnu kiselinu p''K''<sub>a</sub>od +3,7. Pirol je također i slabo kiseo na položaju N–H, sa p''K''<sub>a</sub> na 17,5. |
|||
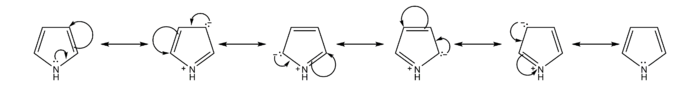
:[[Datoteka:Pyrrole Resonance.png|thumb|left|700px|Resonanca članova pirola]]{{clear left}} |
|||
==Historija== |
|||
Pirol je prvi otkrio F. F. Runge, [[1834]]., kao sastavnu komponentu [[katran]]a.<ref>{{cite journal|first=F. F. |last=Runge |date=1834 |url=http://babel.hathitrust.org/cgi/pt?id=wu.89048351654;view=1up;seq=81 |title=Ueber einige Produkte der Steinkohlendestillation |trans-title=On some products of coal distillation |journal=Annalen der Physik und Chemie |volume=31 |page=65–78}} {{open access}} See especially pages 67–68, where Runge names the compound ''Pyrrol'' (fire oil) or ''Rothöl'' (red oil).</ref> In 1857, it was isolated from the pyrolysate of bone. Its name comes from the Greek ''pyrrhos'' ({{lang|grc|πυρρός}}, “fiery”), from the reaction used to detect it—the red color that it imparts to wood when moistened with [[hydrochloric acid]].<ref name="Ullmann">{{Ullmann|first=Albrecht Ludwig |last=Harreus |title=Pyrrole |doi=10.1002/14356007.a22_453}}</ref> |
|||
==Prirodni izvori== |
|||
[[Datoteka:Heme b.svg|150px|thumb|left|Hem b]] |
|||
Piroli se nalaze u različitim biološkim kontekstima, kao dijelovi [[kofaktor]]a i prirodnih proizvoda. Općerašireni prirodni proizvodi molekula koje sadrže pirole uključuju [[vitamin B12|vitamin B<sub>12</sub>]], žučne pigmentge kao što su [[bilirubin]] i [[biliverdin]] i [[pofirin]]e [[hem]]a, [[hlorofi]]a, [[hlorin]]e, [[bakteriohlorin]]e i [[porfirin]]ogene.<ref name="Jonas Jusélius and Dage Sundholm 2000 2145–2151"/> Ostali sekundarni [[metabolit]]i koji sadrže pirole uključuju PQQ, makaluvamine M, rijanodin, razinilam, lamelarin, prodigiosin, mirmikarin i skeptrin. Piroli se također nalaze u nekoliko lijekova, uključujući [[atorvastatin]], [[ketorolak]] i [[sunitinib]]. |
|||
Jedna od prvih sintetskih molekula koje sadrže pirol bio je hemin, što je izveo [[Franz Joseph Emil Fischer | Emil Fischer]], [[1929]].<ref>{{cite web|last=Emil|first=Fischer|title=Nobel Prize Lecture|url=http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1930/fischer-lecture.pdf)}}</ref> |
|||
{{clear}} |
|||
==Sinteze== |
|||
Pirol se industrijski priprema obradom [[furan]]a sa [[amonijak]]om, u prisustvu krutih kiselinskih [[katalizator]]a, kao što su [[silicij|SiO<sub>2</sub>]] i [[alumij|Al<sub>2</sub>O<sub>3</sub>]].<ref name="Ullmann"/> |
|||
[[Datoteka:Pyrrolsynthese1.svg|200px|center|Sinteza pirola od furana]] |
|||
Pirol se može dobiti katalitičkom dehidratacijom pirolidina. |
|||
===Laboratorijski načini === |
|||
Opisano je nekoliko puteva sinteze pirolskog prstena.<ref name="Lubell">{{cite journal|last1=Lubell |first1=W. |last2=Saint-Cyr |first2=D. |last3=Dufour-Gallant |first3=J. |last4=Hopewell |first4=R. |last5=Boutard |first5=N. |last6=Kassem |first6=T. |last7=Dörr |first7=A. |last8=Zelli |first8=R. |url=https://www.thieme.de/en/thieme-chemistry/sos-knowledge-updates-2013-58727.htm |title= 1''H''-Pyrroles (Update 2013) |journal=Science of Synthesis |date=2013 |volume=2013 |issue=1 |page=157–388}}</ref> |
|||
====Hantzschova sinteza pirola==== |
|||
{{Glavni|Hantzschova sinteza pirola pyrrole}} |
|||
Hantzschova sinteza pirola je reakcija β-ketoestera '''(1)''' sa amonijakom (ili primarnim aminima) i α-haloketonima '''(2)''' koja daje substituirane pirole '''(3)'''.<ref>{{cite journal | last1 = Hantzsch | first1 = A. | year = 1890 | title = Neue Bildungsweise von Pyrrolderivaten | trans_title = New methods of forming pyrrole derivatives | url = https://babel.hathitrust.org/cgi/pt?id=uc1.b3481786;view=1up;seq=1484 | journal = Berichte der deutschen chemischen Gesellschaft | volume = 23 | issue = | pages = 1474–1476 | doi=10.1002/cber.189002301243}} {{open access}}</ref><ref>{{cite journal | last1 = Feist | first1 = Franz | year = 1902 | title = Studien in der Furan- und Pyrrol-Gruppe | trans_title = Studies in the furan and pyrrole groups | url = https://babel.hathitrust.org/cgi/pt?id=uiug.30112025693646;view=1up;seq=305 | journal = Berichte der deutschen chemischen Gesellschaft | volume = 35 | issue = | pages = 1537–1544 | doi = 10.1002/cber.19020350263}} {{open access}}</ref> |
|||
[[Datoteka:Hantzsch Pyrrole Synthesis Scheme.png|center|300px|Hantzschova sinteza pirola]] |
|||
====Knorrova sinteza pirola==== |
|||
{{Glavni|Knorrova sinteza pirola}} |
|||
Knorrova sinteza pirola uključuje reakciju α-amino ketona ili α-amino-β-ketoestera sa aktiviranim metilenskim spojem.<ref>{{Cite journal | doi = 10.1002/cber.18840170220| title = Synthese von Pyrrolderivaten | trans_title = Synthesis of pyrrole derivatives | journal = Berichte der deutschen chemischen Gesellschaft| volume = 17| issue = 2| pages = 1635–1642| year = 1884| last1 = Knorr | first1 = Ludwig | url = https://babel.hathitrust.org/cgi/pt?id=uc1.b3481769;view=1up;seq=65 }} {{open access}}</ref><ref>{{cite journal| last=Knorr |first=L. | title = Synthetische Versuche mit dem Acetessigester | trans_title = Synthesis experiments with the [ethyl] ester of acetoacetic acid | journal=Annalen der Chemie | year=1886| volume=236| pages= 290–332 | url = https://babel.hathitrust.org/cgi/pt?id=hvd.hx3kie;view=1up;seq=702 | doi=10.1002/jlac.18862360303}} {{open access}}</ref><ref>{{Cite journal | doi = 10.1002/cber.19020350392| title = Ueber die Bildung von Pyrrolderivaten aus Isonitrosoketonen | trans_title = On the formation of pyrrole derivatives from isonitrosketones | journal = Berichte der deutschen chemischen Gesellschaft| volume = 35| issue = 3| pages = 2998–3008| year = 1902| last1 = Knorr | first1 = L.| last2 = Lange | first2 = H. | url = https://babel.hathitrust.org/cgi/pt?id=uc1.b3481898;view=1up;seq=470 }} {{open access}}</ref> Ovaj metod uključuje reakciju α-[[amini|amino]] [[keton]]a '''(1)''' i spoja koji sadrži [[metilen|metilensku grupu]] α za (vezan za slijedeći ugljik) [[karbonil grupa|karbonilnu grupu]] '''(2)'''.<ref>{{cite book|last=Corwin |first=Alsoph Henry |chapter=Chapter 6: The Chemistry of Pyrrole and its Derivatives |editor-first=Robert Cooley |editor-last=Elderfield |title=Heterocyclic Compounds |volume=1 |location=New York, NY |publisher=Wiley |date=1950 |page=287}}</ref> |
|||
[[Datoteka:Knorr Pyrrole Synthesis Scheme.png|center|350px| Knorrova sinteza pirola]] |
|||
====Paal–Knorrova sinteza pirola ==== |
|||
{{Glavni|Paal–Knorrova sinteza pirola}} |
|||
Paal–Knorrova sinteza pirola, počiva na reakciji 1,4-dikarbonilnog spoja sa amonijakom ili primarnim aminom, kada se dobija supstituirani pirol.<ref name="Paal1">{{citation | last=Paal|first= C.| title= Ueber die Derivate des Acetophenonacetessigesters und des Acetonylacetessigesters | journal=Berichte der deutschen chemischen Gesellschaft| year=1884| volume=17| pages=2756–2767 | url=https://babel.hathitrust.org/cgi/pt?id=uc1.b3481769;view=1up;seq=1188 |doi=10.1002/cber.188401702228}} {{open access}}</ref><ref name="Knorr1">{{citation | last=Knorr|first= Ludwig| title=Synthese von Furfuranderivaten aus dem Diacetbernsteinsäureester | trans_title = Synthesis of furan derivatives from the [diethyl] ester of 2,3-diacetyl-succinic acid | journal=Berichte der deutschen chemischen Gesellschaft| year=1884| volume=17| pages=2863-2870| url=https://babel.hathitrust.org/cgi/pt?id=uc1.b3481769;view=1up;seq=1295 | doi=10.1002/cber.188401702254}} {{open access}}</ref> |
|||
[[Datoteka:Paal-Knorr Pyrrole Synthesis.svg|center|300px|Paal–Knorrova sinteza pirola]] |
|||
====Van Leusenova reakcija==== |
|||
{{Glavni|Van Leusen reakcija}} |
|||
Za dobijanje pirola može se upotrebiti i Van Leusenova reakcija, koja uključuje kontakt [[tozilmetil-izocijanid]]a (TosMIC) sa [[enon]]om u prisustvu baze, u [[Michaelova addicija| Michaelovoj adiciji]]. Tada 5-''endo'' ciklizacija formira 5-očlani prsten, koji reagira eliminaciju the tozil grupe. Zadnji korak je tautomerizacija ka pirolu. |
|||
[[Datoteka:Van Leusen Mechanism.jpg|center|700px|Mechanizam Van Leusenove reakcije u formiranju pirola]] |
|||
====Barton–Zardova sinteza==== |
|||
{{Glavni|Barton–Zardova reakcija}} |
|||
Barton–Zardova sinteza odvija se na sličan način kao i Van Leusenova. Izocijanoacetat reagira sa nitroalkenom u adiciji 1,4, koju slijedi ciklizacija 5-''endo''-''dig'', eliminacija [[nitro grupa|nitro grupe]] i [[tautomer]]izacija.<ref>{{cite book | first=Jie Jack |last=Li | title =Heterocyclic Chemistry in Drug Discovery | publisher =Wiley | location =New York | year =2013 | isbn =9781118354421| url =https://books.google.com/books?id=p_fM6CuK6xcC}}</ref> |
|||
[[Datoteka:Barton-Zard reaction.png|center|400px]] |
|||
====Piloty–Robinsonovska sinteza pirola==== |
|||
Polazni materiali u Piloty–Robinsonovoj sintezi pirola, imenovanoj prema [[Gertrude Maud Robinson|Gertrudi]] i [[Robert Robinson|Robertu Robinsonu]] i [[Oskar Piloty|Oskaru Pilotyju]], su dva ekvivalenta [[aldehid]]a i [[hidrazin]]a.<ref>{{cite journal | author= Oskar Piloty|last=Piloty |first=Oskar | journal = Berichte der deutschen chemischen Gesellschaft | year = 1910 | volume = 43 | issue = 1 | pages = 489-498 | doi = 10.1002/cber.19100430182 | title = Synthese von Pyrrolderivaten: Pyrrole aus Succinylobernsteinsäureester, Pyrrole aus Azinen | trans_title = Synthesis of pyrrole derivatives: pyrrole from diethyl succinyl succinate, pyrrole from azines | url = https://babel.hathitrust.org/cgi/pt?id=uc1.b3481273;view=1up;seq=499 }} {{open access}}</ref><ref>{{cite journal | journal = [[J. Chem. Soc.]] | year = 1918 | volume = 113 | pages = 639| doi = 10.1039/CT9181300639 | title = LIV.—A new synthesis of tetraphenylpyrrole | last = Robinson|first= Gertrude Maud | last2 = Robinson | first2 = Robert}}</ref> Proizvod je pirol sa supstituentima na položajima 3 i 4. Aldehid reagira sa diaminom za međuproizvod di - [[imin]] (R-C=N-N=C-R). U drugom koraku, između njih odvija se [3,3] - [[sigmatropno preuređenje]]. Dodavanje [[sona kiselina|HCl]] dovodi do zatvaranja prstena i gubitka [[amonijak]]a, kada se formiraj pirol. [[Gertrude Maud Robinson # Piloty-Robinson Pyrrole Sinteza | mehanizam]] je razvili Robinsonovi. |
|||
U jednoj modifikaciji, [[propionaldehid]] se tretira prvo [[hidrazin]]om, a zatim [[benzoil-hlorid]]om, na visokim temperaturama i uz pomoć [[mikrotalasna hemija | mikrotalasnog zračenja]]:<ref name=milgram>{{cite journal | title = Microwave-Assisted Piloty–Robinson Synthesis of 3,4-Disubstituted Pyrroles |first1=Benjamin C.|last1= Milgram |first2=Katrine|last2= Eskildsen |first3=Steven M.|last3= Richter |first4=W. Robert |last4=Scheidt |first5=Karl A. |last5=Scheidt | journal = [[J. Org. Chem.]] | year = 2007 | volume = 72 | issue = 10 | pages = 3941–3944 | format = Note | doi = 10.1021/jo070389+| pmid = 17432915 | pmc = 1939979}}</ref> |
|||
[[Datoteka:Piloty-Robinson reaction.png|center|400px|Piloty–Robinsonova reakcija<ref name=milgram/>]] |
|||
====Putevi na bazi cikloadicije==== |
|||
Imajući više supstituenata, piroli se dobijaju iz reakcije [[münhnon]]a i [[alkin]]a. Mehanizam reakcija uključuje [[1,3-dipolna cikloadicija|1,3-dipolnu cikloadiciju]] praćenu gubitkom [[ugljen-dioksid]]a od retro-[[Diels-Alderov proces| Diels-Alderovog procesa]]. Slične reakcije mogu se izvršiti pomoću azalaktona. |
|||
[[Datoteka:DA Pyrrole Synthesis.jpg|center|350px|Sinteza pirola putem Diels–Alderove ciklizacije]] |
|||
Piroli se mogu pripremiti i putem ciklizacije katalizirane [[srebro]]m, od alkina sa [[izonitril]]ima, gdje je R<sup>2</sup> je grupa koja privlači elektron, a R<sup>1</sup> je alkan, aril grupa ili ester. Primjeri rasprostranjenih alkina mogu se vidjeti u formiranju željenih pirola u značajnim prinosima. Reakcija se nastavlja preko srebrenog [[acetilid]]nog međuproizvoda. Ovaj metod je analogan [[azid-alkin Huisgenova cikloadicija| azid-alkin]] [[klik-hemija|klik-hemiji]] koja se koristi za dobija azola. |
|||
[[Datoteka:Pyrrole Silver Cyclization.jpg|center|350px|Sinteza pirola preko klik-hemije srebra]] |
|||
====Ostali metodi==== |
|||
Ostali putevi sinteze pirola uključuju [[dekarboksilacija|dekarboksilaciju]] [[amonij-mukat]]a, koji je amonijačna so [[sluzna kiselina|sluzne kiseline]]. So se obično zagrijava [[destilacija|destilacijom]] za podešavanje [[glicerol]]a kao [[rastvarač]]a.<ref>{{cite book|title=Practical Organic Chemistry |last=Vogel |date=1956 |page=837 |url=http://www.sciencemadness.org/library/books/vogel_practical_ochem_3.pdf}}</ref> |
|||
[[Datoteka:Pyrrolesynthfromammoniummucate.svg|center|Sinteza pirola od amonij-mukata]] |
|||
===Biosinteza piriola=== |
|||
[[Datoteka:Porphobilinogen Synthesis.jpg|center|Mehanizmi biosinteze of porfobilinogena]] |
|||
Biosinteze pirolnih prstenova ''[[de novo]]'' počinje sa [[aminovevulinska kiselina| aminovevulinskom kiselinom]] (ALA), koja se sintetizira od [[glicin]]a i [[sukcinil-CoA]]. Kondenzaciju dva ALA molekula katalizira ALA dehidrataza preko [[Knorrova sinteza pirola| Knorrovog tipa]] sinteze prstena kada se formira [[porfobilinogen]] (PBG). Ovaj kasnije reagira za formiranje, naprimjer, makrocikličnih spojeva [[hem]]a i [[hlorofil]]a.<ref name="Bajrović">{{Cite book |author=Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Eds.|title=Uvod u genetičko inženjerstvo i biotehnologiju|publisher=Institut za genetičko inženjerstvo i biotehnologiju (INGEB) Sarajevo|year=2005|isbn= 9958-9344-1-8}}</ref><ref name="Međedović"/><ref>{{cite journal|last=Walsh|first=Christopher T.|last2=Garneau-Tsodikova |first2=Sylvie |last3=Howard-Jones |first3=Annaleise R. |title=Biological formation of pyrroles: Nature's logic and enzymatic machinery|journal=Natural Product Reports|volume=23|issue=4|pages=517|doi=10.1039/b605245m}}</ref> |
|||
==Također pogledajte== |
==Također pogledajte== |
||
Verzija na dan 25 decembar 2016 u 14:52
| Pirol | |
|---|---|
    | |
| Općenito | |
| Hemijski spoj | Pirol |
| Druga imena | Azol |
| Molekularna formula | C4H5N |
| CAS registarski broj | 109-97-7 |
| SMILES | N1C=CC=C1 c1cc[nH]c1 |
| InChI | 1/C4H5N/c1-2-4-5-3-1/h1-5H |
| Osobine1 | |
| Gustoća | 0.967 g cm−3 |
| Tačka topljenja | −23 |
| Tačka ključanja | 129 do 131 |
| Pritisak pare | 7 mmHg na 23 °C |
| Rizičnost | |
| NFPA 704 | |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Pirol (grč. πυρρός - pyrόs = crven kao vatra + [alkoh]ol) je heterociklični aromatski organski spoj, petočlani prsten sa formulom C4H4NH.[1] To je bezbojna nestabilna tečnost koja potamni nakon izlaganja zraku. Supstituirani derivati se nazivaju pirolima, kao što je npr. N-metilpirol, C4H4NCH3. Porfobilinogen, trosupstituirani pirol, biosintetski je prekursor mnogih prirodnih proizvoda kao što je hem.[2][3][4]
Piroli su komponente više složenih makrociklusa, uključujući porfirine hema, hlorine, bakteriohlorine, hlorofil i porfirinogene.[5]
Svojstva
Pirol je bezbojna hlapljiva tekućina koja lahko potamni nakon izlaganja zraku, a obično se neposredno prije upotrebe prečisti \destilacijom. [6] Pirol je 5-očlani aromatski heterociklus, poput furana i tiofena. Za razliku od njih, dipolan je, pri čemu je pozitivni kraj na strani heteroatoma, sa dipolnim momentom od 1,58 D. U CDCl3, ima hemijske pomake na 6,68 (H2, H5) i 6,22 (H3, H4). Pirol je slabo bazni, sa konjugatnom kiselinom pKa od −3.8. Većina termodinamično stabilnih pirolskik kationa (C4H6N+) formira se putem protonacije na poziciji 2. Substitucijs pirola alkilnim spojevima daje mnogo baznije molekule —naprimjer, tetrametilpirol ima konjugatnu kiselinu pKaod +3,7. Pirol je također i slabo kiseo na položaju N–H, sa pKa na 17,5.
Historija
Pirol je prvi otkrio F. F. Runge, 1834., kao sastavnu komponentu katrana.[7] In 1857, it was isolated from the pyrolysate of bone. Its name comes from the Greek pyrrhos (πυρρός, “fiery”), from the reaction used to detect it—the red color that it imparts to wood when moistened with hydrochloric acid.[8]
Prirodni izvori

Piroli se nalaze u različitim biološkim kontekstima, kao dijelovi kofaktora i prirodnih proizvoda. Općerašireni prirodni proizvodi molekula koje sadrže pirole uključuju vitamin B12, žučne pigmentge kao što su bilirubin i biliverdin i pofirine hema, hlorofia, hlorine, bakteriohlorine i porfirinogene.[5] Ostali sekundarni metaboliti koji sadrže pirole uključuju PQQ, makaluvamine M, rijanodin, razinilam, lamelarin, prodigiosin, mirmikarin i skeptrin. Piroli se također nalaze u nekoliko lijekova, uključujući atorvastatin, ketorolak i sunitinib. Jedna od prvih sintetskih molekula koje sadrže pirol bio je hemin, što je izveo Emil Fischer, 1929.[9]
Sinteze
Pirol se industrijski priprema obradom furana sa amonijakom, u prisustvu krutih kiselinskih katalizatora, kao što su SiO2 i Al2O3.[8]

Pirol se može dobiti katalitičkom dehidratacijom pirolidina.
Laboratorijski načini
Opisano je nekoliko puteva sinteze pirolskog prstena.[10]
Hantzschova sinteza pirola
Hantzschova sinteza pirola je reakcija β-ketoestera (1) sa amonijakom (ili primarnim aminima) i α-haloketonima (2) koja daje substituirane pirole (3).[11][12]

Knorrova sinteza pirola
Knorrova sinteza pirola uključuje reakciju α-amino ketona ili α-amino-β-ketoestera sa aktiviranim metilenskim spojem.[13][14][15] Ovaj metod uključuje reakciju α-amino ketona (1) i spoja koji sadrži metilensku grupu α za (vezan za slijedeći ugljik) karbonilnu grupu (2).[16]

Paal–Knorrova sinteza pirola
Paal–Knorrova sinteza pirola, počiva na reakciji 1,4-dikarbonilnog spoja sa amonijakom ili primarnim aminom, kada se dobija supstituirani pirol.[17][18]

Van Leusenova reakcija
Za dobijanje pirola može se upotrebiti i Van Leusenova reakcija, koja uključuje kontakt tozilmetil-izocijanida (TosMIC) sa enonom u prisustvu baze, u Michaelovoj adiciji. Tada 5-endo ciklizacija formira 5-očlani prsten, koji reagira eliminaciju the tozil grupe. Zadnji korak je tautomerizacija ka pirolu.

Barton–Zardova sinteza
Barton–Zardova sinteza odvija se na sličan način kao i Van Leusenova. Izocijanoacetat reagira sa nitroalkenom u adiciji 1,4, koju slijedi ciklizacija 5-endo-dig, eliminacija nitro grupe i tautomerizacija.[19]

Piloty–Robinsonovska sinteza pirola
Polazni materiali u Piloty–Robinsonovoj sintezi pirola, imenovanoj prema Gertrudi i Robertu Robinsonu i Oskaru Pilotyju, su dva ekvivalenta aldehida i hidrazina.[20][21] Proizvod je pirol sa supstituentima na položajima 3 i 4. Aldehid reagira sa diaminom za međuproizvod di - imin (R-C=N-N=C-R). U drugom koraku, između njih odvija se [3,3] - sigmatropno preuređenje. Dodavanje HCl dovodi do zatvaranja prstena i gubitka amonijaka, kada se formiraj pirol. mehanizam je razvili Robinsonovi. U jednoj modifikaciji, propionaldehid se tretira prvo hidrazinom, a zatim benzoil-hloridom, na visokim temperaturama i uz pomoć mikrotalasnog zračenja:[22]
![Piloty–Robinsonova reakcija[22]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/bd/Piloty-Robinson_reaction.png/400px-Piloty-Robinson_reaction.png)
Putevi na bazi cikloadicije
Imajući više supstituenata, piroli se dobijaju iz reakcije münhnona i alkina. Mehanizam reakcija uključuje 1,3-dipolnu cikloadiciju praćenu gubitkom ugljen-dioksida od retro- Diels-Alderovog procesa. Slične reakcije mogu se izvršiti pomoću azalaktona.

Piroli se mogu pripremiti i putem ciklizacije katalizirane srebrom, od alkina sa izonitrilima, gdje je R2 je grupa koja privlači elektron, a R1 je alkan, aril grupa ili ester. Primjeri rasprostranjenih alkina mogu se vidjeti u formiranju željenih pirola u značajnim prinosima. Reakcija se nastavlja preko srebrenog acetilidnog međuproizvoda. Ovaj metod je analogan azid-alkin klik-hemiji koja se koristi za dobija azola.

Ostali metodi
Ostali putevi sinteze pirola uključuju dekarboksilaciju amonij-mukata, koji je amonijačna so sluzne kiseline. So se obično zagrijava destilacijom za podešavanje glicerola kao rastvarača.[23]

Biosinteza piriola

Biosinteze pirolnih prstenova de novo počinje sa aminovevulinskom kiselinom (ALA), koja se sintetizira od glicina i sukcinil-CoA. Kondenzaciju dva ALA molekula katalizira ALA dehidrataza preko Knorrovog tipa sinteze prstena kada se formira porfobilinogen (PBG). Ovaj kasnije reagira za formiranje, naprimjer, makrocikličnih spojeva hema i hlorofila.[24][3][25]
Također pogledajte
Reference
- ^ Loudon, Marc G. (2002). "Chemistry of Naphthalene and the Aromatic Heterocycles". Organic Chemistry (4th izd.). New York: Oxford University Press. str. 1135–1136. ISBN 0-19-511999-1.
- ^ Guyton, A.C. & Hall, J.E. (2006) Textbook of Medical Physiology (11th ed.) Philadelphia: Elsevier Saunder ISBN 0-7216-0240-1
- ^ a b Međedović S., Maslić E., Hadžiselimović R. (2002). Biologija 2. Svjetlost, Sarajevo. ISBN 9958-10-222-6.CS1 održavanje: više imena: authors list (link)
- ^ Cox, Michael; Lehninger, Albert L.; Nelson, David R. (2000). Lehninger Principles of Biochemistry. New York: Worth Publishers. ISBN 1-57259-153-6.
- ^ a b Jusélius, Jonas; Sundholm, Dage (2000). "The aromatic pathways of porphins, chlorins and bacteriochlorins". Phys. Chem. Chem. Phys. 2 (10): 2145–2151. doi:10.1039/b000260g.

- ^ Armarego, Wilfred L. F.; Chai, Christina L. L. (2003). Purification of Laboratory Chemicals (5th izd.). Elsevier. str. 346.
- ^ Runge, F. F. (1834). "Ueber einige Produkte der Steinkohlendestillation" [On some products of coal distillation]. Annalen der Physik und Chemie. 31: 65–78.
 See especially pages 67–68, where Runge names the compound Pyrrol (fire oil) or Rothöl (red oil).
See especially pages 67–68, where Runge names the compound Pyrrol (fire oil) or Rothöl (red oil).
- ^ a b Harreus, Albrecht Ludwig (2005), "Pyrrole", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a22_453 CS1 održavanje: nepreporučeni parametar (link)
- ^ Emil, Fischer. "Nobel Prize Lecture".
- ^ Lubell, W.; Saint-Cyr, D.; Dufour-Gallant, J.; Hopewell, R.; Boutard, N.; Kassem, T.; Dörr, A.; Zelli, R. (2013). "1H-Pyrroles (Update 2013)". Science of Synthesis. 2013 (1): 157–388.
- ^ Hantzsch, A. (1890). "Neue Bildungsweise von Pyrrolderivaten". Berichte der deutschen chemischen Gesellschaft. 23: 1474–1476. doi:10.1002/cber.189002301243. Nepoznati parametar
|trans_title=zanemaren (prijedlog zamjene:|trans-title=) (pomoć)
- ^ Feist, Franz (1902). "Studien in der Furan- und Pyrrol-Gruppe". Berichte der deutschen chemischen Gesellschaft. 35: 1537–1544. doi:10.1002/cber.19020350263. Nepoznati parametar
|trans_title=zanemaren (prijedlog zamjene:|trans-title=) (pomoć)
- ^ Knorr, Ludwig (1884). "Synthese von Pyrrolderivaten". Berichte der deutschen chemischen Gesellschaft. 17 (2): 1635–1642. doi:10.1002/cber.18840170220. Nepoznati parametar
|trans_title=zanemaren (prijedlog zamjene:|trans-title=) (pomoć)
- ^ Knorr, L. (1886). "Synthetische Versuche mit dem Acetessigester". Annalen der Chemie. 236: 290–332. doi:10.1002/jlac.18862360303. Nepoznati parametar
|trans_title=zanemaren (prijedlog zamjene:|trans-title=) (pomoć)
- ^ Knorr, L.; Lange, H. (1902). "Ueber die Bildung von Pyrrolderivaten aus Isonitrosoketonen". Berichte der deutschen chemischen Gesellschaft. 35 (3): 2998–3008. doi:10.1002/cber.19020350392. Nepoznati parametar
|trans_title=zanemaren (prijedlog zamjene:|trans-title=) (pomoć)
- ^ Corwin, Alsoph Henry (1950). "Chapter 6: The Chemistry of Pyrrole and its Derivatives". u Elderfield, Robert Cooley (ured.). Heterocyclic Compounds. 1. New York, NY: Wiley. str. 287.
- ^ Paal, C. (1884), "Ueber die Derivate des Acetophenonacetessigesters und des Acetonylacetessigesters", Berichte der deutschen chemischen Gesellschaft, 17: 2756–2767, doi:10.1002/cber.188401702228

- ^ Knorr, Ludwig (1884), "Synthese von Furfuranderivaten aus dem Diacetbernsteinsäureester", Berichte der deutschen chemischen Gesellschaft, 17: 2863–2870, doi:10.1002/cber.188401702254 Nepoznati parametar
|trans_title=zanemaren (prijedlog zamjene:|trans-title=) (pomoć)
- ^ Li, Jie Jack (2013). Heterocyclic Chemistry in Drug Discovery. New York: Wiley. ISBN 9781118354421.
- ^ Piloty, Oskar (1910). "Synthese von Pyrrolderivaten: Pyrrole aus Succinylobernsteinsäureester, Pyrrole aus Azinen". Berichte der deutschen chemischen Gesellschaft. 43 (1): 489–498. doi:10.1002/cber.19100430182. Nepoznati parametar
|trans_title=zanemaren (prijedlog zamjene:|trans-title=) (pomoć); Navedeno je više parametara|author=i|last=(pomoć)
- ^ Robinson, Gertrude Maud; Robinson, Robert (1918). "LIV.—A new synthesis of tetraphenylpyrrole". J. Chem. Soc. 113: 639. doi:10.1039/CT9181300639.
- ^ a b Milgram, Benjamin C.; Eskildsen, Katrine; Richter, Steven M.; Scheidt, W. Robert; Scheidt, Karl A. (2007). "Microwave-Assisted Piloty–Robinson Synthesis of 3,4-Disubstituted Pyrroles" (Note). J. Org. Chem. 72 (10): 3941–3944. doi:10.1021/jo070389+. PMC 1939979. PMID 17432915.
- ^ Vogel (1956). Practical Organic Chemistry (PDF). str. 837.
- ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Eds. (2005). Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB) Sarajevo. ISBN 9958-9344-1-8.CS1 održavanje: više imena: authors list (link)
- ^ Walsh, Christopher T.; Garneau-Tsodikova, Sylvie; Howard-Jones, Annaleise R. "Biological formation of pyrroles: Nature's logic and enzymatic machinery". Natural Product Reports. 23 (4): 517. doi:10.1039/b605245m.
Dopunska literatura
- Jones, R. Jones, ured. (1990). Pyrroles. Part I. The Synthesis and the Physical and Chemical Aspects of the Pyrrole Ring. The Chemistry of Heterocyclic Compounds. 48. Chichester: John Wiley & Sons. doi:10.1002/recl.19911100712. ISBN 0-471-62753-4.
- Jolicoeur, Benoit; Chapman, Erin E.; Thompson, Alison; Lubell, William D. (2006). "Pyrrole protection". Tetrahedron. 62 (50): 11531–11563. doi:10.1016/j.tet.2006.08.071.
Vanjski linkovi
| Commons ima datoteke na temu: Pirol |