Razlika između verzija stranice "Silicij-dioksid"
| [nepregledana izmjena] | [nepregledana izmjena] |
m Vraćena izmjena 808767 korisnika 88.207.97.5 (razgovor) |
m Bot: Automatska zamjena teksta (-Slika: +Datoteka:) |
||
| Red 1: | Red 1: | ||
{{Hemijski spoj |
{{Hemijski spoj |
||
| Strukturna formula = [[ |
| Strukturna formula = [[Datoteka:Towering_Sand_Dunes.jpg|200px]] |
||
| Hemijski spoj = Silicijum dioksid |
| Hemijski spoj = Silicijum dioksid |
||
| Druga imena = Silicijum (IV) oksid, kvarc, kremen |
| Druga imena = Silicijum (IV) oksid, kvarc, kremen |
||
| Red 33: | Red 33: | ||
==Upotreba== |
==Upotreba== |
||
[[ |
[[Datoteka:silikon.png|thumb|Struktura silikona|left]] |
||
Silicijum dioksid je jedna od osnovnih komponenata u proizvodnji [[staklo|stakla]]. Važnu grupu minerala čine [[silikatni minerali]]. Zamjenom OH-grupa u silikatnoj kiselini organskim radikalima, moguće je kontrolisati reakciju kondenzacije, pri čemu nastaju polimerni spojevi strukture slične [[ketoni]]ma R<sub>2</sub>C=O, pa se nazivaju silikoketoni ili '''[[silikoni]]'''. |
Silicijum dioksid je jedna od osnovnih komponenata u proizvodnji [[staklo|stakla]]. Važnu grupu minerala čine [[silikatni minerali]]. Zamjenom OH-grupa u silikatnoj kiselini organskim radikalima, moguće je kontrolisati reakciju kondenzacije, pri čemu nastaju polimerni spojevi strukture slične [[ketoni]]ma R<sub>2</sub>C=O, pa se nazivaju silikoketoni ili '''[[silikoni]]'''. |
||
Verzija na dan 6 januar 2009 u 12:19
Šablon:Hemijski spoj Silicijum dioksid (SiO2) se javlja u tri alotropske modifikacije: kvarc, tridimit i kristobalit. Svaki od ova tri oblika postoji još u dvije modifikacije (α i β)
Hemijske osobine
Silicijum dioksid je prilično inertan. Ne reaguje sa kiselinama, osim sa fluorovodoničnom kiselinom (HF). Taljenjem sa alkalnim hidroksidima prelazi u rastvorljive silikate:
- SiO2 + 2 NaOH → Na2SiO3 + H2O
Kiselina koja odgovara silicijum dioksidu naziva se ortosilikatna kiselina, ali se ne može dobiti kao kod oksida nemetala rastvaranjem u vodi, jer je silicijum oksid netopiv. Najlakši način je hidroliza silicijum tetrahlorida:
- SiCl4 + 4 H2O → H2SiO4 + 4 H+ + 4 Cl-
Ova kiselina u monomolekularnom obliku postoji pri pH oko 3,2. Pri nižim ili višim vrijednostima počinje polimerizirati.
Soli silikatnih kiselina se nazivaju silikati. Samo alkalni silikati se rastvaraju u vodi. Polimerizirana silikatna kiselina prelazi u gel, čijim sušenjem nastaje silikagel.
Upotreba
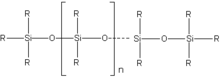
Silicijum dioksid je jedna od osnovnih komponenata u proizvodnji stakla. Važnu grupu minerala čine silikatni minerali. Zamjenom OH-grupa u silikatnoj kiselini organskim radikalima, moguće je kontrolisati reakciju kondenzacije, pri čemu nastaju polimerni spojevi strukture slične ketonima R2C=O, pa se nazivaju silikoketoni ili silikoni.
