Primarna struktura proteina

Primarna struktura ptoteina je linearna sekvenca aminokiselina u peptidu ili proteinu.[1] Prema konvenciji, primarna struktura proteina opisuje se počevši od kraja amino – N-kraja do kraja karboksil – C-kraja. Biosinteza proteina najčešće se odvija u ćelijskim ribosomima. Peptidi mogu biti sintetizirani u laboratoriji. Primarne strukture proteina mogu biti direktno sekvencirane ili izvedene iz sekvenci DNK
Formiranje[uredi | uredi izvor]
Biosinteza[uredi | uredi izvor]
Aminokiseline se polimeriziraju putem peptidnih veza kako bi tvorile dugu kičmu, a različiti bočni lanci aminokiselina strše duž nje. U biološkim sistemima, proteini se proizvode tokom translacije pomoću ćelijskih ribosoma. Neki organizmi mogu napraviti i kratke peptide putem neribosomne peptidne sinteze, koji često koriste i aminokiseline osim standardnih 20 i mogu se ciklizirati, modificirati i umrežiti.
Laboratorijska sinteza[uredi | uredi izvor]
Peptidi se mogu hemijski sintetizirati pomoću niza laboratorijskih metoda. Hemijski metodi obično sintetiziraju peptide suprotnim redoslijedom (počevši od C-kraja) od biološke sinteze proteina (počevši od N-kraja).
Označavanje[uredi | uredi izvor]
Proteinska sekvenca se obično označava nizom slova, nabrajajući aminokiseline koje počinju na amino –karboksilnom kraju. Kôd od tri slova ili kôd s jednim slovom mogu se koristiti za predstavljanje 20 aminokiselina koje se javljaju u prirodi, kao i smjese ili dvosmislene aminokiseline (slično označavanju nukleinskih kiselina).[1][2][3]
Peptidi mogu biti direktno sekvencirani ili izvedeni iz sekvenci DNK. Sada postoje velike baze podataka o sekvencama koje porede poznate proteinske sekvence.
| Aminokiselina | 3. Slovo[4] | 1. Slovo [4] |
|---|---|---|
| Alanin | Ala | A |
| Arginin | Arg | R |
| Asparagin | Asn | N |
| Aspaginska kiselina | Asp | D |
| Cistein | Cys | C |
| Glutaminska kiselina | Glu | E |
| Glutamin | Gln | Q |
| Glicin | Gly | G |
| Histidin | His | H |
| Izoleucin | Ile | I |
| Leucin | Leu | L |
| Lizin | Lys | K |
| Metionin | Met | M |
| Fenilalanin | Phe | F |
| Prolin | Pro | P |
| Serin | Ser | S |
| Treonin | Thr | T |
| Triptofan | Trp | W |
| Tirozin | Tyr | Y |
| Valin | Val | V |
| Simbol | Opis | Reprezentativni ostaci |
|---|---|---|
| X | Bilo koja ili nepoznata aminokiselina | Sve |
| B | Aspartat ili asparagin | D, N |
| Z | Glutamat ili glutamin | E, Q |
| J | Leucin ili izoleucin | I, L |
| Φ | Hidrofobne | V, I, L, F, W, M |
| Ω | Aromatske | F, W, Y, H |
| Ψ | Alifatske | V, I, L, M |
| π | Male | P, G, A, S |
| ζ | Hidrofilne | S, T, H, N, Q, E, D, K, R, Y |
| + | Pozitivno nabijene | K, R, H |
| - | Negativno nabijene | D, E |
Modifikacija[uredi | uredi izvor]
Općenito, polipeptidi su nerazgranati polimeri, pa se njihova primarna struktura često može odrediti redoslijedom aminokiselina duž njihove kičme. Međutim, proteini mogu postati umreženi, najčešće disulfidnim vezama, a za primarnu strukturu je također potrebno navesti umrežavajuće atome, npr. navesti cisteine koji su uključeni u disulfidne veze proteina. Ostale umrežene veze uključuju dezmozin.
Izomerizacija[uredi | uredi izvor]
Hiralni centri polipeptidnog lanca mogu proći racemizaciju. Iako ne mijenja redoslijed, ona ipak utiče na hemijska svojstva sekvence. Konkretno, L – amino kiseline koje se obično nalaze u proteinima mogu se spontano izomerizirati na atom i formirati D–aminokiseline, koji ne razlaže većina proteaza. Pored toga, prolin može, na peptidnoj vezi, formirati stabilne trans izomere.
Posttranslacijska modifikacija[uredi | uredi izvor]
Konačno, protein može proći kroz različite posttranslacijske modifikacije koji su ovdje ukratko sažete. Amino grupa polipeptidnog N-kraja može se modificirati kovalentno, naprimjer,
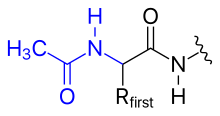
- Pozositivni naboj amino grupe N-kraja može se eliminirati promjenom u acetilnu skupinu (blokiranje N-kraja)
- Formiliranje
- Metionin N-kraja koji se obično nalazi nakon translacije ima N-kraj blokiran formilnom grupom. Ovu formilnu grupu (a ponekad i sam metioninski ostatak, ako je prati Gly ili Ser) uklanja enzim deformilaza.
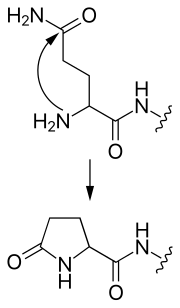
- Glutamin N-kraja može napasti sebe, formirajući cikličku piroglutamatnu grupu.
- Miristoilacija
- Slična je i s acetilacijom. Umjesto jednostavne metilne grupe, mistoilnska grupa ima rep od 14 hidrofobnih ugljika, što ga čini idealnim za vezanje proteina u ćelijske membrane.
Karboksilatna grupa polipeptidnog C-kraja također se može modificirati, npr.
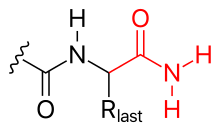
- Aminacija (vidi sliku)
- C-kraj može biti također blokiran minacijom (čime neutralizira svoj negativni naboj).
- Dodatak glikozil fosfatidilinozitola (GPI)
- Glikozil fosfatidilinozitol (GPI) je velika hidrofobna fosfolipidna protetska grupa koja proteinira proteine u ćelijskim membranama. Pričvršćen je na polipeptidni C-kraj preko amidne veze koja se zatim spaja na etanolamin, odatle na različite šećere i na kraju na lipidni dio fosfatidilinozitola.
Konačno, peptidni bočni lanac se takođe može kovalentno modifikovati, npr.
- Pored cijepanja, fosforilacija je možda najvažnija hemijska modifikacija proteina. Fosfatna grupa može se povezati sa bočnom lančanom hidroksilnom grupom ostataka serina, treonina i tirozina, dodajući na tom mjestu negativan naboj i stvarajući neprirodnu aminokiselinu. Takve reakcije kataliziraju kinaze, a reverznu reakciju kataliziraju fosfataze. Fosforilirani tirozini često se koriste kao "ručke" pomoću kojih se proteini mogu vezati jedni s drugima, dok fosforilacija Ser / Thr često izaziva konformacijske promjene, vjerovatno zbog unesenog negativnog naboja. Efekti fosforilacije Ser / Thr ponekad se mogu simulirati mutiranjem Ser / Thr ostatka u glutamat.
- Ovo je sveobuhvatni naziv za skup vrlo uobičajenih i vrlo heterogenih kemijskih modifikacija. Dijelovi šećera mogu se povezati sa hidroksilnim grupama bočnih lanaca Ser / Thr ili sa amidnim grupama bočnih lanaca Asn. Takvi dodaci mogu služiti mnogim funkcijama, u rasponu od povećanja topivosti do složenog prepoznavanja. Sva glikozilacija može se blokirati određenim inhibitorima, kao što je tunikamicin.
- Deamidacija (tvorba sukcinimida)
- U ovoj modifikaciji, bočni lanac asparagina ili aspartata napada slijedeću peptidnu vezu, tvoreći simetričan sukcinimidni intermedijar. Hidrolizom intermedijara nastaje ili aspartat ili β-aminokiselina, izo (Asp). Što se tiče asparagina, bilo koji proizvod rezultira gubitkom amidne gruoa, dakle "deamidizacijom".
- Ostaci prolina mogu biti hidroksilirani na bilo kojem od dva atoma, kao i lizin (na jednom atomu). Hidroksiprolin je kritična komponenta kolagena, koja nakon gubitka postaje nestabilna. Reakciju hidroksilacije katalizira enzim koji zahtijeva askorbinsku kiselinu (vitamin C), čiji nedostatak dovodi do mnogih bolesti vezivnog tkiva, poput skorbuta.
- Nekoliko ostataka proteina može se metilirati, od kojih su najpozitivnije pozitivne grupe lizina i arginina. Ostaci arginina u interakciji su s fosfatnom jezgrom nukleinske kiseline obično formiraju vodikove veze s baznim ostacima, posebno guanina, u kompleksima protein-DNK. Ostaci lizina mogu se metilirati pojedinačno, dvostruko, pa čak i trostruko. Metilacija, međutim, ne mijenja pozitivni naboj bočnog lanca.
- Acetilacija amino-grupa lizina hemijski je analogna acetilaciji N-kraja. U funkcionalnom smislu, acetilacija ostataka lizina koristi se za regulaciju vezanja proteina na nukleinske kiseline. Otkazivanje pozitivnog naboja u lizinu slabi elektrostatsku privlačnost za (negativno nabijene) nukleinske kiseline.
- Tirozini mogu postati sulfatirani na svom atomu . Pomalo neobično, ta se modifikacija događa u Golgijevom aparatu, a ne u endoplazmatskom retikulumu. Slično kao fosforilirani tirozini, sulfatirani tirozini se koriste za specifično prepoznavanje, npr., u hemokinskim receptorima na ćelijskoj površini. Kao i u slučaju fosforilacije, sulfacija dodaje negativan naboj prethodno neutralnom mjestu.
- Preanilacija i palmitoilacija
- Hidrofobni izopren (npr. farnezil, geranil i geranilgeranilne grupe) i palmitoil grupe mogu se dodati atomu cisteinskih ostataka da se vežu proteini u ćelijske membrane . Za razliku od GPI i miritoilnog sidra, ove grupe se ne dodaju nužno na krajevina.
- Ovo je relativno rijetka modifikacija koja veže dodatnu karboksilatnu grupu (a time i dvostruko negativan naboj) u bočni lanac glutamata, stvarajući Gla ostatke. Ovo se koristi za jačanje vezanja na ione "tvrdih metala" kao što je kalcij.
- Velika grupa ADP-ribozila može se prenijeti u nekoliko tipova bočnih lanaca unutar proteina, sa heterogenim efektima. Ova modifikacija je cilj za snažne toksine različitih bakterija, npr. "Vibrio cholerae", "Corynebacterium diphtheriae" i Bordetella pertussis.
- Različiti presavijeni proteini cijele dužine mogu se vezati na njihovim C-krajevima na bočne lance amonijumskih skupina lizina drugih proteina. Ubikvitin je najčešći od ovih, a obično signalizira da bjelančevine s ubikvitinom treba razgraditi.
Većina gore pomenutih polipeptidnih modifikacija događa se posttranslacijski, tj. nakon što je protein sintetiziran na ribosomu, što se obično događa u endoplazmatskom retikulumu, subćelijskoj [ [organela|organeli]] eukariotske ćelije. Mnoge druge hemijske reakcije (npr. cijaniranje) hemičari su primijenili na proteine, iako se ne nalaze u biološkim sistemima.
Razgradnja i vezanje[uredi | uredi izvor]
Pored gore navedenih, najvažnija modifikacija primarne strukture je cijepanje peptida (hemijskom hidrolizom ili proteazama) . Proteini se često sintetiziraju u neaktivnom obliku prekursora; obično, N- ili C-krajnji segment blokira aktivno mesto proteina, inhibirajući njegovu funkciju. Protein se aktivira cijepanjem inhibicijskog peptida.
Neki proteini čak imaju moć da razlažu. Hidroksilna grupa serina (rijetko, treonina) ili tiolna grupa cisteinskog ostatka napada karbonilni ugljik prethodne peptidne veze, formirajući tetraedarski vezani intermedijar, klasificiran kao hidroksioksazolidin (Ser / Thr) ili hidrokstiazolidin ( Cys) intermedijar. Ovaj intermedijar ima tendenciju vraćanja u amidni oblik, izbacujući napadnu grupu, pošto je amidni oblik najčešće pogodan sa slobodnom energijom (vjerojatno zbog jake rezonantne stabilizacije peptidne grupe). Međutim, dodatne molekularne interakcije mogu učiniti amidni oblik manje stabilnim; Umjesto toga, amino grupa se izbacuje, što rezultira vezom estera (Ser / Thr) ili tioestra (Cys) umjesto peptidne veze. Ta se hemijska reakcija naziva N-O acil pomicanje).
Veza ester / tioester se može riješiti na više načina:
- Jednostavna hidroliza podijelit će polipeptidni lanac, gdje premještena amino grupa postaje novi N-kraj. To se vidi pri sazrevanju glikosilasparaginaze.
- Reakcija β-eliminacije također raspodjeljuje lanac, ali rezultira stvaranjem piruvoilne grupe na novom N-kraju. Ova grupa može se koristiti kao kovalentno vezani katalitski kofaktor u nekim enzimima, posebno dekarboksilazi poput S-adenozilmetionin-dekarboksilaze (SAMDC) koja iskorištava moć povlačenja elektrona piruvoilne skupine.
- Intramolekularna transesterifikacija, što rezultira razgranatim polipeptidom. U inteinima, nova esterska veza prekida se intramolekularnim napadom asparagina koji će uskoro biti C-kraj.
- Intermolekularna transesterifikacija može prenijeti čitav segment s jednog polipeptida na drugi, kao što je vidljivo u autoprocesiranju ježnih proteina.
Primarna struktura u ostalim molekulama[uredi | uredi izvor]
Za svaki heteropolimer linearnog lanca može se reći da ima "primarnu strukturu", analogno upotrebi termina za proteine, ali ta je upotreba rijetka u usporedbi s izuzetno uobičajenom uporabom u odnosu na proteine. U RNK, koja također ima opsežnu sekundarnu strukturu, linearni lanac baza općenito se naziva "sekvenca" kao što je to u DNK (koju obično tvori linearnu dvostruku spiralu s malo sekundarne strukture). Za druge biološke polimere poput polisaharida također se može smatrati da imaju primarnu strukturu, iako upotreba nije standardna.
Odnos prema sekundarnoj i tercijarnoj strukturi[uredi | uredi izvor]
Primarna struktura biološkog polimera u velikoj mjeri određuje njegov trodimenzijski oblik (tercijarna struktura). Proteinska sekvenca može se koristiti za predviđanje lokalnih karakteristika, poput segmenata sekundarne strukture ili transmembranskih područja. Međutim, složenost savijanja proteina zasad onemogućava predviđanje tercijarne strukture proteina samo iz njihove sekvence. Poznavanje strukture slične homologne sekvence (naprimjer člana iste porosice proteina) omogućava visoko precizno predviđanje tercijarne strukture prema modelima homologije. Ako je dostupan cjelovia sekvenca proteina, moguće je procijeniti njegova opća biofizička svojstva, kao što je njegova izoelektrična tačka.
Porodice sekvenci često se određuju grupiranjem sekvenci, a projekti strukturne genomike imaju za cilj stvoriti skup reprezentativnih struktura koje bi pokrile prostor mogućih, ne suvišnih sekvenci.
Također pogledajte[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ a b SANGER F (1952). The arrangement of amino acids in proteins. Adv. Protein Chem. Advances in Protein Chemistry. 7. str. 1–67. doi:10.1016/S0065-3233(08)60017-0. ISBN 9780120342075. PMID 14933251.
- ^ Aasland, Rein; Abrams, Charles; Ampe, Christophe; Ball, Linda J.; Bedford, Mark T.; Cesareni, Gianni; Gimona, Mario; Hurley, James H.; Jarchau, Thomas (20. 2. 2002). "Normalization of nomenclature for peptide motifs as ligands of modular protein domains". FEBS Letters. 513 (1): 141–144. doi:10.1016/S0014-5793(01)03295-1. ISSN 1873-3468.
- ^ Aasland R, Abrams C, Ampe C, Ball LJ, Bedford MT, Cesareni G, Gimona M, Hurley JH, Jarchau T, Lehto VP, Lemmon MA, Linding R, Mayer BJ, Nagai M, Sudol M, Walter U, Winder SJ (1. 7. 1968). "A One-Letter Notation for Amino Acid Sequences*". European Journal of Biochemistry. 5 (2): 151–153. doi:10.1111/j.1432-1033.1968.tb00350.x. ISSN 1432-1033. PMID 11911894.
- ^ a b Hausman, Robert E.; Cooper, Geoffrey M. (2004). The cell: a molecular approach. Washington, D.C: ASM Press. str. 51. ISBN 978-0-87893-214-6.







