Protein-kinaza

Protein-kinaza je kinaza koja selektivno modificira druge proteine dodavajući im kovalentno fosfate (fosforilacija), za razliku od kinaza koje modificiraju lipide, ugljikohidrate ili druge molekule. Fosforilacija obično rezultira funkcionalnom promjenom ciljnog proteina (supstrata), promjenom ]]enzimske aktivnosti, ćelijske lokacije ili povezanosti s drugim proteinima. Ljudski genom sadrži oko 500 gena za protein-kinaze, koji čine oko 2% svih ljudskih gena.[1] Postoje dva glavna tipa protein kinaze. Velika većina su serin/treonin kinaze, koje fosforiliraju hidroksilne grupe serina i treonina u svojim metama, a većina ostalih su tirozin kinaze, iako postoje dodatni tipovi.[2] Protein-kinaze se također nalaze u bakterijama i biljkama. Do 30% svih ljudskih proteina može biti modificirano aktivnošću kinaze, a poznato je da kinaze reguliraju većinu ćelijskih puteva, posebno onih koji su uključeni u transdukciju signala.
Hemijska aktivnost[uredi | uredi izvor]
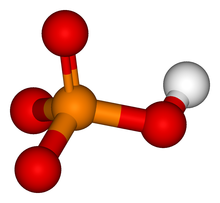
Hemijska aktivnost kinaze uključuje uklanjanje fosfatne grupe iz ATP i njeno kovalentno vezivanje za jednu od tri aminokiseline koje imaju slobodnu hidroksilnu grupu. Većina kinaza djeluje i na serin i treonin, druge djeluju na tirozin, a određeni broj (kinaza dvostruke specifičnosti djeluje na sva tri.[3] Postoje i proteinske kinaze koje fosforiliraju druge aminokiseline, uključujući histidin-kinaze koje fosforiliraju ostatke histidina.[4]
Struktura[uredi | uredi izvor]
Eukariotske protein kinaze su enzimi koji pripadaju vrlo opsežnoj porodici proteina koji dijele konzervirano katalitsko jezgro.[5][6][7][8] Određene su strukture preko 270 ljudskih protein-kinaza.[9]
Postoji niz konzerviranih regija u katalitskom domenu protein-kinaza. U N-terminalnom produžrtku katalitskog domena nalazi se glicinom bogati dio ostataka u blizini lizinske aminokiseline, za koju se pokazalo da je uključena u vezivanje ATP-a . U središnjem dijelu katalitskog domena nalazi se konzervirana asparaginska kiselina, koja je važna za katalitsku aktivnost enzima.[10]
Serin/treonin-specifične protein kinaze[uredi | uredi izvor]
Serin/treonin protein kinaze (EC 2.7.11.1) fosforiliziraju OH grupu serina ili treonina (koji imaju slične bočne lance). Aktivnost ovih protein-kinaza može se regulisati specifičnim događajima (npr. oštećenjem DNK), kao i brojnim hemijskim signalima, uključujući cAMP/cGMP, diacilglicerol, i Ca2+/kalmodulin. Jedna veoma važna grupa protein-kinaza su MAP-kinaze (akronim od: "mitogen-aktivirane protein-kinaze"). Važne podgrupe su kinaze potporodice ERK, koje se tipski aktiviraju mitogenim signalima i stresom aktivirane proteinske kinaze JNK i p38. Dok su MAP-kinaze specifične za serin/treonin, ove se aktiviraju kombinovanom fosforilacijom na ostacima serina/treonina i tirozina. Aktivnost MAP-kinaza ograničena je brojnim proteinskim fosfatazama, koje uklanjaju fosfatne grupe koje su dodane specifičnim serinskim ili treoninskim ostacima kinaze i koje su potrebne za održavanje kinaze u aktivnoj konformaciji.
Tirozin-specifične protein kinaze[uredi | uredi izvor]
Tirozin-specifične protein kinaze ([[EC broj|EC 2.7.10.1}} i EC 2.7.10.2) fosforiliraju aminokiselinske ostatke tirozina i, poput serin/treonin-specifičnih kinaza, koriste se u tranansdukciji signala. Oni prvenstveno djeluju kao receptori faktora rasta i u nizvodnoj signalizaciji faktora rasta.[11] Neki primjeri uključuju:
- trombocitni receptor faktora rasta (PDGFR)
- receptor epidermnog faktora rasta (EGFR)[12]
- Insulinski receptor i insulinoliki receptor faktora rasta 1 (IGF1R)
- Receptor faktora matičnih ćelija (SCF) (također zvani c-kit).
Receptor tirozin-kinaza[uredi | uredi izvor]
Ove kinaze sastoje se od vanćelijskih domena, transmembrane koja se proteže alfa-heliksom i unutarćelijskog tirozin-kinaznog domena koji strši u [citoplazma|[citoplazmu]]. Imaju važnu ulogu u regulaciji ćelijske diobe, ćelijske diferencijacije i morfogeneze. Kod sisara je poznato više od 50 receptorskih tirozin-kinaza.
Struktura[uredi | uredi izvor]
Vanćelijskii domeni služe kao ligand-vezujući dio molekula, često indukujući domene da formiraju homo– ili heterodimere. Transmembranski element je jedan α-heliks. Unutarćelijski ili citoplazmatski domen protein-kinaza je odgovoran za (visoko konzerviranu) aktivnost kinaze, kao i nekoliko regulatornih funkcija.
Regulacija[uredi | uredi izvor]
Vezivanje liganda uzrokuje dvije reakcije:
- Dimerizacija dve monomerne receptorske kinaze ili stabilizacija labavog dimera. Mnogi ligandi receptorskih tirozin-kinaza su multivalentni. Neke tirozin-receptorske kinaze (npr. receptor trombocitni faktor rasta) mogu formirati heterodimere sa drugim sličnim, ali ne identičnim kinazama iste potporodice, omogućavajući vrlo raznolik odgovor na vanćelijski signal.
- Trans-autofosforilacija (fosforilacija putem od druge kinaze u dimeru) kinaze.
Autofosforilacija stabilizuje aktivnu konformaciju kinaznog domena. Kada je nekoliko aminokiselina pogodnih za fosforilaciju prisutno u domeni kinaze (npr. insulinoliki receptor faktora rasta), aktivnost kinaze se može povećati s brojem fosforiliranih aminokiselina; u ovom slučaju, prva fosforilacija prebacuje kinazu iz "isključene" u "standbaj" položaj (na čekanju).
Transdukcija signala[uredi | uredi izvor]
Aktivna tirozin-kinaza fosforilira specifične ciljne proteine, koji su često i sami enzimi. Važna meta je ras proteinski lanac transdukcije signala.
Tirozin kinaze povezane sa receptorom[uredi | uredi izvor]
Tirozin-kinaze regrutovane na receptor, nakon vezivanja hormona, su tirozin kinaze povezane s receptorom i uključene su u brojne signalne kaskade, posebno one koje su uključene u citokinsku signalizaciju (ali i druge, uključujući hormon rasta). Jedna takva tirozin kinaza povezana sa receptorom je Janus kinaza (JAK), čiji su mnogi efekti posredovani STAT proteinima. (Pogledajte JAK-STAT put.)
Histidin-specifične protein kinaze[uredi | uredi izvor]
Histidin-kinaze se strukturno razlikuju od većine drugih protein kinaza i nalaze se uglavnom u prokariota kao dio dvokomponentnih mehanizama za transdukciju signala. Fosfatna grupa iz ATP-a se prvo dodaje ostatku histidina unutar kinaze, a kasnije se prenosi na aspartat ostatak na 'domenu primaoca' na drugom proteinu, ili ponekad na samoj kinazi. Ostatak aspartil fosfata je tada aktivan u signaliziranju.
Histidin kinaze se široko nalaze u prokariotima, kao iu biljkama, gljivama i eukariotima. Familija kinaza piruvat dehidrogenaza kod životinja je strukturno povezana sa histidin kinazama, ali umjesto toga fosforilira serinske ostatke i vjerovatno ne koristi fosfo-histidin intermedijer.
Proteinske kinaze specifične za asparaginsku/glutaminsku kiselinu[uredi | uredi izvor]
Mješovite kinaze[uredi | uredi izvor]
Neke kinaze imaju mješovitu aktivnost kinaze. Naprimjer, mitogen-aktivirana protein-kinaza (MAPKK), koja je uključena u kaskadu MAP kinaza, mješovita je serin/treonin i tirozin-kinaza i stoga je dvostruko-specifična kinaza.
Inhibitori[uredi | uredi izvor]
Deregulirana aktivnost kinaze je čest uzrok bolesti, posebno raka, pri čemu kinaze reguliraju mnoge aspekte koji kontroliraju rast, kretanje i smrt ćelija. Razvijaju se lijekovi koji inhibiraju specifične kinaze, za liječenje nekoliko bolesti, a neki su već u kliničkoj upotrebi, uključujući Gleevec-ove (imatinib) i Iressa (gefitinib).
Testovi i profiliranje kinaza[uredi | uredi izvor]
Razvoj lijekova za inhibitore kinaze počinje od testova kinaze Arhivirano 26. 11. 2014. na Wayback Machine, a olovni spojevi se obično profiliraju za specifičnost prije nego što se pređu u daljnja ispitivanja. Dostupne su mnoge usluge profilisanja, od fluorescentnih testova do radioisotopskie zasnovanih detekcija i competition binding assays.
Reference[uredi | uredi izvor]
- ^ Manning G, Whyte DB, Martinez R, Hunter T, Sudarsanam S (2002). "The protein kinase complement of the human genome". Science. 298 (5600): 1912–1934. Bibcode:2002Sci...298.1912M. doi:10.1126/science.1075762. PMID 12471243. S2CID 26554314.
- ^ Alberts, Bruce (18. 11. 2014). Molecular biology of the cell (Sixth izd.). New York. str. 819–820. ISBN 978-0-8153-4432-2. OCLC 887605755.
- ^ Dhanasekaran N, Premkumar Reddy E (septembar 1998). "Signaling by dual specificity kinases". Oncogene. 17 (11 Reviews): 1447–55. doi:10.1038/sj.onc.1202251. PMID 9779990.
- ^ Besant PG, Tan E, Attwood PV (mart 2003). "Mammalian protein histidine kinases". Int. J. Biochem. Cell Biol. 35 (3): 297–309. doi:10.1016/S1357-2725(02)00257-1. PMID 12531242.
- ^ Hanks SK (2003). "Genomic analysis of the eukaryotic protein kinase superfamily: a perspective". Genome Biol. 4 (5): 111. doi:10.1186/gb-2003-4-5-111. PMC 156577. PMID 12734000.
- ^ Hanks SK, Hunter T (maj 1995). "Protein kinases 6. The eukaryotic protein kinase superfamily: kinase (catalytic) domain structure and classification". FASEB J. 9 (8): 576–96. doi:10.1096/fasebj.9.8.7768349. PMID 7768349. S2CID 21377422.
- ^ Hunter T (1991). "Protein kinase classification". Meth. Enzymol. Methods in Enzymology. 200: 3–37. doi:10.1016/0076-6879(91)00125-G. ISBN 9780121821012. PMID 1835513.
- ^ Hanks SK, Quinn AM (1991). "Protein kinase catalytic domain sequence database: identification of conserved features of primary structure and classification of family members". Meth. Enzymol. Methods in Enzymology. 200: 38–62. doi:10.1016/0076-6879(91)00126-H. ISBN 9780121821012. PMID 1956325.
- ^ Modi, V; Dunbrack, RL (24. 12. 2019). "A Structurally-Validated Multiple Sequence Alignment of 497 Human Protein Kinase Domains". Scientific Reports. 9 (1): 19790. Bibcode:2019NatSR...919790M. doi:10.1038/s41598-019-56499-4. PMC 6930252. PMID 31875044.
- ^ Knighton DR, Zheng JH, Ten Eyck LF, Ashford VA, Xuong NH, Taylor SS, Sowadski JM (juli 1991). "Crystal structure of the catalytic subunit of cyclic adenosine monophosphate-dependent protein kinase". Science. 253 (5018): 407–14. Bibcode:1991Sci...253..407K. doi:10.1126/science.1862342. PMID 1862342.
- ^ Higashiyama S, Iwabuki H, Morimoto C, Hieda M, Inoue H, Matsushita N. Membrane-anchored growth factors, the epidermal growth factor family: beyond receptor ligands. Cancer Sci. 2008 Feb;99(2):214-20. Review. PMID 18271917
- ^ Carpenter G. The EGF receptor: a nexus for trafficking and signaling. Bioessays. 2000 Aug;22(8):697-707. Review. PMID 10918300
Vanjski linkovi[uredi | uredi izvor]
- Human and mouse protein kinases in UniProt: classification and index
- Kinase.Com Arhivirano 20. 1. 2022. na Wayback Machine: Genomics, evolution and large-scale analysis of protein kinases (non-commercial).
- KinMutBase: A registry of disease-causing mutations in protein kinase domains Arhivirano 15. 6. 2022. na Wayback Machine
- KLIFS (Kinase-Ligand Interaction Fingerprints and Structures) Database -- analysis of kinase structures and kinase-inhibitor interactions
- KinCore: the Kinase Conformation Resource: A web resource for protein kinase sequence, structure and phylogeny
