Suhi led


Suhi led je čvrsti oblik ugljik dioksida. Najviše se koristi kao sredstvo za rashlađivanje. Prednost mu je što omogućava rashlađivanje na niže temperature od običnog leda te nakon isparavanja ne ostavlja nikakve ostatke (za razliku od topljenja običnog leda nakon čega ostaje voda). Koristan je za konzerviranje i održavanje hrane, sladoleda i slično, kada nisu dostupni frižideri i drugi rashladni uređaji.
Suhi led sublimira na temperaturi od -78,5 °C pri normalnom atmosferskom pritisku na Zemlji. Ova izuzetno niska temperatura čini ovaj spoj opasnim za rukovanje bez odgovarajuće zaštite. Na ljudskom tijelu može izazvati smrzavanje. Iako nije otrovan, pri isparavanju većih količina ugljik dioksida može doći do hiperkapnije u zatvorenim prostorijama.
Osobine[uredi | uredi izvor]
Suhi led je forma ugljik dioksida u čvrstom stanju (hemijska formula CO2), sastoji se iz dva atoma kisika vezana kovalentnom vezom sa jednim atomom karbona. On je bezbojan, ne gori i pokazuje slabe kisele osobine.[1]
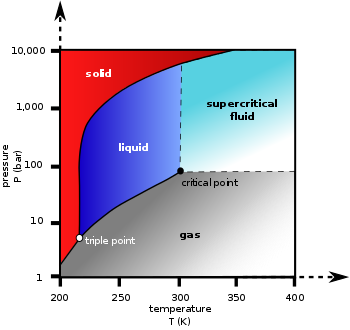
Na temperaturama ispod -56,4 °C i pritisku ispod 5,13 atm (trostruka tačka), CO2 mijenja svoje agregatno stanje iz čvrstog direktno u gasovito bez prelaska u tekuće, kroz proces sublimacije. Suprotan proces naziva se depozicija, kada CO2 prelazi iz gasovitog direktno u čvrsto stanje (suhi led). Pri atmosferskom pritisku, sublimacija i depozicija se dešavaju pri temperaturi od -78,5 °C. Gustoća suhog leda je promjenjiva, obično se kreće između 1,4 i 1,6 g/cm3[2]
Niska temperatura i direktna sublimacija u gas daje suhom ledu odlične rashladne osobine, pošto je hladniji od običnog leda te nakon depozicije ne ostavlja ostatke.[3] Suhi led ima entalpiju sublimacije od 571 kJ/kg (25,2 kJ/mol). On je nepolaran, pošto mu je molekularni dipolni momenat jednak nuli te tako da između molekula djeluju privlačne van der Waalsove sile.[4] Sastav rezultira niskom termalnom i električnom provodljivošću.[5]
Upotreba[uredi | uredi izvor]
Prehrambena industrija[uredi | uredi izvor]
Najčešća upotreba suhog leda je čuvanje hrane[1] u slučajevima kada nema dostupnih rashladnih uređaja. Često se koristi i za pakovanje stvari kojima je neophodno da ostanu hladne ili smrznute, poput sladoleda ili bioloških uzoraka, a kada mehanički rashladni uređaji nisu dostupni ili nepraktični.
Nauka[uredi | uredi izvor]
U laboratorijama, muljeviti razvodnjeni oblik suhog leda je organsko otapalo korisan kao smjesa za hlađenje kod hemijskih reakcija gdje su potrebne niske temperature te za kondenziranje otapala u rotirajućim evaporatorima.[6]
Reference[uredi | uredi izvor]
- ^ a b Yaws, Carl (2001). Matheson gas data book (7. izd.). McGraw-Hill Professional, str. 125, ISBN 978-0-07-135854-5
- ^ Häring 2008, str. 200
- ^ Yaws 2001, str. 124
- ^ Khanna i Kapila 2008, str. 161
- ^ Khanna i Kapila 2008, str. 163
- ^ Housecroft 2001, str. 410
Literatura[uredi | uredi izvor]
- Housecroft, Catherine; Sharpe, Alan G (2001). Inorganic Chemistry. Harlow: Prentice Hall. ISBN 0-582-31080-6
- Häring, Heinz-Wolfgang (2008). Industrial Gases Processing. Christine Ahner. Wiley-VCH. ISBN 978-3-527-31685-4
- Khanna, S. K.; Kapila, Dr. B. (2008). Comprehensive Chemistry X. Laxmi Publications. ISBN 978-81-7008-596-6
| Commons ima datoteke na temu: Suhi led |

