Nukleofilna supstitucija
Ovaj članak nije preveden ili je djelimično preveden. |
Nukleofilna supstitucija je temeljna klasa hemijskih reakcija u kojima elektronski bogati nukleofili putem odabira vežu ili napadaju pozitivni ili djelomično pozitivni naboj atoma ili grupe atoma, zamjenjujući odlazeće grupe. Pozitivni ili djelomično pozitivni atomi nazivaju se elektrofili. Cijeli molekularni entitet koji je elektrofilan i odlazeća grupa su dio koji se obično naziva podloga.[1][2] Najviše općih oblika odvijanja ovih hemijskih reakcija dat je kako slijedi:
- Nuc: + R-LG → R-Nuc + LG:
Elektronski par (:) nukleofila (Nuc) napada supstrate (R-LG) stvarajući novu vezu, dok odlazeća grupa (LG) polazi sa elektronskim parom. Glavni proizvod u ovom slučaju je R-Nuc. Nukleofil može biti električno neutralan ili negativno nabijen, dok je podloga obično neutralna ili pozitivno naelektrisana. Jedan primjer nukleofilne supstitucije je hidroliza alkil broma i R-Br pod osnovnim uslovima, gdje je napadajući nukleofil OH–, a odlazeća grupa je Br−.
- R-Br + OH− → R-OH + Br−
Nukleofilne reakcije supstitucije su uobičajene u organskoj hemiji, a mogu biti u širokoj kategoriji odvijanja u zasićenja alifatskog ugljika ili (manje često) u aromatskom ili drugom nezasićenom ugljičnom centru.[3]
Zasićeni ugljikovi centri[uredi | uredi izvor]
Reakcija SN1 and SN2[uredi | uredi izvor]

Godine 1935., Edward D. Hughes i Sir Christopher Ingold studirali su reakcije nukleofilne supstitucije alkil-halida i srodnih spojeva. Predložili su da tamo djeluju dva glavna mehanizma, u međusobnom natjecanju. Ti glavni mehanizmi su reakcija SN1 i reakcija SN2. Pri označavanju hemijske supstitucije, N označava nukleofile, a broj predstavlja kinetički red reakcije.[4]
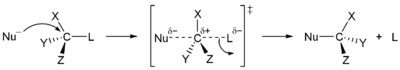
U reakciji SN2, dodavanja nukleofila i uklanjanje odlazeće grupe odvijaju se istovremeno u usklađenoj reakciji. SN2 javlja se gdje je lahko dostupan nukleofilski centralni atom ugljika lahko dostupan nukleofilu.[5]
| Nuklefilna supstitucija na ugljiku | |
|---|---|
| |

| |
| Mehanizam SN2 | |
U reakciji SN2, postoji nekoliko uslova koji utiču na njenu brzinu. Prije svega, 2 u SN2 podrazumijeva da postoje dvije koncentracije supstanci koje utiču na stopu reakcije: supstrat i nukleofil. Jednačina stope za ovu reakciju bi bila:
- Stopa=k[Sub][Nuc]. Za reakciju SN2 najbolji je aprotonski rastvarač, kao što su aceton, DMF ili DMSO. Aprotonski rastvarač ne dodaje protone (H+) iona u rastvor. U prisustvu protona u reakciji SN2, oni mogu reagirati sa nukleofilom i ozbiljno ograničiti brzinu reakcije. Pošto je ovo reakcija koja se javlja u jednom koraku, prostorni efekti usmjeravaju brzinu reakcije. u međukoraku nukleofil se nalazi 180 stepeni od odlazeće grupe, a stereohemija je obrnuta kako nukleofilske veze čine proizvod. Također, zbog djelomične veze međuproizvoda na nukleofil i odlazeću grupu, nema vremena da se podloga preuredi: nukleofil će se vezati na isti ugljik kao i vezana odlazeća grupa. Konačni faktor koji utiče na stopu reakcija nukleofilnosti je da nukleofil mora napasti neki drugi atom, osim vodika.
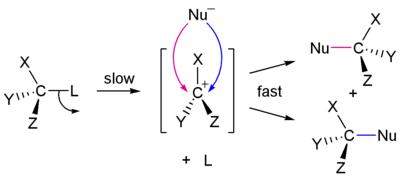
Nasuprot tome, reakcija SN1 uključuje dva koraka. Ona ima tendenciju da bude važna kada je centralni atom ugljika podloge okružen glomaznom grupom, kako zbog toga što takve grupe ometaju prostornost sa reakcijom SN2 (gore navedeno) i zbog toga što je vrlo supstituirani oblik ugljika stabilan karbokation.
| Nukleofilna supstitucija na ugljiku | |
|---|---|
| |
| Mehanizam SN1 | |
Kao i u reakciji SN2, postoji dosta faktora koji utiču na brzinu reakcije SN1. Umjesto dvije koncentracije koje utiču na brzinu reakcije, postoji samo jedna, podloge. Jednadžba stope za ovo bi bila
- Stopa = k [Sub]. S obzirom da se stopa reakcije određuje samo po najsporijem koraku, stopa po kojoj odlazeća grupa "odlazi" određuje brzinu reakcije. To znači da ako je bolja odlazeća grupa, brzina reakcije je veća. Opće pravilo za ono što čini dobrom odlazeću grupu je da što je slabija konjugirana baza, to je bolja odlazeća grupa. U ovom slučaju, halogeni bi bili najbolje odlazeće grupe, dok spojevi kao što su amini, vodik i alkani prilično loše odlazeće grupe. Kao što je reakcija SN2 pogođena prostornošću, reakcija SN1 određuje glomazne grupe priključene na karbokatjonske. Budući da je srednja grupa ta koja zapravo sadrži pozitivan naboj, a privezane glomazne grupe će pomoći u stabilizaciji naboja na karbokationu putem rezonance i raspodjele punjenja. U ovom slučaju, tercijarni karbokation će reagirati brže od sekundarnog, koji će reagirati mnogo brže nego primarni. To je i zbog ovog karbokatjonskog međuproizvoda koji ne mora imati inverzije. Nukleofil može napasti sa vrha ili dna i stoga stvoriti razgranati proizvod. Važno je da se koriste protonska otapala, kao što su voda i alkohol, jer bi aprotonsko otapalo moglo napasti međuproizvod i izazvati neželjene proizvode. Nije bitno da li vodik iz protonskog otapala reagira sa nukleofilom, jer nukleofil nije uključen u koraku određivanja stope.
| Nukleofilna supstitucija na RX (alkil halid ili ekvivalent) | |||||||
|---|---|---|---|---|---|---|---|
| Faktor | SN1 | SN2 | Komentar | ||||
| Kinetika | Stopa = k[RX] | Stopa = k[RX][Nuc] | |||||
| Primarni alkil | Nikad osim prisutnih dodatnih grupa stabilizacije | Dobro, osim ako se koristi otežani nukleofil | |||||
| Sekundarni alkil | Umjereno | Umjereno | |||||
| Tercijarni alkil | Odlično | Nikad | Eliminacija, slično kada se zagrijava ili upotrebljava jaka baza | ||||
| Odlazeća grupa | Značajno | Značajni | Za halogene, I > Br > Cl >> F | ||||
| Nukleofilnost | Beznačajno | Značajno | |||||
| Preferirani rastvarač | Polarni protonski | Polarni aprotonski | |||||
| Stereohemija | Racemizacija (+ moguća parcijalna inverzija) | Inverzija | |||||
| Preuređenje | Uobičajeno | Rijetko | Bočna reakcija | ||||
| Eliminacije | Uobičajeno, posebno sa baznim nukleofilima | Samo uz zagrijavanje i bazne nukleofile | Bočna reakcija posebno uz zagrijavanje | ||||
Reakcije[uredi | uredi izvor]
Postoji mnogo reakcija u organskoj hemiji koje uključuju ovu vrstu mehanizma. Uobičajeni primjeri obuhvataju:
- organske redukcije sa hidridima, naprimjer;
- hidroliza, reakcije kao što su
- Wenkerova sinteza, reakcija zatvaranja prstena aminoalkohola.
- Finkelsteinova reakcija, reakcija razmjene halida. Fosforni nukleofili koji se javljaju u Perkowljeva reakcija i Michaelis–Arbuzov reakciji.
- Kolbeova sinteza nitrila, reakcija alkil-halida sa cijanidima.
Granični mehanizam[uredi | uredi izvor]
Primjer reakcije supstitucije prema tzv. graničnom mehanizmu odvija se kao što su prvobitno proučili Hughes i Ingold,[6] – je reakcija 1-feniletil-hlorida sa natrij-methoksidom u metanolu.
Stopa reakcije je zbir komponenti SN1 and SN2 sa 61% (3,5 M, 70 °C) koji se održavaju od drugih.
Ostali mehanizmi[uredi | uredi izvor]
Osim SN1 and SN2, poznati su i drugi mehanizmi, iako su manje uobičajeni. Mehanizam SNi se posmatra u reakcijama tionil-hlorida sa alkoholima, što je slično S< sub>N1, osim ako se nukleofil isporučuje sa iste strane kao odlazeča grupa. Nukleofilna supstitucija može biti u pratnji alilnog preuređenja kao što se vidi u reakcijama poput Ferrierovog preuređenja. Ova vrsta mehanizma se naziva SN1' ili SN2' reakcija (ovisno o kinetici). Sa alilnim halogenidima ili sulfonatima, naprimjer, nukleofil može napasti na γ nezasićeni ugljik, umjesto ugljika kojeg nosi odlazeća grupa. To se može vidjeti u reakciji 1-hlor-2-buten sa natrij-hidroksidom koja daje mješavinu 2-buten-1-ola i 1-buten-3-ola:
- CH3CH=CH-CH2-Cl → CH3CH=CH-CH2-OH + CH3CH(OH)-CH=CH2
Mehanizam Sn1CB se javlja u neorganskoj hemiji, gdje postoje suparničkih mehanizama.[7][8]
U organometalnoj hemiji, sa mehanizmom nukleofilne supstitucije javlja se nukleofilna apstrakcija.
Nezasićeni ugljikovi centri[uredi | uredi izvor]
Nukleofilna supstitucija preko mehanizma SN1 ili SN2 S, uglavnom se ne javljaju sa vinil ili aril halogenidima ili srodnim spojevima. Pod određenim uslovima može doći do nukleofilne supstitucije, preko drugih mehanizama, kao što su oni opisani u članku nukleofilna aromatska supstitucija. Kada se supstitucije javlja u karbonil grupi, acil grupa može proći kroz acil nukleofilnu supstituciju. To je normalan način supstitucije derivatima karboksilne kiseline, kao što su acil-hloridi, esteri i amidi.
Reference[uredi | uredi izvor]
- ^ J. March, Advanced Organic Chemistry, 4th ed., Wiley, New York, 1992.
- ^ R. A. Rossi, R. H. de Rossi, Aromatic Substitution by the SRN1 Mechanism, ACS Monograph Series No. 178, American Chemical Society, 1983. [[[International Standard Book Number|ISBN]] 0-8412-0648-1].
- ^ L. G. Wade, Organic Chemistry, 5th ed., Prentice Hall, Upper Saddle RIver, New Jersey, 2003.
- ^ S. R. Hartshorn, Aliphatic Nucleophilic Substitution, Cambridge University Press, London, 1973. [[[International Standard Book Number|ISBN]] 0-521-09801-7]
- ^ Introducing Aliphatic Substitution with a Discovery Experiment Using Competing Electrophiles Timothy P. Curran, Amelia J. Mostovoy, Margaret E. Curran, and Clara Berger Journal of Chemical Education 2016 93 (4), 757-761 doi:10.1021/acs.jchemed.5b00394
- ^ 253. Reaction kinetics and the Walden inversion. Part II. Homogeneous hydrolysis, alcoholysis, and ammonolysis of -phenylethyl halides Edward D. Hughes, Christopher K. Ingold and Alan D. Scott, J. Chem. Soc., 1937, 1201 doi:10.1039/JR9370001201
- ^ N.S.Imyanitov. Electrophilic Bimolecular Substitution as an Alternative to Nucleophilic Monomolecular Substitution in Inorganic and Organic Chemistry. J. Gen. Chem. USSR (Engl. Transl.) 1990; 60 (3); 417-419.
- ^ Unimolecular Nucleophilic Substitution does not Exist! / N.S.Imyanitov. SciTecLibrary
Vanjski linkovi[uredi | uredi izvor]
| Commons ima datoteke na temu: Nukleofilna supstitucija |


