Stereoizomerizam

U stereohemiji, stereoizomerizam ili prostorni izomerizam, je oblik izomerizma u kojem molekule imaju istu molekulsku formulu i niz vezanih atoma (konstitucija), ali se razlikuju u trodimenzijskoj orijentaciji atoma u prostoru.[1] To je u suprotnosti sa strukturnim izomerima, koji imaju istu molekulsku formulu, ali veze ili njihov redoslijed se razlikuju. Po definiciji, molekule koje su međusobno stereoizomeri predstavljaju isti strukturni izomer.
Enantiomeri
[uredi | uredi izvor]Enantiomeri, poznati i kao optički izomeri, dva su stereoizomera koja su međusobno povezana jednakim odrazom: međusobno su slika u ogledalu i nisu superposabilni . Ljudske ruke su makroskopski analog ovoga. Svaki stereogeni centar u jednom ima suprotnu konfiguraciju u drugom. Dva spoja koji su međusobno enantiomeri imaju ista fizička svojstva, osim smjera u kojem se okreće polarizovana svjetlost i načina interakcije s različitim optičkim izomerima drugih spojeva. Kao rezultat toga, različiti enantiomeri datog spoja mogu imati bitno različite biološke efekte. Čisti enantiomeri takođe pokazuju fenomen optičke aktivnosti i mogu se odvojiti samo upotrebom hiralnih sredstva. U prirodi je prisutan samo jedan enantiomer većine hiralnih bioloških spojeva, poput aminokiselina (osim glicina, koji je ahiralni). Optički aktivni spoj pokazuje dva oblika: D –(+) oblik i L – (–) oblik.
Diastereomeri
[uredi | uredi izvor]Dijastereomeri su stereoizomeri koji nisu povezani operacijom refleksije. Oni nisu međusobna ogledalna slika. Tu spadaju mezo spojevi, cis-trans izomeri, EZ izomeri i neenantiomerni optički izomeri. Dijastereomeri rijetko imaju ista fizička svojstva. U dolje prikazanom primjeru, mezo-oblik vinske kiseline tvori dijastereomerni par i s levo i s dekstro vinskom kiselinom, koji čine enantiomerni par.

|

| |
|
(Prirodna) vinska kiselina |
D–( –)- vinska kiselina |
Mezo-vinska kiselina |
|
(1:1) |
||
D- i L-označavanje izomera gore nije isto što i oznake d- i l- češće viđene, objašnjavajući zašto se one mogu činiti obrnutima za one koji su upoznati sa samo potonjom konvencijom imenovanja.
Cis – trans i E-Z izomernost
[uredi | uredi izvor]Stereoizomerija o dvostrukim vezama nastaje zato što je rotacija oko dvostruke veze ograničena, a supstituenti ostaju fiksirani jedni prema drugima. Ako su dva supstituenta na barem jednom kraju dvostruke veze ista, tada nema stereoizomera i dvostruka veza nije stereocentar. Primjer je propen, CH3CH=CH2, gdje su dva supstituenta na jednom kraju oba H.
Tradicijski, stereohemija dvostrukih veza opisana je ili kao cis (latinski, s ove strane) ili kao trans (latinski, prijeko), u odnosu na relativni položaj supstituenata na bilo kojoj strani dvostruke veze. Najjednostavniji primjeri cis – trans izomerije su 1,2-disupstituirani eteni, poput dolje prikazanih izomera dihloroetena (C2H2Cl2).
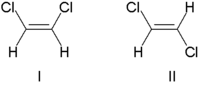
Molekula I je cis-1,2-dihloroeten, a molekula II je trans-1,2-dihloroeten. Zbog povremenih nejasnoća, IUPAC je usvojio rigorozniji sistem u kojem se supstituentima na svakom kraju dvostruke veze dodjeljuje prioritet na osnovu njihovog atomskog broja. Ako su supstituenti visokog prioriteta na istoj strani veze, dodjeljuje se Z (njem. zusammen = zajedno). Ako su na suprotnim stranama, to je E (njem. entgegen = nasuprot). Budući da hlor ima veći atomski broj od vodika, on je grupa s najvećim prioritetom. Koristeći ovaj način za imenovanje gornjih molekula, molekula I je (Z)-1,2-dihloroeten, a molekula II je (E)-1,2-dihloroeten. Nije slučaj da su Z i cis ili E i trans uvijek zamjenjivi. Treba uzeti u obzir sljedeći fluorometilpenten:
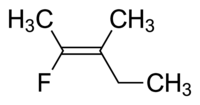
Ispravno ime za ovu molekulu je ili trans-2-fluoro-3-metilpent-2-en, jer alkilne grupe koje čine okosnicu (tj. metil i etil) su međusobno vezane preko dvostruke veze ili (Z)-2-fluoro-3-metilpent-2-ena, jer su grupe s najvišim prioritetom na svakoj strani dvostruke veze na istoj strani dvostruke veze. Fluoro je skupina s najvećim prioritetom na lijevoj strani dvostruke veze, a etil je grupa s najvećim prioritetom na desnoj strani molekule.
Izrazi "cis" i "trans" također se koriste za opisivanje relativnog položaja dva supstituenta na prstenu; cis ako je na istoj strani, inače trans.
Konformeri
[uredi | uredi izvor]Konformacijska izomernost je oblik izomerije koji opisuje fenomen molekula s istom strukturnom formulom, ali različitih oblika, zbog rotacija oko jedne ili više veza. Različite konformacije mogu imati različite energije, a obično se mogu međusobno pretvoriti i vrlo rijetko se mogu izolirati. Naprimjer, cikloheksan može postojati u raznim različitim konformacijama, uključujući konformaciju stolice i brodsku konformaciju, ali, za sam cikloheksan, te se nikada ne mogu razdvojiti. Konformacija broda predstavlja maksimum energije na konformacijskom planu puta između dva ekvivalentna oblika stolice; međutim, on ne predstavlja tranzicijsko stanje za ovaj proces, jer postoje putevi niže energije.
Anomeri
[uredi | uredi izvor]Anomerizam je identitet za jednostruko vezanom prstenastom strukturom, gdje cis ili E i trans ili Z (geometrijska izomerija). Trebaju se imenovati po supstituciji na atomu ugljika koja također ispoljava identitet hiralnosti ; tako anomeri imaju atome ugljika koji imaju geometrijsku i optičku izomernost (enantiomerizam) na jednom ili više ugljika u prstenu. Anomeri se nazivaju alfa ili aksijalni i beta ili ekvatorski, kada zamjenjuju cikličnu strukturu prstena koja ima jednostruke veze između atoma ugljika u prstenu, naprimjer, hidroksilna grupa, metil hidroksilna grupa, metoksi grupa ili druge grupe piranoze ili furanoze, koje su tipske supstitucije jednostruke veze, ali nisu ograničene na njih. Aksijalna geometrijska izomernost bit će okomita (90 stepeni) na referentnu ravninu, a ekvatorijalno će biti udaljena 120 stepeni od aksijalne veze ili odstupati za 30 stepeni od referentne ravni.[2]
Atropizomeri
[uredi | uredi izvor]Atropizomeri su stereoizomeri koji nastaju kao posljedica otežanog okretanja oko jednostruke veze, pri čemu je sterna deformacija barijera rotaciji dovoljno visoka da omogući izolaciju konformera.
Ostale definicije
[uredi | uredi izvor]- Konfiguracijski stereoizomer je stereoizomer referentna molekule, koji ima suprotnu konfiguraciju u stereocentru (npr. R– vs S– ili E– vs Z–). To znači da se konfiguracijski izomeri mogu međusobno pretvoriti samo prekidom kovalentnih veza na stereocentru, naprimjer, invertiranjem konfiguracija nekih ili svih stereocentra u spoju.
- Epimer je diastereoizomer koji ima suprotnu konfiguraciju u samo jednom od stereo centara.
Pravilo Le Bel-van't Hoffa
[uredi | uredi izvor]Le Bel-van't Hoffovo pravilo navodi da za strukturu sa n asimetričnim atomima ugljika postoji najviše 2n različitih mogućih stereoizomera. Kao primjer, D-glukoza je aldoheksoza i ima formulu C6H12O6. Četiri od njegovih šest atoma ugljika su stereogeni, što znači da D-glukoza ima jedan od 24 = 16 mogućih stereoizomera.
Reference
[uredi | uredi izvor]- ^ Columbia Encyclopedia. "Stereoisomers" in Encyclopedia.com, n.l., 2005, Link
- ^ Morrison and Boyd Organic Chemistry Sixth ed. pgs. 1170-1171 ISBN 0-13-643669-2

