Kovalentna veza
Ovaj članak ili neki od njegovih odlomaka nije dovoljno potkrijepljen izvorima (literatura, veb-sajtovi ili drugi izvori). |
Kovalentna veza je vrsta veze između dva ili više atoma nemetala kojom se između njih postiže neutralna elektronska konfiguracija (konfiguracija plemenitih plinova). Neutralna "kolekcija" atoma vezanih kovalentnom vezom nazvana je molekula. Razlika kovalentne i ionske veze ogleda se u tome što atomi u ionskoj vezi otpuštaju ili primaju elektrone da bi upotpunili svoju elektronsku konfiguraciju do konfiguracije najbližeg plemenitog plina. Nasuprot njih, atomi u kovalentnoj vezi ne otpuštaju elektrone nego ih dijele između sebe i na taj način dostižu elektronsku konfiguraciju najbližeg plemenitog plina.
Najjednostavniji način za predstavljanje kovalentne veze u molekuli je tzv. "Lewisova" struktura ili struktura elektronskih tačaka, u kojoj su valentni elektroni atoma predstavljeni kao tačke. Tako naprimjer, vodonik svoj 1s elektron predstavlja jednom tačkom, ugljik ima četiri tačke (2s2 2p2), kisik ima šest tačaka (2s2 2p4) itd. Stabilna molekula se postiže samo onda kada svi atomi u molekuli postignu konfiguraciju plemenitog plina: oktet (osam elektrona) za većinu atoma, odnosno dva za vodik.
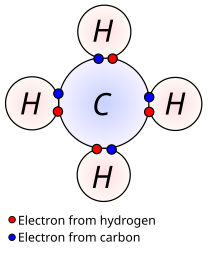
U molekuli, nije neophodno da svi elektroni na najvišem energetskom nivou (elektronskoj ljusci) budu uključeni u formiranje kovalentne veze. Valentni elektroni koji ne učestvuju u kovalentnoj vezi nazivaju se usamljeni elektronski parovi (engleski: lone-pair electrons). Na primjer, atom dušika u molekuli amonijaka dijeli šest valentnih elektrona u tri kovalentne veze (sa tri atoma vodika), a preostala dva valentna elektrona su nevezani usamljeni elektroni.
Pored Lewisovog načina predstavljanja kovalentne veze putem tačaka, postoji još i Kekulé-ov model ili linearna struktura prikaza veze. Ovim načinom se umjesto dva kovalentna elektrona između atoma prikazuje prava linija, dok se usamljeni elektronski parovi često izostavljaju.
Teorije kovalentne veze[uredi | uredi izvor]
Postoje dvije glavne teorije o tome kako se dešava dijeljenje elektrona u kovalentnoj vezi:
- Teorija valentne veze i
- Teorija molekulskih orbitala
Oba modela imaju svoje prednosti i slabosti, te ih hemičari upotrebljavaju u ovisnosti od situacije.
Teorija valentne veze[uredi | uredi izvor]
Osnovne ideje ove teorije su:
- Kovalentna veza se formira preklapanjem dvije atomske orbitale, od kojih svaka sadrži po jedan elektron različitih spinova
- Svaki povezani atom zadržava svoje vlastite atomske orbitale, ali elektronski parovi u zajedničkim orbitalama se dijele između tih atoma
- Koliko god ima više preklapajućih orbitala, utoliko je snažnija veza
Teorija molekulskih orbitala[uredi | uredi izvor]
Osnovne ideje ove teorije su:
- Ono što su atomske orbitale za atom, to su molekulske orbitale za molekulu. Molekulske orbitale opisuju prostor u molekuli, gdje postoji najveća mogućnost da se pronađu elektroni, te imaju specifičnu veličinu, oblik i energetski nivo.
- Molekulske orbitale se formiraju kombiniranjem atomskih orbitala. Broj molekulskih orbitala koje se formiraju je isti kao i broj atomskih orbitala koje se kombinuju.
- Molekulske orbitale koje imaju nižu energiju od početnih atomskih orbitala su vezujuće orbitale; molekulske orbitale koje imaju višu energiju od početnih atomskih orbitala su antivezujuće, dok one koje imaju istu energiju kao i početne atomske orbitale su nevezujuće.
Vanjski linkovi[uredi | uredi izvor]
- Covalent Bonds and Molecular Structure Arhivirano 10. 2. 2009. na Wayback Machine
- Structure and Bonding in Chemistry—Covalent Bonds
| Covalent bonds na Wikimedia Commonsu. |
Reference[uredi | uredi izvor]
- John McMurry: Organic chemistry, 5. izdanje, Cornell University, 1999, str. 9-15, ISBN 0-534-37366-6

