Stereoizomer

Stereoizomeri su hemijski spojevi koji imaju iste sastojke, ali različite rasporede.
Enantiomeri[uredi | uredi izvor]

Enantiomeri su stereoizomeri koji se međusobno odnose kao predmet i lik u ogledalu. Svaki stereocentar datog enantiomera ima suprotni hemijski raspored na odgovarajućem hiralnom atomu drugog enantiomera. Enantiomeri imaju identična fizička obilježja, osim što jedan enantiomer okreće ravan polarizirane svjetlosti u lijevo, a drugi u desno. Međutim, kod hemijskih aktivnosti značajno se razlikuju u reaktivnosti sa drugim optički aktivnim spojevima. Enantiomeri se zato mogu razlikovati ili propuštanjem polarizirane svjetlosti kroz standardizirani rastvor i mjerenjem ugla skretanja svjetlosne ravni ili u reakciji sa nekim hiralnim reagensima. U prirodi postoji pravilo da najčešće jednog enantiomera ima značajno više od drugog, kao naprimjer, kod aminokiselina. Posljedica svega ovoga je veoma različita biološka aktivnost enantiomera.[1] [2]
Dijastereoizomeri[uredi | uredi izvor]
Dijastereoizomeri su stereoizomeri čiji odnos nije kao kod predmeta i lika u ogledalu, odnosno to su svi stereoizomeri koji nisu enantiomeri. Geometrijska izomerija nekih klasa spojeva pripada kategoriji dijastereoizomera, ali u najužem smislu objedinjuje optički aktivne ne-enantiomerne oblike hemijskih spojeva. U primjeru koji slijedi, vinska kiselina ima dva hiralna ugljikova atoma, što znači da bi po pravilu trebala imati 4 stereoizomera. Od toga su dva – -L--(+)-vinska kiselina i -D--(-)-vinska kiselina – enantiomeri, dok su druga dva zapravo identični hemijski spojevi: mezovinska kiselina. U ovom obliku se javlja ravan simetrije, zbog čega mezo-vinska kiselina ne ispoljava optičku aktivnost, ali se prema dva enantiomerna oblika odnosi kao prema dijastereoizomerima. Dijastereoizomeri se gotovo redovno međusobno razlikuju po fizičkim i hemijskim osobinama.

|

| |
| Vinska kiselina L-(+)-Vinska kiselina Dekstrovinska kiselina |
Mezovinska kiselina | |
|
(1:1) |
||
Geometrijski izomeri[uredi | uredi izvor]

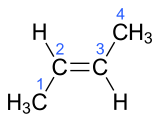
Stereoizomerija kod jedinjenja sa kovalentnom vezom javlja se kao posljedica relativnog odsustva mogućnosti rotacije oko dvostruke veze, što znači da su sastojci u stalnom položaju jedan prema drugom. Prostorna obilježja ovakvih molekula ne može se razmatrati ukoliko su sa bilo koje strane dvostruke veze (gledano u odnosu na ravan koja je okomita na vezu), prisutni isti sastojci.
Uobičajeni način opisa stereohemije spojeva sa dvostrukom vezom obuhvata upotrebu cis-trans naziva, preuzetih od opisivanja položaja sastojaka u cikličnim jedinjenjima kao iznad ili ispod ravni prstena. Cis-trans nomenklatura se može upotrebljavati samo ako su posmatrani sastojci isti ili slični.
Nešto dosljedniji je sistem IUPAC-a, koji se može koristiti i kada posmatrani sastojci nisu identični, ali samo ako je moguće ustanoviti njihov redoslijed prioriteta. Time se obuhvata određivanje prioriteta kod svakog pojedinačnog sastojka. Nakon toga se hemijski raspored označava kao E (=suprotno), ukoliko su sastojci viših prioriteta na suprotnim stranama dvostruke veze, odnosno Z (=zajedno) ako su sastojci sa višim prioritetom sa iste strane dvostruke veze. Veoma često je Z hemijski raspored ujedno i cis, a E je trans, ali kao što se uočava u datim primjerima, ovo nije opće pravilo.
  |
 
|
| Trans-1,2-dihlorocikloheksan | Cis-1,2-dihlorocikloheksan |
Konformacije[uredi | uredi izvor]
Konformacije predstavljaju različite prostorne oblike datih hemijskih spojeva koji nastaju rotacijom oko jedne ili više jednostrukih veza. Različite konformacije imaju i različite sadržaje energije, što zavisi od niza činilaca i međuodnosa u samoj molekuli. U zavisnosti od broja jednostrukih veza i prirode same molekule, ona se može javiti u više konformacija. Na taj način praktično je nemoguće odvojiti pojedinačni oblik od ostalih. Ovakav primjer je cikloheksan, koji ne postoji u konformacijama "stolice" i "lađe", ali ih je nemoguće međusobno razdvojiti. Kod nekih spojeva kao što su 2,2,2,2-tetrasupstutuirani bifenili, ovo je ipak moguće zbog velikih energetskih prepreka između dvije konformacije. Ova pojava se naziva atropizomerija, koja predstavlj jedan oblik enantiomerije, iako je neki autori izdvajaju kao zasebnu.
Također pogledajte[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ Alberts B.; et al. (2002). Molecular Biology of the Cell, 4th Ed. Garland Science. ISBN 0-8153-4072-9. Eksplicitna upotreba et al. u:
|author=(pomoć) - ^ Voet D., Voet J. G. Biochemistry, 3rd Ed.[publisher= Wiley. ISBN 978-0-471-19350-0.
Dopunska literatura[uredi | uredi izvor]
- Ernest L. Eliel, Samuel H. Wilen (1994). Stereochemistry of Organic Compounds (1 izd.). Wiley, John & Sons, Incorporated. ISBN 0-471-01670-5.CS1 održavanje: ref=harv (link)
- Ernest L. Eliel, Samuel H. Wilen, Michael P. Doyle (2001). Basic Organic Stereochemistry (1. edition izd.). Wiley-Interscience. ISBN 0-471-37499-7.
|edition=sadrži dodatni tekst (pomoć)CS1 održavanje: više imena: authors list (link) CS1 održavanje: ref=harv (link) - Kurt Martin Mislow Kurt Mislow (2003). Introduction to Stereochemistry. Dover Publications. ISBN 0-486-42530-4.CS1 održavanje: ref=harv (link)
- D. Nasipuri (1994). Stereochemistry of Organic Compounds: Principles and Applications (2 edition izd.). South Asia Books. ISBN 81-224-0570-3.
|edition=sadrži dodatni tekst (pomoć)CS1 održavanje: ref=harv (link)
Vanjski linkovi[uredi | uredi izvor]
| Commons ima datoteke na temu: Stereoizomer |


