Dvopolarizirani ion
Dvopolarizirani ion ili hermafroditni ion (u literaturi pozanat pod njemačkim nazivom zwitterion) je molekula koja sadrži podjednak broj pozitivno i negativno nabijenih funkcijskih grupa, uključujući i samo po jednu takvu.[1] Ovakvi ioni se također mogu označiti kao unutrašnje soli. Naprimjer, s aminokiselinama, u otopini se uspostavlja hemijska ravnoteža između "matične" molekule i zwitteriona.
Betaini su cviterioni koji se ne mogu izomerizirati do potpuno neutralnog oblika, kao naprimjer kada se pozitivni naboj nalazi u kvarternarnoj amonijskoj grupi. Slično tome, molekula koji sadrži fosfonijsku i karboksilatnu grupu ne može se izomerizirati.
Aminokiseline
[uredi | uredi izvor]
Zwitterion se formira u dvije faze. U stadiju 1, proton se prenosi iz karboksilne grupe u molekulu vode.
U stupnju 2, proton se prenosi iz hidronijskog iona u aminsku grupu:
Obrnute reakcije nastaju obrnutim redoslijedom. Općenito, ovo je reakcija izomerizacija
Omjer koncentracija dviju vrsta u otopini bit će neovisan o pH jer je jednak vrijednosti konstante ravnoteže za reakciju izomerizacije
[X] označava koncentraciju hemijske vrste X u ravnoteži. Općenito se pretpostavlja da je K> 1, to jest da je zwitterion dominantni izomer aminokiselina u otopini. Jedno objašnjenje zasnovano na teorijskoj analizi je da je neutralni oblik sam po sebi manje stabilan, ali postaje stabiliziran vodikovom vezom s molekulama vode.[2] Analiza podataka neutronske difrakcije za glicin pokazala je da je u čvrstom stanju u zwitterionskom obliku.[3]
Teorijski proračuni korišteni su da pokažu da ovi ioni mogu biti i u plinskoj fazi za neke slučajeve drugačije od jednostavnog prijenosa karboksilne kiseline u amin.[4]
pKavrijednost za deprotoniranje uobičajenih aminokiselina obuhvata približni raspon od 2,15 ± 0,2. To je također u skladu s prevladavajućim izoomerom koji je prisutan u vodenoj otopini. Za poređenje, karboksilna propionska kiselina (RCO2H (R=CH3CH2), ima pK vrijednost od 4,88.
Ostali spojevi
[uredi | uredi izvor]-
Izomeri Izomeri sulfatne kiseline, sa zwitterionom (desno)
-
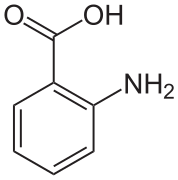
Antranilna kiselina
-
Struktura H4EDTA
Sulfatna kiselina kristalizira u formu hermafroditnog iona.[5]
U kristalima antranilne kiseline postoje dvije molekule u jediničnoj ćeliji. Jedna molekula je u cviterionskom obliku, druga nije.[6] U čvrstom stanju, H4EDTA je ion sa dva protona koja su prebačena iz karboksilnih kiselina u atome dušika.[7]
Teorijske studije
[uredi | uredi izvor]
Iako se ravnoteža između spoja i njegovog dvojnog izomera ne može eksperimentalno proučiti, iz rezultata teorijskih izračuna može se steći određeni uvid. Dobar primjer je piridoks-fosfat, oblik vitamina B6. Predviđeno je da se tautomerna ravnoteža dobije u vodenoj otopini ovog spoja, favorizirajući zwitterion u kojem se proton prenosi iz fenolne -OH grupe u atom dušika.[8]
Betaini i slični spojevi
[uredi | uredi izvor]Spoj trimetilglicin, koji je izoliran iz šećerne repe, nazvan je "betainom" (po nazivu njenog roda, Beta). Kasnije su otkrivena i drugi spojevi koji sadrže isti strukturni motiv, kvaternarni atom dušika sa karboksilatnom grupom povezanom sa –CH2 vezom. U današnje vrijeme, svi spojevi čija struktura uključuje ovaj motiv poznati su kao betaini. Betaini se ne izomeriziraju, jer hemijske grupe vezane za atom dušika nisu labilne. Ovi spojevi mogu se klasificirati kao trajni cviterioni, jer ne dolazi do izomerizacije molekula bez električnog naboja ili je vrlo sporo.[9]
Ostali primjeri stalnih cviteriona uključuju fosfatidilholine i psilocibin, koji također sadrže kvarternarni atom dušika, ali s negativno nabijenom fosfatnom skupinom umjesto karboksilatne grupe i plućni surfikant je takav kao dipalmitoilfosfatidilholin.
-
Trimetilglicin (trivijalni naziv betaina)
-
Primjer fosfatidilholina
-
Lauramidopropil-betain, glavna komponenta kokamidopropil betaina
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ Skoog, Douglas, A.; West, Donald M.; Holler, F. James; Crouch, Stanley R. (2004). Fundamentals of Analytical Chemistry (8th izd.). Thomson/Brooks/Cole. str. 231, 385, 419, 460. ISBN 0-03-035523-0. 9th edition (20113), pp 415-416, ISBN 9781285607191
- ^ Jensen, Jan H.; Gordon, Mark S. (1995). "On the Number of Water Molecules Necessary To Stabilize the Glycine Zwitterion". J. Am. Chem. Soc. 117 (31): 8159–8170. doi:10.1021/ja00136a013.
- ^ Jönsson, P.-G.; Kvick, Å. (1972). "Precision neutron diffraction structure determination of protein and nucleic acid components. III. The crystal and molecular structure of the amino acid α-glycine" (PDF). Acta Crystallographica Section B. 28 (6): 1827–1833. doi:10.1107/S0567740872005096. Arhivirano s originala (PDF), 14. 3. 2020. Pristupljeno 29. 4. 2020.
- ^ Price, William D.; Jockusch, Rebecca A.; Williams, Evan R. (1997). "Is Arginine a Zwitterion in the Gas Phase?". Journal of the American Chemical Society. 119 (49): 11988–11989. doi:10.1021/ja9711627. PMC 1364450. PMID 16479267.
- ^ R. L. Sass (april 1960). "A neutron diffraction study on the crystal structure of sulfamic acid". Acta Crystallogr. 13 (4): 320–324. doi:10.1107/S0365110X60000789.
- ^ Brown, C.J; Ehrenberg, M. (1985). "Anthranilic acid, C7H7NO2, by neutron diffraction". Acta Cryst. C41: 441–443. doi:10.1107/S0108270185004206.
- ^ Cotrait, Par Michel (1972). "La structure cristalline de l'acide éthylènediamine tétraacétique, EDTA". Acta Crystallographica Section B. 28: 781–785. doi:10.1107/S056774087200319X.
- ^ Kiruba, G. S. M.; Ming, Wah Wong (2003). "Tautomeric Equilibria of Pyridoxal-5'-phosphate and 3-Hydroxypyridine Derivatives: A Theoretical Study of Solvation Effects". J. Org. Chem. 68 (7): 2874–2881. doi:10.1021/jo0266792.
- ^ Nelson, D. L.; Cox, M. M. Lehninger, Principles of Biochemistry 3rd Ed. Worth Publishing: New York, 2000. ISBN 1-57259-153-6




![{\displaystyle K={\frac {[H_{3}N^{+}(R)CO_{2}^{-}]}{[H_{2}N(R)CO_{2}H]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/018c5122fee4f8c30ac282f8d86927e47099cf90)