Tubulin
| Tubulin | |
|---|---|
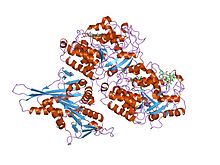 kif1a glava strukture mikrotubulskog kompleksa u atp-formi | |
| Identifikatori | |
| Simbol | Tubulin |
Tubulin je naziv koji se može odnositi na tubulinsku proteinsku superfamiliju globulskih proteina ili samo na člana superfamilije. α- i β-tubulin se polimerizira u mikrotubule, glavne komponente eukariotskog citoskeleta.[1][2][3][4][5]
Mikrotubules djeluju u mnogim ključnim ćelijskim procesima, ukljućujući i ćelijske diobe. Lijekovi koji se vežu za tubulin ubijaju kancerozne ćelije putem inhibicije dinamike mikrotubula, koje su potrebne za segregaciju hromosoma i DNK i stoga ćelijsku diobu.
Za tubulin se dugo mislilo da je specifičan za eukariote. Međutim, pokazalo se da nekoliko prokariotskih proteina ispoljava srodnost sa tubulinom.[6][7][8][9]
Karakterizacija[uredi | uredi izvor]
Tubulin je okarakteriziran evolucijski konzerviranom porodicom tubulin/FtsZ , GTPaznim proteinskim domenom.
Ovaj GTPazni domen je nađen u svim eukariotskim tubulinskim lancima,[10] kao i kod bakterijskih proteina TubZ, proteina CetZ u Archaea i FtsZ porodice proteina, koja je široko rasprostranjena kod bakterija i Archaea.[6][11]
Funkcija[uredi | uredi izvor]
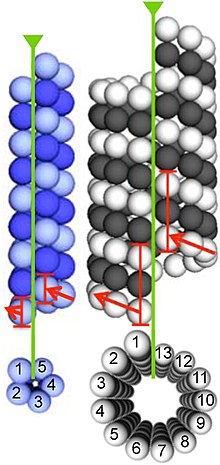
Lijevo: BtubA - tamno plava; BtubB: svijetlo-plava i 13-protofilamentne eukariotske mikrotubule
Desno: α-tubulin – bijel; β-tubulin – crn ). Šavovi i start-heliksi su osjenčeni zelenom i crvenom.[12]
Mikrotubule[uredi | uredi izvor]
α- i β-tubulin se polimeriziraju u dinamičke mikrotubule. Kod eukariota, mikrotubule su jedna od glavnih komponenti citoskeleta i funkcioniraju u mnogim procesima, uključujući i strukturnu potporu, unutarćelijskog transporta i segregaciju DNK. Mikrotubule su sastavljene od proteinskih dimera α- i β-tubulina. Ove podjedinice su blago kisele, sa izoelektričnom tačkom između 5,2 and 5,8.[13] Svaki ima molekulsku masu od približno 50.000 Daltona.[14] Za nastanak mikrotubula, dimeri α- i β-tubulina se vežu za Guanotin trifosfat (GTP) i sastavljaju (+) završetke mikrotubula, dok su u stanju GTP-vezanosti.[15] Podjedinica β-tubulina je izložena na plus kraju mikrotubule, dok je posjedinica α-tubulina na minus kraju. Nakon ugradnje dimera u mikrotubule, molekule GTP se vežu za β-tubulinsku podjedinicu i eventualno se subunit hidroliziraju u GDP preko inter-dimernih kontakata duž mikrotubulskog protofilamenta.[16] Činjenica da li će β-tubulin koji je član tubulinskog dimera biti vezan za GTP ili BDP-a, utiče na stabilnost dimera u mikrotubuli. Dimeri koji su vezani za GTP imaju tendenciju da se okupe u mikrotubule, dok su dimeri vezani za BDP-a skloniji raspadanju. Dakle, ovaj GTP ciklus je od suštinskog značaja za dinamičku nestabilnost mikrotubule.
Reference[uredi | uredi izvor]
- ^ Sofradžija A., Šoljan D., Hadžiselimović R. (2004). Biologija 1. Svjetlost, Sarajevo. ISBN 9958-10-686-8.CS1 održavanje: više imena: authors list (link)
- ^ Međedović S., Maslić E., Hadžiselimović R. (2002). Biologija 2. Svjetlost, Sarajevo. ISBN 9958-10-222-6.CS1 održavanje: više imena: authors list (link)
- ^ Alberts B.; et al. (2002). Molecular Biology of the Cell, 4th Ed. Garland Science. ISBN 0-8153-4072-9. Eksplicitna upotreba et al. u:
|author=(pomoć) - ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Eds. (2005). Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB) Sarajevo. ISBN 9958-9344-1-8.CS1 održavanje: više imena: authors list (link)
- ^ Kapur Pojskić L. (2014). Uvod u genetičko inženjerstvo i biotehnologiju, 2. izdanje. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo. ISBN 978-9958-9344-8-3.
- ^ a b Nogales E, Downing KH, Amos LA, Löwe J (1998). "Tubulin and FtsZ form a distinct family of GTPases". Nat. Struct. Biol. 5 (6): 451–8. doi:10.1038/nsb0698-451. PMID 9628483.CS1 održavanje: upotreba parametra authors (link)
- ^ Jenkins C, Samudrala R, Anderson I, Hedlund BP, Petroni G, Michailova N, Pinel N, Overbeek R, Rosati G, Staley JT (2002). "Genes for the cytoskeletal protein tubulin in the bacterial genus Prosthecobacter". Proceedings of the National Academy of Sciences of the United States of America. 99 (26): 17049–54. doi:10.1073/pnas.012516899. PMC 139267. PMID 12486237.CS1 održavanje: upotreba parametra authors (link)
- ^ Yutin N, Koonin EV (2012). "Archaeal origin of tubulin". Biology Direct. 7: 10. doi:10.1186/1745-6150-7-10. PMC 3349469. PMID 22458654.CS1 održavanje: upotreba parametra authors (link)
- ^ Larsen RA, Cusumano C, Fujioka A, Lim-Fong G, Patterson P, Pogliano J (2007). "Treadmilling of a prokaryotic tubulin-like protein, TubZ, required for plasmid stability in Bacillus thuringiensis". Genes & Development. 21 (11): 1340–52. doi:10.1101/gad.1546107. PMC 1877747. PMID 17510284.CS1 održavanje: upotreba parametra authors (link)
- ^ Nogales E, Wolf SG, Downing KH (1998). "Structure of the alpha beta tubulin dimer by electron crystallography". Nature. 391 (6663): 199–203. Bibcode:1998Natur.391..199N. doi:10.1038/34465. PMID 9428769.CS1 održavanje: upotreba parametra authors (link)
- ^ Löwe J, Amos LA (1998). "Crystal structure of the bacterial cell-division protein FtsZ". Nature. 391 (6663): 203–6. Bibcode:1998Natur.391..203L. doi:10.1038/34472. PMID 9428770.CS1 održavanje: upotreba parametra authors (link)
- ^ Pilhofer, Martin; Ladinsky, Mark S.; McDowall, Alasdair W.; Petroni, Giulio; Jensen, Grant J. (1. 12. 2011). "Microtubules in bacteria: Ancient tubulins build a five-protofilament homolog of the eukaryotic cytoskeleton". PLoS biology. 9 (12): e1001213. doi:10.1371/journal.pbio.1001213. ISSN 1545-7885. PMC 3232192. PMID 22162949.
- ^ Williams RC, Shah C, Sackett D (1999). "Separation of tubulin isoforms by isoelectric focusing in immobilized pH gradient gels". Anal. Biochem. 275 (2): 265–7. doi:10.1006/abio.1999.4326. PMID 10552916.CS1 održavanje: upotreba parametra authors (link)
- ^ "tubulin in Protein sequences". EMBL-EBI.
- ^ Heald R, Nogales E (2002). "Microtubule dynamics". J. Cell. Sci. 115 (Pt 1): 3–4. PMID 11801717.CS1 održavanje: upotreba parametra authors (link)
- ^ Howard J, Hyman AA (2003). "Dynamics and mechanics of the microtubule plus end". Nature. 422 (6933): 753–8. Bibcode:2003Natur.422..753H. doi:10.1038/nature01600. PMID 12700769.CS1 održavanje: upotreba parametra authors (link)
