Sumporasta kiselina
| Sumporasta kiselina | |
|---|---|
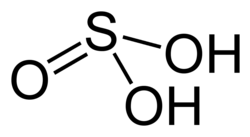  | |
| Općenito | |
| Hemijski spoj | Sumporasta kiselina |
| Druga imena | Sumporna(IV) kiselina IUPAC ime: Sulfurna kiselina |
| Molekularna formula | H2SO3 |
| CAS registarski broj | 7782-99-2 |
| SMILES | O[S+](O)[O-] |
| InChI | 1/H2O3S/c1-4(2)3/h(H2,1,2,3) |
| Osobine1 | |
| Molarna masa | 82,07 g/mol |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Sumoprasta kiselina, poznata i kao sumporna(IV) kiselina) je spoj sa hemijskom formulom H2SO3. Nema dokaza da sumporasta kiselina postoji u rastvoru, ali molekula je otkrivena u plinskoj fazi.[1] Konjugirane baze ove isparljive kiseline su, međutim, uobičajeni anioni, bisulfiti (ili vodik-sulfiti) i sulfiti. Sumporasta kiselina je međuvrsta u nastanku kisele kiše iz sumpor-dioksida.[2]
Ramanovi spektri rastvora sumpor-dioksida u vodi pokazuju samo signale zbog molekule SO2 i bisulfitnog iona, HSO−
3. Intenziteti signala su u skladu sa sljedećom ravnotežom:
- SO2 + H2O <=> HSO−
3 + H+ Ka = 1.54×10−2; pKa = 1,81.
- SO2 + H2O <=> HSO−
17O NMR spektroskopija pružila je dokaze da rastvori sumporaste kiseline i protoniranih sulfita sadrže smesu izomera koja je u ravnoteži:[3]
- [H–OSO2]− ⇌ [H–SO3]−
Prilikom pokušaja koncentriranja rastvora isparavanjem da bi se dobila bezvodna sumporastaa kiselina, ona će se razgraditi (preokrećući reakciju formiranja). U hlađenju klatrat SO2·5+3⁄4H2O će kristalizirati jer se ponovo raspada na 7 °C. Tako se sumporasta kiselina H2SO3 ne može izolirati.
Upotreba[uredi | uredi izvor]
Vodene otopine sumpor-dioksida, koje se ponekad nazivaju sumporasta kiselina, koriste se kao redukcijsko sredstvo i kao dezinficijensi, kao i rastvori bisulfitnih i sulfitnih soli. Oni se oksidiraju do sumporne kiseline ili sulfata, prihvatanjem drugog atoma kisika.[4]
Također pogledajte[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ D. Sülzle; M. Verhoeven; J. K. Terlouw; H. Schwarz (1988). "Generation and Characterization of Sulfurous Acid (H2SO3) and of Its Radical Cation as Stable Species in the Gas Phase". Angew. Chem. Int. Ed. Engl. 27 (11): 1533–4. doi:10.1002/anie.198815331.
- ^ McQuarrie; Rock (1987). General Chemistry (2nd izd.). New York: W.H. Freeman and Company. str. 243. ISBN 0-7167-1806-5.
- ^ Catherine E. Housecroft; Alan G. Sharpe (2008). "Chapter 16: The group 16 elements". Inorganic Chemistry, 3rd Edition. Pearson. str. 520. ISBN 978-0-13-175553-6.
- ^ L. Kolditz, Anorganische Chemie , VEB Deutscher Verlag der Wissenschaften, Berlin 1983, S. 476.
