Sumpor-dioksid
Ovaj članak ili neki od njegovih odlomaka nije dovoljno potkrijepljen izvorima (literatura, veb-sajtovi ili drugi izvori). |
| Sumpor dioksid | |
|---|---|
 | |
| Općenito | |
| Hemijski spoj | Sumpor dioksid |
| Druga imena | Sumpor (IV) oksid |
| Molekularna formula | SO2 |
| CAS registarski broj | 7446-09-5 |
| Kratki opis | bezbojni gas |
| Osobine1 | |
| Molarna masa | 64,054 g mol−1 |
| Agregatno stanje | gasovito |
| Gustoća | 2,551 g/L |
| Tačka topljenja | −72.4 °C (200.75 K) |
| Tačka ključanja | −10 °C (263 K) |
| Rastvorljivost | 9.4 g/100 mL (25 °C) |
| Dipolni moment | 1.63 D |
| Rizičnost | |
| NFPA 704 | |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Sumpor dioksid ili sumpor (IV) oksid je spoj u kojem sumpor ima oksidacijsko stanje (+4). On je glavni produkt kod izgaranja sumpora u fosilnim gorivima i predstavlja okolinski problem. U okolinu dospijeva i iz vulkana i industrijskim procesima. Sumpor dioksid se u atmosferi može i dalje oksidirati do oksidacijskog stanja (+6) uz dušik-dioksid kao katalizator, pri čemu nastaje sumporna kiselina, odnosno kisele kiše.
Dobijanje[uredi | uredi izvor]
Sumpor dioksid se dobija izgaranjem sumpora s kisikom iz zraka:
- S + O2 → SO2
ili prženjem sulfidnih ruda, obično pirita:
- 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Osobine[uredi | uredi izvor]
Pri običnoj temperaturi sumpor dioksid je gas, ali se može lahko ukapljiti, zbog postojanja dipola u strukturi molekule.
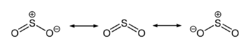
Sumpor dioksid ima neugodan miris i otrovan je za niže organizme, pa se upotrebljava za sterilizaciju suhog voća. U vinu služi kao antioksidans i antibiotik. Osim što sprječava njegovo kvarenje, služi i za održavanje odgovarajuće kiselosti. Sumpor dioksid ima redukciono djelovanje, jer može lahko preći u više oksidacijsko stanje. Ova osobina omogućava njegovo korištenje kao izbjeljivač. Sa vodom daje sulfitnu kiselinu, koja nije poznata u čistom stanju i postoji samo u vodenom rastvoru:
- SO2 + H2O → H2SO3
To je slaba kiselina i daje soli sulfite i hidrogensulfite. I sulfitna kiselina kao i sumpor dioksid ima redukciono djelovanje.
Također pogledajte[uredi | uredi izvor]
| Commons ima datoteke na temu: Sumpor-dioksid |


