Razlika između verzija stranice "Egzotermna reakcija"
| [nepregledana izmjena] | [nepregledana izmjena] |
Crazy&confused premjestio je stranicu Egzotermna reakcija na Egzotermni proces: Greška - mea culpa oznaka: novo preusmjerenje |
Uklonjeno preusmjerenje na Egzotermni proces oznaka: uklonjeno preusmjerenje |
||
| Red 1: | Red 1: | ||
| ⚫ | |||
[[Slika:ThermiteReaction.jpg|thumb| Reakcija [[termitna smjesa|termitne smjese]] je izrazito egzotermna. Redukcija gvožđe (III)-oksida, pomoću [[aluminij]]a oslobađa dovoljno toplote da se dobije rastaljeno gvožđe.]] |
|||
'''Egzotermna reakcija''' je ona kod koje je ukupna [[standardna entalpija reakcije |standardna promjena entalpije]] Δ''H''○ negativna.<ref>{{cite web |title=Exothermic reaction |url=https://goldbook.iupac.org/terms/view/E02269 |publisher=IUPAC}}</ref><ref name="IUPAC Recommendations 1996">{{cite journal |doi=10.1351/pac199668010149|title=A glossary of terms used in chemical kinetics, including reaction dynamics (IUPAC Recommendations 1996)|year=1996|last1=Laidler|first1=K. J.|journal=Pure and Applied Chemistry|volume=68|pages=149–192}}</ref> Egzotermne reakcije obično oslobađaju [[toplota|toplotu]] i podrazumijevaju zamjenu slabih veza jačim.<ref>{{cite journal|last1=Galley|first1=William C.|year=2004|title=Exothermic Bond Breaking: A Persistent Misconception|journal=Journal of Chemical Education|volume=81|issue=4|page=523|bibcode=2004JChEd..81..523G|doi=10.1021/ed081p523}}</ref><ref name="SchmidtRohr2015">{{cite journal|last1=Schmidt-Rohr|first1=Klaus|year=2015|title=Why Combustions Are Always Exothermic, Yielding About 418 kJ per Mole of O2|journal=Journal of Chemical Education|volume=92|issue=12|pages=2094–2099|bibcode=2015JChEd..92.2094S|doi=10.1021/acs.jchemed.5b00333|doi-access=free}}</ref> Termin se često miješa sa [[egzergonična reakcija]], što IUPAC definira kao "... reakcija za koju ukupna standardna Gibbsova promjena energije Δ''G''○ je negativna<ref name="IUPAC Recommendations 1996"/> Snažno egzotermna reakcija obično će biti i egzergonska jer Δ''H''○ daje glavni doprinos [[ΔG °|Δ''G''○]]. Većina spektakularnih hemijskih reakcija koje se pokazuju u učionicama su egzotermne i egzergonične. Suprotna je [[endotermna reakcija]], koja obično uzima toplotu i pokreće se [[entlapija|entropijskim]] povećanjem sistema. |
|||
== Primjeri == |
|||
Primjeri su brojni: [[sagorijevanje]], [[termitna reakcija]], kombiniranje [[jake kiseline|jakih kiselina]] i [[baza (hemija)|baza]], [[polimerizacija]]. Kao primjer u svakodnevnom životu, [[grijač šake]] korist oksidaciju gvožđaa da bi se postigla egzotermna reakcija: |
|||
:4Fe  + 3O<sub>2</sub>  → 2Fe<sub>2</sub>O<sub>3</sub>  Δ''H''○ = –1648 kJ/mol |
|||
Posebno važna klasa egzotermnih reakcija je sagorijevanje ugljikovodičnog goriva, npr. izgaranje prirodnog [[plin]]a: |
|||
:<chem>CH4 + 2O2 -> CO2 + 2H2O</chem> Δ''H''○ = - 890 kJ/mol |
|||
[[Slika:15. Ослободување на големо количество енергија при согоровуање етанол.webm|thumb| Video egzotermne reakcije. Etanolna para se zapali unutar boce, uzrokujući [[sagorijevanje]].]] |
|||
U ovim primjerima većina oslobođene energije pohranjena je u O<sub>2</sub>, u njegovoj relativno slaboj dvostrukoj vezi.<ref name = "SchmidtRohr2015"/> Većina hemijskih reakcija uključuje i razbijanje postojećih i stvaranje novih, jačih hemijskih veza. Kada se atomi spoje kako bi stvorili nove, stabilnije hemijske veze, elektrostatske sile koje ih okupljaju napuštaju vezu, s velikim viškom energije (obično u obliku vibracija i rotacija). Ako se ta energija ne rasipa, nova veza brzo bi se ponovo raspala. Umjesto toga, nova veza može odbaciti višak energije – zračenjem, prenošenjem na druge pokrete u molekuli ili na druge molekule, sudarima – i tako postati stabilna nova veza. Ovaj višak energije je toplota koja napušta molekulski sistem. |
|||
, |
|||
Nekontrolirane egzotermne reakcije, one koje dovode do požara i eksplozija, rasipne su jer je teško uhvatiti oslobođenu energiju. Priroda djeluje na reakcije sagorijevanja pod visoko kontroliranim uvjetima, izbjegavajući požare i eksplozije, uz [[aerobno disanje]], tako da uhvati oslobođenu energiju, npr. za formiranje [[Adenozin trifosfat |ATP]]. |
|||
== Mjerenje == |
|||
[[Entalpija]] hemijskog sistema u osnovi je njegova energija. Promjena entalpije Δ''H '' za reakciju jednaka je toploti ''q'', koja se prenosi iz (ili u) zatvoreni sistem pod konstantnim pritiskom, bez ulazne ili izlazne električne energije. Proizvodnja ili apsorpcija toplote u hemijskoj reakciji mjeri se pomoću [[kalorimetrija|kalorimetrije]], npr. sa [[kalorimetar|kalorimetarskom bombom]]. Jedan od uobičajenih laboratorijskih instrumenata je [[reakcijski kalorimetar]], gdje se prati protok toplote iz ili u reakcijsku posudu. Osiguranje toplote i odgovarajuća promjena energije, mogu se posebno precizno izmjeriti Δ {{var | H}} reakcije [[sagorijevanje|sagorijevanja]]. |
|||
Izmjerena toplotna energija, oslobođena u egzotermnoj reakciji pretvara se u Δ''H''○ u [[džul po molovima]] (ranije [[kalorija|kal/mol]]). Promjena entalpije '' [[Standardno stanje | standardnog stanja]] '''Δ''H''○, u osnovi je promjena entalpije kada se [[stehiometrija | stehiometrijski]] koeficijenti u reakciji smatraju količinama reaktanata i proizvoda (u krticama); obično se pretpostavlja da su početna i konačna temperatura 25 °C. Za reakcije u plinskoj fazi, vrijednosti Δ''H''○ povezane su s [[energija veze | energijom veze]] do dobre aproksimacije pomoću: |
|||
: Δ {{var | H}} ○ = ukupna energija veze reaktanata – ukupna energija veze. |
|||
[[Slika:ac com.svg|300px|thumb|right| [[Energetski profil]] egzotermne reakcije]] |
|||
U egzotermnoj reakciji, po definiciji, promjena entalpije ima negativnu vrijednost: |
|||
: Δ {{var | H}} = ''H''<sub proizvodi</sub> –''H''<sub>reaktant</sub> <0 |
|||
pri čemu se veća vrijednost (veća energija reaktanata) oduzima od manje vrijednosti (manja energija proizvoda). Naprimjer, kada gori vodik: |
|||
:2H<sub>2</sub> (g) + O<sub>2</sub> (g) → 2H<sub>2</sub>O (g) |
|||
:Δ{{var|H}}○ = − 483.6 kJ/mol <ref>{{cite web |url=http://chemistry.osu.edu/~woodward/ch121/ch5_enthalpy.htm |title=Archived copy |accessdate=2013-07-20 |url-status=dead |archiveurl=https://web.archive.org/web/20130708030319/http://chemistry.osu.edu/~woodward/ch121/ch5_enthalpy.htm |archivedate=2013-07-08 }}</ref> |
|||
==Također pogledajte== |
|||
*[[Hemijska termodinamika]] |
|||
*[[Diferencijalna skenirajuća kalorimetrija]] |
|||
| ⚫ | |||
*[[Homeotermija]] |
|||
*[[Endotermni proces]] |
|||
*[[Endotermija]] |
|||
== Reference == |
|||
{{reflist}} |
|||
==Vanjski linkovi== |
|||
{{Portal|Hemija}} |
|||
{{commonscat|Exotermic reaction}} |
|||
[[Kategorija:Termohemija]] |
|||
[[Kategorija: Termodinamika]] |
|||
Verzija na dan 2 novembar 2020 u 11:19

Egzotermna reakcija je ona kod koje je ukupna standardna promjena entalpije ΔH○ negativna.[1][2] Egzotermne reakcije obično oslobađaju toplotu i podrazumijevaju zamjenu slabih veza jačim.[3][4] Termin se često miješa sa egzergonična reakcija, što IUPAC definira kao "... reakcija za koju ukupna standardna Gibbsova promjena energije ΔG○ je negativna[2] Snažno egzotermna reakcija obično će biti i egzergonska jer ΔH○ daje glavni doprinos ΔG○. Većina spektakularnih hemijskih reakcija koje se pokazuju u učionicama su egzotermne i egzergonične. Suprotna je endotermna reakcija, koja obično uzima toplotu i pokreće se entropijskim povećanjem sistema.
Primjeri
Primjeri su brojni: sagorijevanje, termitna reakcija, kombiniranje jakih kiselina i baza, polimerizacija. Kao primjer u svakodnevnom životu, grijač šake korist oksidaciju gvožđaa da bi se postigla egzotermna reakcija:
- 4Fe + 3O2 → 2Fe2O3 ΔH○ = –1648 kJ/mol
Posebno važna klasa egzotermnih reakcija je sagorijevanje ugljikovodičnog goriva, npr. izgaranje prirodnog plina:
- ΔH○ = - 890 kJ/mol
U ovim primjerima većina oslobođene energije pohranjena je u O2, u njegovoj relativno slaboj dvostrukoj vezi.[4] Većina hemijskih reakcija uključuje i razbijanje postojećih i stvaranje novih, jačih hemijskih veza. Kada se atomi spoje kako bi stvorili nove, stabilnije hemijske veze, elektrostatske sile koje ih okupljaju napuštaju vezu, s velikim viškom energije (obično u obliku vibracija i rotacija). Ako se ta energija ne rasipa, nova veza brzo bi se ponovo raspala. Umjesto toga, nova veza može odbaciti višak energije – zračenjem, prenošenjem na druge pokrete u molekuli ili na druge molekule, sudarima – i tako postati stabilna nova veza. Ovaj višak energije je toplota koja napušta molekulski sistem. , Nekontrolirane egzotermne reakcije, one koje dovode do požara i eksplozija, rasipne su jer je teško uhvatiti oslobođenu energiju. Priroda djeluje na reakcije sagorijevanja pod visoko kontroliranim uvjetima, izbjegavajući požare i eksplozije, uz aerobno disanje, tako da uhvati oslobođenu energiju, npr. za formiranje ATP.
Mjerenje
Entalpija hemijskog sistema u osnovi je njegova energija. Promjena entalpije ΔH za reakciju jednaka je toploti q, koja se prenosi iz (ili u) zatvoreni sistem pod konstantnim pritiskom, bez ulazne ili izlazne električne energije. Proizvodnja ili apsorpcija toplote u hemijskoj reakciji mjeri se pomoću kalorimetrije, npr. sa kalorimetarskom bombom. Jedan od uobičajenih laboratorijskih instrumenata je reakcijski kalorimetar, gdje se prati protok toplote iz ili u reakcijsku posudu. Osiguranje toplote i odgovarajuća promjena energije, mogu se posebno precizno izmjeriti Δ H reakcije sagorijevanja.
Izmjerena toplotna energija, oslobođena u egzotermnoj reakciji pretvara se u ΔH○ u džul po molovima (ranije kal/mol). Promjena entalpije standardnog stanja 'ΔH○, u osnovi je promjena entalpije kada se stehiometrijski koeficijenti u reakciji smatraju količinama reaktanata i proizvoda (u krticama); obično se pretpostavlja da su početna i konačna temperatura 25 °C. Za reakcije u plinskoj fazi, vrijednosti ΔH○ povezane su s energijom veze do dobre aproksimacije pomoću:
- Δ H ○ = ukupna energija veze reaktanata – ukupna energija veze.
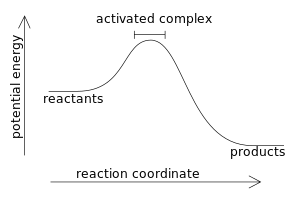
U egzotermnoj reakciji, po definiciji, promjena entalpije ima negativnu vrijednost:
- Δ H = H<sub proizvodi –Hreaktant <0
pri čemu se veća vrijednost (veća energija reaktanata) oduzima od manje vrijednosti (manja energija proizvoda). Naprimjer, kada gori vodik:
- 2H2 (g) + O2 (g) → 2H2O (g)
- ΔH○ = − 483.6 kJ/mol [5]
Također pogledajte
- Hemijska termodinamika
- Diferencijalna skenirajuća kalorimetrija
- Egzotermni proces
- Homeotermija
- Endotermni proces
- Endotermija
Reference
- ^ "Exothermic reaction". IUPAC.
- ^ a b Laidler, K. J. (1996). "A glossary of terms used in chemical kinetics, including reaction dynamics (IUPAC Recommendations 1996)". Pure and Applied Chemistry. 68: 149–192. doi:10.1351/pac199668010149.
- ^ Galley, William C. (2004). "Exothermic Bond Breaking: A Persistent Misconception". Journal of Chemical Education. 81 (4): 523. Bibcode:2004JChEd..81..523G. doi:10.1021/ed081p523.
- ^ a b Schmidt-Rohr, Klaus (2015). "Why Combustions Are Always Exothermic, Yielding About 418 kJ per Mole of O2". Journal of Chemical Education. 92 (12): 2094–2099. Bibcode:2015JChEd..92.2094S. doi:10.1021/acs.jchemed.5b00333.
- ^ "Archived copy". Arhivirano s originala, 2013-07-08. Pristupljeno 2013-07-20. CS1 održavanje: nepreporučeni parametar (link) CS1 održavanje: arhivirana kopija u naslovu (link)
Vanjski linkovi
| Commons ima datoteke na temu: Egzotermna reakcija |


