Jačina kiseline
Kiselinska snaga ili jačina kiseline odnosi se na tendenciju kiseline, koja je simbolizirana hemijskom formulom HA, da disocira u proton H+ i anion A−. disocijacija jake kiseline u rastvoru je učinkovito potpuna, osim u većini koncentriranih otopina.
- HA → H+ + A−
Primjeri jakih kiselina su hlorovodonična (HCl), perhlorna (HClO4) dušična (HNO3) i sumporna kiselina (H2SO4).
Slaba kiselina se dijelom disocira, pri čemu su i nedisocirana kiselina i njeni produkti disocijacije prisutni u rastvoru, u ravnoteži jedni s drugima.
Primjer slabe kiseline je acetatna (CH3COOH) . Snaga slabe kiseline kvantificira se njenom konstantom disocijacije, vrijednošću pKa. Jačina slabe organske kiseline može zavisiti od dijelova supstituenta. Jačina anorganske kiseline ovisi o oksidacijskom stanju atoma na koji se proton može vezati. Jačina kiseline ovisi o rastvaraču. Naprimjer, hlorovodonik je jaka kiselina u vodenoj otopini, ali je slaba kada se rastvara u lednoj acetatnoj kiselini.
Mjere kiselinske jačine
[uredi | uredi izvor]Uobičajena mjera jačine kiseline je konstanta disocijacije kiseline (Ka), koja može biti eksperimentalno određena metodima titracije. Jake kiseline imaju veću Ka i manju logaritamsku konstantu (pKa = −log Ka) nego slabe. Što je jača kiselina, lakše gubi proton H+. Dva ključna faktora koja doprinose lahkoći deprotoniranja su polarnost veze H-A i veličina atoma A, koji određuju snagu H-A veze. Jačina također ovisi o stabilnosti konjugacijske baze.
Dok vrijednost pKa mjeri tendenciju kiselinskog rastvarača za prenošenje protona u standardni rastvarač (najčešće vodu ili DMSO), tendencija rastvarača za prijenos protona na referentni rastvor (najčešće slabu bazu anilin) mjeri se njegovom Hammettovom funkcijom kiselosti, vrijednosti H0. Iako ova dva koncepta jačine kiseline često predstavljaju istu opću tendenciju tvari da doniraju proton, vrijednosti pKa i "H"0 su mjere različitih svojstava i mogu se povremeno razlikovati. Naprimjer, fluorovodik, rastvoren u vodi (pKa = 3,2) ili DMSO (pKa = 15) ima vrijednost pKa koja upućuju na to da se podvrgava nepotpunoj disocijaciji u tim rastvaračima, što ga čini slabom kiselinom. Međutim, kako krajnje osušen, fluorovodik ima vrijednost H0 od –15,[1] što ga čini snažnijim protonirajućim sredstvom od 100% sumporne kiseline i, prema tome, po definiciji, superkiseline.[2](Kako bi se spriječila dvosmislenost, u ostatku ovog članka, jaka kiselina će se, osim ako nije drugačije navedeno, odnositi na kiselinu koja je jaka mjerena njene vrijednošću pKa (pKa<–1,74). Ova upotreba je u skladu sa uobičajenim jezikom većine praktičara u hemiji.)
Kada je riječ o kiselim medijima, razrijeđena vodena otopina, H0 je približno jednaka pH vrijednosti, što je negativan logaritam koncentracije vodenog H+ u rastvoru. Vrijednost pH jednostavnog rastvora kiseline u vodi određuje se i Ka i koncentracijom kiseline. Za rastvore slabih kiselina ovisi o stupanju disocijacije koji se može odrediti proračunom ravnoteže. Za koncentrirane rastvore kiselina, posebno jakih, za koje je vrijednost pH <0, H0 je bolje mjerilo kiselosti od pH.
Jake kiseline
[uredi | uredi izvor]
Jaka kiselina je ona koja disocira prema reakciji:
- HA +
pri čemu S predstavlja molekulu rastvarača, poput molekule vode ili DMSO, do te mjere da je koncentracija neodvojive vrste HA preniska da bi se mogla mjeriti. Za praktične svrhe može se reći da je jaka kiselina potpuno disocirana. Primjer jake kiseline je hlorovodonična kiselina
- HCl → H+ + Cl− (u vodenom rastvoru).
Svaka kislina sa vrijednošću pKa koja je manja od oko –2, klasificira se kao jaka kiselina. To je rezultat vrlo visokog puferskog kapaciteta rastvora sa pH vrijednošću od 1 ili nižim i poznat je kao efekt izravnavanja.[3]
Slijede jake kiseline u vodenom i dimetil sulfoksidnoom rastvoru. Vrijednosti pKa, ne mogu se eksperimentalno mjeriti. Podaci u sljedećoj tabeli prosječne su vrijednosti od čak 8 različitih teorijskih izračuna.
Procijenjena vrijednost pKa[4] Kiselina Formula U vodi U DMSO Hlorovodonična kiselina HCl –5,9 ± 0,4 −2,0 ± 0,6 Bromovodična kiselina HBr –8,8 ± 0,8 −6,8 ± 0,8 Hidroeodinska kiselina HI –9,5 ± 1 −10,9 ± 1 Trifilna kiselina H [CF 3SO3] −14 ± 2 −14 ± 2 Perhlorna kiselina H [ClO <4] −15 ± 2 −15 ± 2
Također u vodi:
- Dušična kiselina HNO3 pKa = –1,6 [5]
- Sumporna kiselina H2SO4 (samo prva disocijacija, pKa1 ≈ −3)
Sljedeće se mogu koristiti kao protonatori u organskoj hemiji:
- Fluoroantimonska kiselina H[SbF6]
- Magična kiselina H[FSO3SbF5]
- Karboranska superkiselina H [CHB11Cl11]
- Fluorosulfatna kiselina H [FSO3] (pKa = −6,4)
Sulfonska kiselina, poput p-toluensulfonske kiseline (tozilna kiselina) su klasa jakih organskih oksikiselina.[6] Neke sulfonske kiseline mogu se izolirati kao krute tvari. Polistiren funkcionaliziran u polistiren sulfonat primjer je tvari koja je čvrsta jaka kiselina.
Slabe kiseline
[uredi | uredi izvor]
Slaba kiselina je supstanca koja se djelimično disocira kad se otopi u rastvaraču. U rastvoru postoji ravnoteža između kiseline HA i produkta disocijacije
Rastvarač (npr. voda) se izostavlja iz ovog izraza kada je njegova koncentracija djelotvorno nepromijenjena postupkom disocijacije kiseline. Jačina slabe kiseline može se kvantificirati u konstanta disocijacije, Ka, definirana kako slijedi, gdje [X] označava koncentraciju hemijskog dijela, X.
Kada je poznata numerička vrijednost Ka pomoću nje se može odrediti stupanj disocijacije u rastvoru s datom koncentracijom kiseline , TH, primjenom zakona zvanog konzervacija mase.
gdje TH = analitička koncentracija kiseline. Kada se sve količine u ovoj jednadžbi tretiraju kao brojevi, ionski naboji se ne prikazuju i to postaje kvadratna jednačina u vrijednosti koncentracije vodikovih iona, [H]:
Ova jednadžba pokazuje da pH rastvora slabe kiseline zavisi i od vrijednosti njene Ka < i od njene koncentracije. Tipski primeri slabih kiselina uključuju acetatnu i fosfornu kiselinu. Za kiselinu kao što je oksalna (HOOC–COOH) se kaže da je dvobazna jer može izgubiti dva protona i reagirati s dvije molekule jednostavne baze. Fosforna kiselina (H3PO4) je tribazna.
Za strožiji tretman jačine kiseline pogledajte konstanta disocijacije kiseline. To uključuje kiseline kao što je dvobazna kiselina jantarna kiselina, za koje se ne može koristiti jednostavni, gore prikazani, metod izračunavanja pH rastvora.
Činitelji kiselinske jačine
[uredi | uredi izvor]Indukcijski efekt
[uredi | uredi izvor]U organskim karboksilnim kiselinama, elektronegativni supstituent može povući gustoću elektrona iz kisele veze kroz indukcijski efekt, što rezultira manjom vrijednošću pKa . Učinak se smanjuje, dalje je elektronegativni element iz karboksilatne grupe, što ilustrira sljedeća serija halogeniranih butanoičnih kiselina .
| Struktura | Ime | pKa |
|---|---|---|
 |
2-hlorobutanoična kiselina | 2,86 |
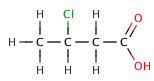 |
3-hlorobutanoična kiselina | 4,0 |
 |
4-hlorobutanoična kiselina | 4,5 |
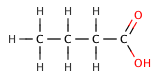 |
Butanoična kiselina | 4,5 |
Efekt oksidacijskog stanja
[uredi | uredi izvor]U skupu oksokiselina vrijednosti pKa elementa smanjuju se sa njegovim oksidacijskim stanjem.
| Struktura | Imeme | Oksidacijsko stanje |
pKa |
|---|---|---|---|
 |
Perhlorna kiselina | 7 | –8† |
 |
Hlorna kiselina | 5 | –1 |
| Hlorovodonična kiselina | 3 | 2,0 | |
 |
Hipohlorna kiselina | 1 | 7,53 |
† teorijski
Reference
[uredi | uredi izvor]- ^ Liang, Joan-Nan Jack (1976). The Hammett Acidity Function for Hydrofluoric Acid and some related Superacid Systems (Ph.D. Thesis) (PDF). Hamilton, Ontario: McMaster University. str. 94.
- ^ Miessler G.L. and Tarr D.A. Inorganic Chemistry (2nd ed., Prentice-Hall 1998, p.170) ISBN 0-13-841891-8
- ^ Porterfield, William W. Inorganic Chemistry (Addison-Wesley 1984) p.260 ISBN 0-201-05660-7
- ^ Trummal, Aleksander; Lipping, Lauri; Kaljurand, Ivari; Koppel, Ilmar A.; Leito, Ivo (2016). "Acidity of strong acids in water and dimethyl sulfoxide". J. Phys. Chem. A. 120 (20): 3663–3669. Bibcode:2016JPCA..120.3663T. doi:10.1021/acs.jpca.6b02253. PMID 27115918.
- ^ Bell, R. P. (1973), The Proton in Chemistry (2nd izd.), Ithaca, NY: Cornell University Press
- ^ Guthrie, J.P. (1978). "Hydrolysis of esters of oxy acids: pKa values for strong acids". Can. J. Chem. 56 (17): 2342–2354. doi:10.1139/v78-385.
Vanjski linkovi
[uredi | uredi izvor]- Titration of acids - freeware for data analysis and simulation of potentiometric titration curves



![{\displaystyle K_{a}={\frac {[H^{+}][A^{-}]}{[HA]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/83ee86c6746a584bd7b209324db405b0563af917)
![{\displaystyle {\begin{aligned}T_{H}&=[H]+[HA]\\&=[H]+[A][H]/K_{a}\\&=[H]+[H]^{2}/K_{a}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2d1d8921a76226cabb40caf4153fb742226ac0b6)
![{\displaystyle [H]^{2}/K_{a}+[H]-T_{H}=0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/20510aaf9a0ccaa6aa4bec6e7f9f6eb7222e8db9)