Interakcija protein-protein

Kontakti između dva proteina su prikazani kao obojene mrlje.
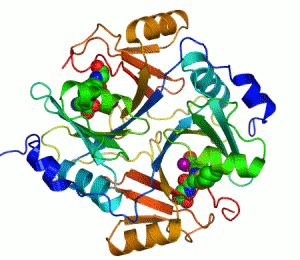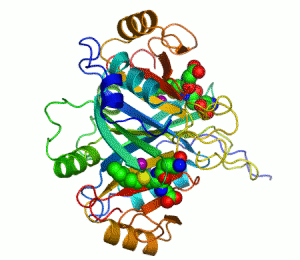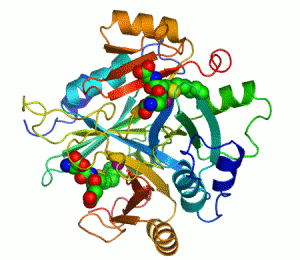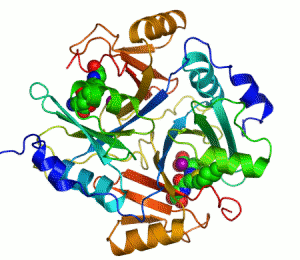
Dva iona cinka koji su potrebni za funkciju enzima, prikazani su kao ljubičaste kuglice.
Inhibitor enzima S-heksiglutation je prikazan kao prostorno-popunjavajući modul, u dva aktivna mjesta.
Definicija[uredi | uredi izvor]
Interakcije protein–protein (IPP) se odnose na trajne i specifične fizički uspostavljene kontakte između dva ili više proteina kao rezultata biohemijskih događaja i / ili elektrostatskih sila. Obično se shvataju kao fizički kontakti sa molekulskim priključenjima između proteina koji se javljaju u ćeliji ili u živim organizmima u specifičnim biomolekulskim kontekstima (De Las Rivas J. i Fontanillo C., 2010.).[1]
Način djelovanja[uredi | uredi izvor]
Proteini rijetko djeluju sami. Mnogi molekulski procesi u ćeliji obavljaju molekulski mehanizmi koji se sastoje od velikog broja komponenti proteina u organizaciji njihove IPP. Ove interakcije su važne za interakcijski sistem žive ćelij, a nenormalni IPP su osnova više bolesti, kao što su Creutzfeldt-Jakobova i Alzheimerova bolest i rak.[2][3][4][5][6][7]
IPP su proučavani iz različitih perspektiva, kao što su:biohemije, kvantna hemija, molekulska dinamika, signali, između ostalog.[8] Sve ove informacije omogućuje stvaranje velikih interakcija mrežolike proteinske lično metabolitske ili genetičke / epigenetičke mreže – da osnaži dosadašnja saznanjima o biohemijskim kaskadama i patogenezi bolesti, kao i pružanja novih terapijskih ciljeva.
Primjeri interakcija protein–protein[uredi | uredi izvor]
Signalna transdukcija[uredi | uredi izvor]
Aktivnost ćelije je regulirana vanćelijskim signalima. Signalna propagacija unutra i / ili uz unutrašnjost ćelija ovisi o PPI između različitih signalnih molekula. Ovaj proces, nazvan signalni, ima ključnu ulogu u mnogim biološkim procesima i kod mnogih bolesti (npr Parkinsonova bolest i rak).
Transport kroz membrane[uredi | uredi izvor]
Protein može nositi još jedan protein (naprimjer, iz citoplazme u ćelijsko jedro ili obrnuto, u slučaju mportina jedrovih pora).
Ćelijski metabolizam[uredi | uredi izvor]
U mnogim procesima, biosintetskih enzimi komuniciraju jedni s drugima za proizvodnju malih spojeva ili drugih makromolekula.
Mišićna kontrakcija[uredi | uredi izvor]
Fiziologija mišićne kontrakcije uključuje nekoliko interakcija. Miozinska vlakna djeluju kao molekulski motori i vezivanjem za aktin omogućuju klizanje filamenta. Osim toga, članovi skeletne muskulature, lipidne kapljice povezane sa proteinima porodice sudjelatnika s drugim proteinima, kao aktivator masnog triglicerida lipaze i njegove koactivatorski komparativni identifikacijski-58 gen, za reguliranje lipolize u skeletnim mišićima.[9][10]
Priroda interakcije[uredi | uredi izvor]
Kao što u strukturi proteina dominiraju snage privlačnosti između podjedinica kompleksa proteina koji imaju hidrofobne interakcije, tako djeluju i van der Waalsove sile, vodikove veze i ionske sile između bočnih lanaca u aminokiselinama, koji čine svaki protein.
Metodi istraživanja interakcije protein-protein[uredi | uredi izvor]


Budući da su interakcije proteina toliko važne, postoji mnoštvo metoda njihovog otkri vanja. .[11] Svaki od raspoloživih pristupa ima svoje prednosti i mahane, posebno u pogledu osjetljivosti i specifičnosti metoda. Visoka osjetljivost znači da su mnoge od interakcija koje se javljaju zapravo otkrivene određenim metodom, dok visoku specifičnost ukazuje na to da je većina otkrivenih interakcija stvarno I javljaju, uz nekoliko lažno pozitivnih nalaza.
- Imunoprecipitacija se smatra najboljim testom za otkrivanje interakcija protein-protein, pogotovo kada se izvodi sa endogenim proteinima (prekomjerno eksprimiranim ili označenim). Protein od interesa se izolira prema odgovoru na određena antitijela. Molekule koje u interakciji s proteinima, kao što je ispoljavaju se u testu koji je poznat kao Western blot.
- Dvohibridni test kvasaca istražuje interakcije inventivnih fuzija proteina u jedru kvasca. Ovaj metod može identificirati molekule koje se nedvosmisleno vezuju za dati protein. Međutim, oj metod ima značajnu stopu lažno pozitivnog nalaza, što nalaže potrebu za provjeru interakcije po ko-imuniprecipitacijskom testu.
- Pročišćavanje tandemskog afiniteta (TAP) otkriva interakcija u realnom ćelijskom okruženju (npr. u citosolu sisara). Ovo je velika prednost u odnosu na dvohibridni test. Glavni nedostatak je da je pročišćavanje proteina sa po dva pranja, tako da ne može otkriti prolazne interakcije protein-protein.
- Kvantitativna imuniprecipitacija u kombinaciji sa knok-out laboratorijskim miševima se temelji na komunoprecipitaciji, kvantitativnoj masenoj spektrometriji (SILAC) i RNK interferenciji (RNK interferencija - RNAi). Ovaj metod otkriva interakcija između označenih endogenih proteina, tako da ima istu pouzdanost kao komuniprecipitacijska, ali i ovisi o raspoloživosti odgovarajućih antitijela.
Otkriva interakcije u realnom ćelijskom okruženju (kao u citosolu sisara, npr.). Ovo je velika prednost u odnosu na dvohibridni test. Glavni nedostatak je da je pročišćavanje proteina je po dva pranja, tako da ne može otkriti prolazne interakcije protein-protein.
- Dvojna polarizacijska interferometrija(IPR) se može koristiti za mjerenje interakcije protein-protein. Daje mjere veličine molekula, gustoće i mase, u realnom vremenu i uz visoke rezolucije.
- Matični gelovi (Blue Native: BN-PAGE) metod se zasniva na migraciji proteinskog kompleksa na poliakrilamidnim gelovima u skladu sa svojom molekulskom težinom. Jer migracija je također definirana opterećenjem, a koristi se katodni pufer koji sadrži ‘’Coomassie’’ plavilo, što daje neto negativni naboj na proteine bez denaturacije ili prekidanja interakcije s drugim proteinima. Druga dimenzija u denaturisanju SDS-PAGE gelova je da mogu odvojiti spotove i nakon toga identificirati podjedinice kompleksa komponenti, primjeno masene spektrometrije.[12]
Mreža interakcija protein-protein[uredi | uredi izvor]
Stvaranje vizualnih alata za predstavljanje mreža interakcija između proteina je popularna primjena računarske grafike. Iako su dijagrami interakcije proteina uobičajeni u udžbenicima, nisu, zbog svoje kompleksnosti, tako uobičajeni u istraživačkim dijagramima potpunog predstavljaja mreže interakcija između proteina. Karta kontrole ćelijskog ciklusa, koju je uradio Kurt Kohn (1999) je primjer molekulske interakcije mreže, koja je rađena “ručno.Mol Biol Cell. 1999. Na mapi, Kohn, Schwikowski, Uetz, i Fields (2000) su objavili članak o interakciji protein-protein u kvasca, kombinirajući 1548 proteina određenih dvohibridno, koristeći Sugiyama grafikon crtanja algoritma sa automatskim generiratanjem mrežne slike.Nature 2000. Od tada, razvijeni su drugi sistemi za automatizaciju stvaranja mreže interakcija između proteina, uključujući.
- Osprey
- VisANT
- NAViGaTOR Arhivirano 28. 1. 2016. na Wayback Machine
- Cytoscape To je otvoren softverski alat za kreiranje grafike u molekulskoj interakciji i integraciji sa profilima ekspresije gena i drugim podacima, kod.
- yEd je moćan grafički uređivač. Može koristiti za izgradnju grafikona, a automatski dizajnira različite vrste dijagrama i mreža.
- NetPro
Mnoge od gore prikazanh baza podataka o interakcija između proteina, sadrže alate za pomoć korisnicima upravljanja podacima.
Baze podataka o interakciji proteina[uredi | uredi izvor]
- BioGrid je javni katalog interakcija između proteina i njihove genetike.[13]
- HPRD Human Protein Reference Database Arhivirano 27. 9. 2019. na Wayback Machine
- The MIPS Mammalian Protein-Protein Interaction Database Arhivirano 18. 3. 2017. na Wayback Machine
- IntAct Interaction Database
- APID Agile Protein Interaction DataAnalyzer
- Database of Interacting Proteins Arhivirano 14. 3. 2009. na Wayback Machine,
Također pogledajte[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ De Las Rivas, J; Fotanillo, C. (2010). "Protein-protein interactions essentials: key concepts to building and analyzing interactome networks". PLoS Comput Biol. 6 (6): e1000807. doi:10.1371/journal.pcbi.1000807. PMID 20589078.
- ^ Alberts B. (2002)ː Molecular biology of the cell Garland Science, New York, ISBN 0-8153-3218-1.
- ^ Lindhorst T. (2007): Essentials of carbohydrate chemistry and biochemistry. Wiley-VCH, 3527315284}}
- ^ Robyt F. (1997): Essentials of carbohydrate chemistry. Springer, ISBN 0387949518.
- ^ Voet D., Voet J. (1995): Biochemistry, 2nd Ed. Wiley, http://www.wiley.com/college/math/chem/cg/sales/voet.html.
- ^ Laidler K. J. (1978): Physical chemistry with biological applications. Benjamin/Cummings, Menlo Park, ISBN 0-8053-5680-0.
- ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Ed. (2005): Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-1-8.
- ^ Herce, Henry D.; Deng, Wen; Helma, Jonas; Leonhardt, Heinrich; Cardosoa, M. Cristina (2013). "Visualization and targeted disruption of protein interactions in living cells". Nature Communications. 4: 2660. doi:10.1038/ncomms3660. PMC 3826628. PMID 24154492.
- ^ Cooper, G.M. (2000). The cell : a molecular approach (2nd izd.). Washington DC: ASM Press. ISBN 0-87893-106-6.[potrebna stranica]
- ^ MacPherson, R.E.; Ramos, S.V.; Vandenboom, R.; Roy, B.D.; Peters, S.J. (2013). "Skeletal muscle PLIN proteins, ATGL and CGI-58, interactions at rest and following stimulated contraction". American journal of physiology. Regulatory, integrative and comparative physiology. 304 (8): R644–50. doi:10.1152/ajpregu.00418.2012. PMC 3627954. PMID 23408028.
- ^ Brettner L. M., Masel J. (2012): Protein stickiness, rather than number of functional protein-protein interactions, predicts expression noise and plasticity in yeast. BMC Systems Biology, 6: 128.
- ^ Voet D., Voet J. G. (2005). Biochemistry, 3rd Ed. Wiley. ISBN 978-0-471-19350-0.
- ^ http://thebiogrid.org/%7Ctítulo=thebiogrid.org%7Caño=2013%7Cfechaacceso=31[mrtav link].
Vanjski linkovi[uredi | uredi izvor]
- https://web.archive.org/web/20070911065858/http://www.chem.upenn.edu/chem/research/faculty.php?browse=V.
- Protéines et enzymes.
- http://www.pnas.org/cgi/content/abstract/105/19/6959?etoc Arhivirano 21. 2. 2021. na Wayback Machine, Estimating the size
- Stark C, Breitkreutz BJ, Reguly T, Boucher L, Breitkreutz A, Tyers M (January 2006). "BioGRID: a general repository for interaction datasets". Nucleic Acids Research. 34 (Database issue): D535–9. doi:10.1093/nar/gkj109. PMC 1347471. PMID 16381927.CS1 održavanje: više imena: authors list (link)
- http://www.chemdiv.com/portfolio/library-of-modulator-of-protein-protein-interactions-ppi/ Arhivirano 29. 5. 2014. na Wayback Machine
- Proteins and Enzymes na Curlie
- Casado-Vela, Juan; Matthiesen, Rune; Sellés, Susana; Naranjo, José (2013). "Protein-Protein Interactions: Gene Acronym Redundancies and Current Limitations Precluding Automated Data Integration". Proteomes. 1 (1): 3–24. doi:10.3390/proteomes1010003.
- http://www.mdpi.com/.
