Genetika
| Dio članaka o |
| Genetici |
|---|
 |
| Ključne komponente |
| Historija i teme |
| Istraživanje |
| Personalizovana medicina |
| Personalizovana medicina |



Genetika (starogrčki: γενετικός – generičkô, γένεσις = porijeklo) biološka je nauka o genima i promjenljivosti živih bića u prostoru i vremenu, o nasljednim osnovama života i njegovog biodiverziteta – od prvih reproducibilnih molekula – do savremenih i budućih oblika života.[1][2][3][4][5][6][7][8][9] Osnivač savremene genetike je austrijski botaničar, matematičar i biolog Gregor Mendel (1822-84).
Gregor Mendel, je krajem 19. stoljeća istraživao osobinu nasljedstva, tj. obrasce na koji se način osobine roditelja javljaju i potomstvu. Primijetio je da organizmi (biljke graška) naslijeđuju osobine putem diskretnih jedinica nasljeđivanja ili nasljednih faktora. Ovaj termin se čak i danas koristi, iako je nejasna definicija onoga što se naziva gen.
Nasljedive fenotipske osobine i molekulski mehanizmi nasljeđivanja gena su i dalje u fokusu genetike 21. stoljeća, ali je moderna genetika proširena i na proučavanje funkcije i ponašanja gena. Struktura, funkcija, varijacija i distribucija gena se proučava u svjetlu ćelijske biologije, molekulske razine i u kontekstu genetike populacija. Višestran i interdisciplinaran razvoj genetike je doveo do pojave niza njenih grana, o kojima se u početnim fazama razvoja klasične genetike nije moglo ni naslućivati. Jedna od njih je i epigenetika, koja je bila definirana još polovinom 20. stoljeća, ali (čini se zbog nevjerice) svoj procvat doživljava tek početkom 21. Uključivanjem molekulskih genetičkih markera novu ekspanziju ostvaruje i populacijska genetika posebno u razvoju mjera genetičke distance. U ova i ostala istraživanja uključuju se organizmi svih oblika života, od bakterija, preko gljiva i biljaka do životinja i čovjeka.
Genetičke pojave i procesi se proučavaju u kombinaciji s faktorima životnog okruženja i iskustva, koji značajno utiču na razvoj i ponašanje organizma. Intra- ili ekstra-ćelijsko okruženje organizma može uticati i na transkripciju, uključivanje i isključivanje određenih gena, odnosno tajming njihove funkcije tokom ontogeneze. Klasičan primjer je dvije sjemenke genetički identičnih kukuruza, kada se jedna biljka uzgaja u umjerenoj klimi, a druga u sušnoj. Iako prosječna visina stabljike ova dva kukuruza može biti genetički određena da budu jednaki, onaj u sušnim klimatima raste samo na pola visine onog u umjerenoj klimi, zbog nedostatka vode i hranjivih tvari u svom okruženju. Slično se dešava i s kloniranim biljkama koje rastu u tako različitim uvjetima ili čak različitim nadmorskim visinama.
Nedavno, 19. marta 2015, genetičari su pozvali na zabranu širom svijeta nekih istraživačkih metoda, posebno tzv. Crispr-Cas9 i cinkov prst postupaka, koji se koriste za promjene ljudskog genoma, jer u takvim postupcima mogu nastati nasljedne promjene. Tako je razvoj genetike dospio u fazu kada njen napredak treba da usmjeravaju i zakonska i etička načela.
Historija genetike
[uredi | uredi izvor]Rezultati Mendelovih istraživanja su onovremenoj naučnoj javnosti ostali nepoznati sve do 1900, kada su ih "ponovo otkrili" ugledni genetičari onoga doba: Carl Correns, Erich von Tschermak i Hugo de Vries i označili kao Mendelova pravila. Po tome je i početna faza razvoja genetike označena kao mendelizam. To ponovno otkriće označava početak burne akceleracije razvoja ove biološke nauke.[10]
Hronologija najznačajnijih otkrića i događaja
[uredi | uredi izvor]- 1859 – Charles Darwin objavljuje Porijeklo vrsta putem prirodnog odabiranja
- 1865 – Gregor Mendel objavljuje Eksperimenti u hibridizaciji biljaka
- 1900 – Ponovo otkriće Mendelovog rada i afirmacija značenja njegovih rezultata (Tschermak, Korens i De Vries)
- 1903 – Otkriće hromosoma
- 1905 – Britanski biolog William Bateson prvi put upotrebljuje pojam genetika
- 1910 – Thomas Hunt Morgan potvrđuje lokaciju gena na hromosomima
- 1913 – Alfred Sturtevant pravi prvu gensku (genetičku) mapu hromosoma
- 1918 – Ronald A. Fisher objavljuje rad pod nazivom Korelacija između pripadnika iste familije na osnovu Mendelovskog nasljeđivanja
- 1913 – Genske mape pokazuju linearni raspored gena na hromosomima
- 1927 – Fizičke promjene u genima se zovu mutacije
- 1928 – Frederick Griffit otkriva nasljednu molekulu koja se prenosi sa bakterije na bakteriju
- 1931 – Crossing ower je posljedica rekombinacije
- 1941 – Edward Lawrie Tatum i George Wells Beadle potvrđuju da geni nose kodove za sintezu preoteina
- 1944 – Oswald Avery, Colin MacLeod i Maclyn McCarty prvi izoliraju molekule DNK
- 1950 – Erwin Chargraff pokazuje da generalni zakoni stabiliziraju brojni odnos purinskih i pirimidinskih nukleotida (adenina je skoro uvijek jednak broju timina, a citozina broju guanina)
- 1952 – Alfred D. Hershey i Martha Chase Hershey-Chase metodom eksperimentalno potvrđuju da se genetička informacija bakteriofaga nalazu u molekulu DNK.
- 1953 – James Devey Watson i Francis H. C. Crick dokazuju dvojno-spiralnu strukturu DNK
- 1956 – Joe Hin Tjio i Albert Levan dokazuju da ljudi u somatskim (ćelijama imaju 46 hromosoma
- 1958 – Matthew Meselson i Franklin Stahl eksperimentalno demonstriraju semikonzervativnu replikacij DNK
- 1961 – Genetički kod se sastoji od tripleta; svaki kod ima po tri jedinice ("slova"), a svaka od njih kodira samo po jednu aminokiselinu. Više kodova može imati isti smisao - kodiranje iste aminokiseline
- 1964 – Howard M. Temin na RNK virusima demonstrira da Watsonova centralna dogma nije uvažila činjenicu da se virusa genetička informacija može dolaziti i u RNK molekuli, a ne samo u DNK.
- 1970 – Otkriveni restrikcijski enzimi, u studijama na bakteriji Haemophilius influenzae. Oni su omogućili isijecanje ciljanih segmenata DNK i njihovo intraspecijsko i transspecijsko inkorporiranje druge dijelove ili molekule.
- 1977 – Frederick Sanger svojom originalnom metodom utvrđuje DNK sekvencu bakteriofaga E. coli poznatog pod nazivom Ø X174 (koji sadrži 5 375 nukleotida). Nezavisno od njega, po istom principu, Walter Gilbert i Alan Maxam razvili su svoj metod hemijske degradacije (Chemical degradation method - Maksam-Gilbertova metoda).
- 1983 – Kary Banks Mullis otkriva polimerizovanu lančanu reakciju (PCR) koja omogućava jednostavnu amplifikaciju DNK molekula
- 1989 – Utvrđena sekvenca prvog ljudskog gena Francisa Collinsa i Lap-Chi-Cuija; gen kodira CFTR protein, koji uzrokuje cističu fibrozu
- 1995 – Utvrđena sekvenca genoma Haemophilus influenza, što je bio prvi uspjeh u sekvenciranju cjelokupnog genoma nekog živog organizma
- 1996 – Sekvenciran genom Saccharomyces cerevisiae - prvog eukariotskog genoma koji je sekvenciran
- 1998 – Sekvenciran prvi multicelularni eukariotski genom
- 2001 – Objavljena prva verzija sekvence ljudskog genoma
- 2003 (14. april) – Uspješno okončan "Human Genom Project" (Projekat Ljudski Genom); sekvencirano 99% ukupnog genoma, uz grešku od 0,01%.
Klasična genetika
[uredi | uredi izvor]Klasična genetika (formalna genetika) oblast je genetike koja proučava pojave i modele nasljeđivanja individualnih svojstava, na osnovu eksperimentalne ili posmatrane distribucije fenotipova u potomstvu mogućih roditeljskih parova. Istražuje tokove gena kroz sukcesivne generacije živih bića i citogenetičke osnove njihove međugeneracijske distribucije.[12][14]
Iako je formalna (klasična) genetika najstarija oblast nauke o biološkom nasljeđivanju, njeni rezultati imaju fundamentalno mjesto i u modernoj genetici. Značajni rezultati istraživanja u ovoj oblasti su postignuti i prije Mendelovih eksperimenata i imenovanja gena i genetike.
Mendelovi zakoni
[uredi | uredi izvor]
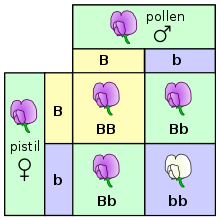
Ove zakone je formulirao 1865. godine Gregor Mendel, a tiču se raspodjele gena i osobina u tri sukcesivne generacije monohibridnog i dihibridnog ukrštanja različitih sorti baštenskog graška (latinski: Pisum sativum). Roditeljska generacija je označena s P (parentalna), a dvije potomačke s F–1 (prva filijalna) i F–2 (druga filijalna).
Izvorna su tri Mendelova zakona:
- Zakon uniformnosti prve filijalne generacije,
- Zakon segregacije gena u drugoj filijalnoj generaciji, i
- Zakon nezavisnog kombiniranja gena.
Molekulska genetika
[uredi | uredi izvor]Iako se za znalo da se geni nalaze na hromosomima i da se hromosomi sastoje od proteina i DNK, dugo se nije znalo koja je od ovih supstanci odgovorna za nasljeđivanje. Godine 1928, Frederick Griffith je otkrio fenomen transformacije, uočivši da su mrtve bakterije mogle prenijeti genetički materijal na transformirane druge žive bakterije Diplococcus pneumoniae. Šesnaest godina kasnije, 1944. godine, Avery, MacLeod i McCarty su identificirali DNK kao molekulu koja je odgovorna za takvu transformaciju. U Hershey-Chasevom eksperimentu, 1952. godine potvrđeno je da je DNK (umjesto proteina) genetički materijal virusa koji inficiraju bakterije. Također je potvrđeno da je DNK molekula odgovorna za prenošenje genetičke informacije.
Hemijsku strukturu i molekulsku konfiguraciju DNK su odredili James Watson i Francis Crick, 1953. Polazište im je bio kristalografski rad sa X-zračenjem Rosalind Franklin i Mauricea Wilkinsa koji je indicirao da DNK ima helikoidnu, tj. dvostruko spiralnu strukturu.[15] Njihov model dvostrukog heliksa je imao dva lanca nukleotida s međusobnim vezama između komplementarnih nukleotida, koji se spiralno uvrću.[16][17] Ova struktura je sugerirala da se genetička informacija nalazi u sekvencama nukleotida na svakom lancu nukleotida, tj. polulancu DNK. Ona je predviđala i jednostavan način replikacije ovih makromolekula: kada se polulanci odvoje, svaki od njih, od slobodnih nukleotida u citoplazmi, rekonstruira komplementarni polulanac. Ova pojava je označena kao semikonzervativna priroda procesa u kojem jedan od potomačkih polulanaca DNK potiče od originalnog roditeljskog.
Kada je bilo poznato da struktura DNK kontrolira procese nasljeđivanja, još uvijek nije bilo jasno kako ona utiče na ponašanje ćelija, odnosno na metaboličke tokove. U narednim godinama, naučnici su pokušali shvatiti kako DNK kontrolira proces sinteze proteina.[18][19] Otkriveno je da DNK u ćelijama ustvari ima ulogu matrice za komplementarnu sintezu informacijske RNK, (iRNK) – jednolančanog polinukleotidnog spoja – koji ima veoma sličnu građu. Nukleotidna sekvenca iRNK služi za kreiranje aminokiselinski slijedova u proteinskim lancima. Matrica za prevođenje genetičke informacije s jezika nukleotida na jezik proteina označena je kao genetički kod.
Nakon novootkrivenih molekulskih modela nasljeđivanja došlo je do prave eksplozije istraživanja u svim oblastima osnovne i primijenjene genetike. Jedan od važnijih poticaja tom razvoju je otkriće mehanizma terminacije molekula DNK (Frederick Sanger, 1977. godine). Ova tehnologija je omogućila čitanje sekvence nukleotida molekule DNK. Godine 1983, Kari Banks Mullis je razvio reakciju lančane polimeraze, pružajući brz način izolacije i umnožavanja određenih dijelova DNK iz smjese. Napori Projekta ljudskog genoma, u Odsjek za energetiku, NIH, i paralelni privatni napor kompanije Celera Genomics doveli su do sekvenciranja ljudskog genoma, 2003. godine.
Geni
[uredi | uredi izvor]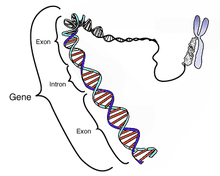
Gen je osnovna materijalna i funkcionalna jedinica genetičkog materijala, odnosno biološkog nasljeđivanja. Čini ga nukleotidna sekvenca koja sadrži genetičku informaciju za sintezu određenog proteina, tj. formiranje određene karakteristike u interakciji sa okolinom. Određeni gen zauzima specifično mjesto na hromosomu – genski lokus. Pojmove fenotip i genotip u nauku je uveo danski botaničar Wilhelm Johannsen (1905), a iz genotipa je izveden gen.[14][20][21][22]
Geni su transkripcijski aktivni dijelovi molekule DNK, veličine od nekoliko stotina do nekoliko hiljada nukleotidnih parova. Prosječna dužina gena obično se kreće između 600 i 1800 parova nukleotida. Procjenjuje se da lanci ljudske DNK u svakoj ćeliji sadrže ukupno oko tri milijarde nukleotidnih parova. Dokazano je da određeni dugi, ponavljajući dijelovi, lanaca DNK svih organizama, pa tako i čovjeka, nisu genetički aktivni (repetitivne sekvence). Pored toga, mnoge cjeline genetičke šifre se ponavljaju u manjem ili većem broju molekula DNK i njihovih dijelova. Sveukupnost organizacije i funkcije ljudskog organizma, uključujući sve ono što je osobeno i za ljudsku vrstu i fantastične razmjere individualne različitosti, određuje oko 30.000 gena, što je oko 2% našeg ukupnog genetičkog potencijala. Paradoks između veličine i složenosti kontrole i organizacije ljudskoga genoma ostvaruje se tzv. alternativnim splajsingom. To je pojava da nekoliko različitih gena (i do 6) zauzima zajednički prostor na DNK molekuli (vidi: Bioinformatika).
Na svakom lancu DNK geni su raspoređeni linearno, tj. u jednolinijskom nizu koji isključuje mogućnost preklapanja njihovih dodirnih dijelova (tripleta). Također, stabilno svojstvo svakog gena jeste da on uvijek zauzima isto mjesto, odnosno isti dio molekule DNK. To stalno fizičko mjesto određenog gena označava se kao genski lokus. Dio DNK (gen) koji zauzima taj lokus može biti istovjetan kod svih pripadnika iste vrste organizama ili se može javiti u dvije ili više varijanti, koje se označavaju kao aleli (alelogeni, alelomorfi).
Struktura i varijacija
[uredi | uredi izvor]Na svakom lancu DNK geni su raspoređeni linearno, tj. u jednolinijskom nizu koji isključuje mogućnost preklapanja njihovih dodirnih dijelova (tripleta). Također, stabilno svojstvo svakog gena jeste da on uvijek zauzima isto mjesto, odnosno isti dio molekule DNK. To stalno fizičko mjesto određenog gena označava se kao genski lokus. Dio DNK (gen) koji zauzima taj lokus može biti istovjetan kod svih pripadnika iste vrste organizama ili se može javiti u dvije ili više varijanti, koje se označavaju kao aleli (alelogeni, alelomorfi).
Aleli nastaju promjenom (mutacijom) određenog ishodišnog oblika odgovarajućeg gena ("divlji tip" gena), koji je obično i najčešći. Aleli se međusobno mogu razlikovati samo po jednom ili više parova azotnih baza (ili tripleta), od čega zavise obim i priroda njihovih funkcionalnih razlika. Ako posmatrani gen ima samo dvije varijante, riječ je o alelnom paru, dok se tri ili više varijanti istog gena označavaju kao multipli aleli. Bez obzira da li se javlja u jednom, dva ili više alelnih oblika, jedan gen uvijek kontrolira istu osobinu ili skupinu osobina u čijem nasljeđivanju učestvuje. Naprimjer, ljudsku osobinu "viđenje crvene boje" kontrolira alelni par s genskog lokusa koji je (redovno) smješten na istoj ("svojoj") poziciji DNK spolnog hromosoma X (a stalan je raspored i njemu susjednih lokusa). Jedan od pripadajućih alela određuje normalnu sposobnost viđenja ove boje, dok je drugi "odgovoran" za odsustvo te sposobnosti ("sljepilo za crvenu boju"). Četiri krvne grupe ABO sistema (A, B, AB i O) genetički kontrolira jedan gen, čiji se lokus uvijek nalazi na lancu DNK onog hromosoma 9. Taj gen se javlja u tri glavne alelne varijante, tj. ovo svojstvo kontroliraju multipli aleli.
Priroda djelovanja
[uredi | uredi izvor]Svaka normalna ljudska jedinka u svojim ćelijama nosi kompletnu genetičku informaciju svoje vrste, dobivenu spajanjem jajne ćelije i spermatozoida. Prema tome, svako od nas za svaku nasljednu osobinu (izuzimajući spolno vezane) nosi po dva alela, od kojih jedan potječe od oca, a drugi od majke. Ako posmatramo jednu osobinu čije ispoljavanje kontroliraju samo dva alelna gena, pa jednog označimo sa A, a drugog sa a, možemo zaključiti da se oni javljaju u tri kombinacije (genotipa): AA, Aa i aa. Budući da AA i aa imaju homogenski sastav, označavaju se kao homozigoti (homo od grč. homois – jednak, isti), dok se heterogenski sastav genotipa Aa imenuje kao heterozigot (grč. heteros – drugi).[11][23]
Općepoznato je da se interakcija alelnih gena manifesuje u fenotipskom ispoljavanju heterozigotnih genotipova. Postoje tri osnovna oblika tog međudejstva: dominantnost–recesivnost, kodominantnost i intermedijarnost.
Veoma je mali broj gena koji učestvuju u kontroli samo jednog svojstva, a izgleda da je još manji broj osobina koje su kontrolirane alelima samo jednog gena. Pojava da jedan gen svojom aktivnošću utječe na formiranje više osobina organizma označava se kao polifenija (plejotropija gena). Kao izrazit primjer takvog djelovanja može poslužiti složeni skup posljedica aktivnosti gena koji je odgovoran za anemiju srpastih eritrocita (drepanocitozu). Primarna osobina koju gen uvjetuje je sinteza (nenormalnog) hemoglobina S, čija pojava ima niz lančanih posljedica u mnogim osobinama: srpasti eritrociti, anemija, poremećaj niza vitalnih funkcija srca, jetre, slezene i koštane srži, mentalnih sposobnosti itd.
Složenost genetičke kontrole nasljednog dijela promjenljivosti može biti veoma različita; od svojstva koja su pod kontrolom samo jednog gena, manjeg broja ili mnoštva gena. Na osnovu toga, sve osobine možemo podijeliti na monogenske (grč. monos – sam, jedan, jedini), oligogenske (grč. oligo – nekoliko) i poligenske (grč. poli – mnogo). monogensko i oligogensko nasljeđivanje su posebno karakteristični za kvalitativne osobine, odnosno nasljednu kontrolu alternirajuće promjenljivosti. Poligensko nasljeđivanje (poligenija) se odnosi na najrašireniju pojavu da se razvoj pojedinih fenotipskih osobina ostvaruje uz sadejstvo većeg broja gena. Takve gene nazivamo poligenima, a osobine koje oni kontroliraju označavaju se kao poligenske. Poligensko nasljeđivanje je karakteristično za kvantitativnu (kontinuiranu) promjenljivost. Osnovni oblik interakcija nealelnih gena|interakcije nealelnih gena u poligenskom skupu je sabiranje (adicija) pojedinačnih, obično malih učinaka svih pripadajući alela u zajednički (zbirni) izraz posmatranog svojstva.[24]
- Fenotip – sva mjerljiva ili uočljiva morfološka i fiziološka svojstva organizma nastala kao rezultat interakcije genotipa i okoline. Svojstvo može biti vidljivo kao npr. ravna kosa ili boja cvijeta dok neka svojstva zahtijevaju provođenje posebnih testova da bi ih identificirali, posebno kada je riječ o biohemijsko-fiziološkim i čulnim svojstvima (npr. krvna slika i određivanje krvnih grupa različitih sistema).
- Genotip – predstavlja sveukupno biološko nasljeđe jedinke. To je skup svih gena nekog organizma. Genotip neke jedinke nije uvijek vidljiv u fenotipu.
Broj gena
[uredi | uredi izvor]
Nakon realizacije Projekta "Humani genom" (Human Genome Project), sekvencioniranje ljudskog i drugih genoma je pokazalo da je broj gena koji kodiraju proteine mnogo manji (~20 000 – čovjek , miš i vinska mušica i ~13 000 – valjkasta glista i 46 000 – riža).[25][26] Ove protein-kodirajuće sekvence čine do 1–2% ljudskog genoma.[27] Veliki dijelovi genoma se transkribiraju u introne, retrotranspozone i naizgled veliki niz nekodirajućih molekula RNK.Ukupni broj proteina (Zemaljski proteom) je procijenjen na oko 5 miliona sekvenci.[28][29] Interakcija gena podrazumijeva međudejstvo dva ili više gena u realizaciji sinteze jednog i/ili više strukturnih ili enzimskih proteina. Priroda te interakcije bitno zavisi od broja involviranih gena i funkcionalnih relacija među njihovim alelima. Metodološki razlozi sugeriraju potrebu distinkcije dva oblika ovog pojma: interakcija alelnih gena i interakcija nealelnih gena.
Interakcija gena
[uredi | uredi izvor]Interakcija alelnih gena
[uredi | uredi izvor]Interakcija alelnih gena (alela, alelogena) ispoljava se u tri osnovna oblika.[30][31][32][33][34]

P = Parentalna (roditeljska) generacija
F1 i F2 = Prva i druga filijalna (potomačka) generacija
- Dominantnost – recesivnost (A1 > A2) rezultira pojavom da heterozigoti (A1A2) imaju istovjetan fenotip kao i dominantni homozigoti (A1A1), odnosno da se fenotipski ispoljava funkcija samo jednog – dominantnog alela (A1), dok su fenotipski efekti drugog (A2) u recesiji (prikriveni), tj. nezamjetljivi. Mogući fenotipski efekti recesivnog alela su "maskirani" i ispoljavaju se samo u njegovom homozigotnom stanju (A2A2). Pritom je ovaj oblik interakcije najčešće posljedica djelimičnog ili potpunog gubitka sposobnosti recesivnog alela da kodiranje sinteze specifičnog produkta dovede do njenog finalnog oblika (koji je karakterističan za funkciju izvornog – "divljeg tipa" alela).
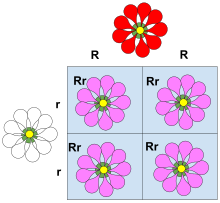
- Kodominantnost (A<>A) osobena je varijacija kodominacije dvaju alela nad trećim. Manifestira u pojavi da su heterozigotne jedinke istovremeno obilježene produktima oba prisutna alela; specifična supstanca koju kodira svaki od njih strukturno je istovjetna u oba moguća genotipa.
- Intermedijarnost (Nekompletna dominantnost) (A1→←A2) ispoljava se u takvoj alternativnoj fenotipskoj varijanti koja ne odražava funkciju nijednog od prisutnih alela, tj. u pojavi osobenog "međufenotipa" – međuprodukta A1 i A2. Najčešće je posljedica nepotpune dominantnosti odgovarajućeg alela.
- Penetrabilnost i ekspresivnost su fenomeni koji uveliko otežavaju pouzdanu detekciju prirode interakcije alelnih gena.
- Penetrabilnost (probojnost) određenog gena izražava se kao relativna učestalost individua istog genotipa u čijem se fenotipu ispoljava njegova funkcija. Zapaženo je, naime, da se prisustvo odgovarajućeg alela u individualnom genotipu (ponekad) ne ispoljava u fenotipu svih pripadajućih individua.
- Ekspresivnost (izražajnost) prisutnog alelogena je izraz i mjera intenziteta njegovog fenotipskog ispoljavanja, koji, ponekad, može varirati u veoma širokom rasponu.[35]
Interakcija nealelnih gena
[uredi | uredi izvor]Nealelni geni je pojam koji podrazumijeva mnoge oblike sudejstva alela različitih gena, tj. onih alelogenena koji se ne javljaju na istom genskom lokusu. Ovaj termin se najčešće upotrebljava u distinkciji interakcije gena, budući da u ispoljavanju promatrane fenotipske oznake mogu učestvovati aleli jednog ili cijele galaksije gena (lokusa).
Priroda interakcije nealelnih gena bitno ovisi o prirodi varijacije svojstva koje diraju, tj. da li se radi o kvalitativnim ili kvantitativnim svojstvima.Interakcija nealelnih gena obuhvata veoma široku lepezu različitih oblika sudjelovanja genetičkih determinatora sa dva ili (mnogo) više genskih lokusa u formiranju pojedinih kvalitativnih i kvantitativnih fenotipskih svojstava.[36][37]
Kvalitativna svojstva
[uredi | uredi izvor]U kontroli heritabilnog dijela kvalitativne individualne varijecije, interakcija nealelnih gena se ispoljava u nekoliko osobenih oblika, kao što su: koakcija, epistaza–hipostaza, komplementacija, inhibicija i sl.

- Koakcija (izvorno poznatija kao interakcija – jedan od ranih primjera interakcije nealelnih gena – u užem smislu pojma) odnosi se na fenomene u kojima geni sa dva ili više lokusa kontroliraju formiranje istog svojstva. Registrira se na osnovu nezavisnog razdvajanja gena u F2 generaciji potomaka dvostrukih homozigota. Pritom je jedan roditelj dominantni homozigot po prvom, a recesivan po drugom lokusu, dok je drugi recesivni homozigot po prvom, a dominantni po drugom. Tada se u F2 generaciji javljaju četiri fenotipa u omjeru koji je svojstven ishodu dihibridnog ukrštanja: 9 (AB) : 3 (Ab) : 3 (aB) : 1 (ab), pri čemu se posljednji – sa relativnom frekvencijom od 1/16 – nije pojavljivao ni u roditeljskom (P) ni u F1 pokoljenju.
- Epistaza – hipostaza je vid interakcije nealelnih gena u kojem dominantni alel jednog lokusa ima snažniju ekspresiju od dominantnog alela drugog gena. Ispoljeni gen je pritom epistatičan, u odnosu na "maskirani" hipostatični gen sa drugog lokusa. Tako, npr., jedna od važećih hipoteza o prirodi nasljeđivanja boje kose počiva na mogućnosti da je ona određena genima sa dva lokusa. Jedan od njih je odgovoran za produkciju tamnog pigmenta (melanina), a drugi za sintezu crvenog pigmenta (karotena). Kada se u individualnom genotipu na oba lokusa istovremeno pojave dominantni aleli (za visoku produkciju odgovarajućih pigmenata), efekti gena za sintezu crvenog pigmenta bivaju potpuno prikriveni tamnim melaninom. Međutim, u kombinacijama sa alelima koji sa odgovarajućeg lokusa kreiraju manje intenzivne nijanse tamnog pigmenta, produkti gena za sintezu crvenog pigmenta postaju vidljivi u osebujnim ekspresijama relacija sa tamnom bojom, učestvujući u komponiranju: kestenjasto–crvenkastih, zlatastoplavih, zlatastocrvenih, jarkocrvenih i drugih tonova riđe kose.
- Komplementacija predstavlja genetički fenomen koji zavisi od pune i nadopunjavajuće funkcije dva ili više produktivnih alela (sa dva ili više genskih lokusa). Jedan od primjera ovog oblika interakcije nealelnih gena manifestira se u sintezi imunoglobulina, čija molekula nastaje integracijom polipeptidnih (lakih i teških) lanaca, kodiranih sa dva nezavisna genska lokusa.
- Adicija podrazumijeva sumiranje pojedinačnih fenotipskih efekata nealelnih gena određenog genotipa. Tako se, npr., pretpostavlja da, u izvjesnim konstelacijama, produkti viralnih (v–onc) i ćelijskih onkogena imaju zajedničke (zbirne) kancerogene efekte.
- Duplikacija je sumiranje (udvostručavanje) fenotipskih efekata nealelnih gena koji se javljaju u dvije kopije (duplikanata), a učestvuju u determinaciji istog svojstva. Npr., hemoglobini su građeni od nekoliko lanaca: α, β, γ i δ, koji su vjerovatno nastali jedni od drugih. Lanci β i δ, a vjerovatno i γ su blisko vezani, što sugerira porijeklo "tandemske" duplikacije. Moguće da je translokacija razdvojila izvorno susjedne dupikante s obzirom da geni koji kodiraju α i β lance nisu vezani.
- Supresija je oblik interakcije nealelnih gena koji se očituje u odsustvu fenotipske ekspresije alela određenog genskog lokusa, uslijed djelovanja alela nekog drugog lokusa. Tako su, npr. tumor–supresorsorski geni uključeni u razvoj nekih familijarnih kancera. Heterozigoti, koji nasljeđuju defekt u po jednoj kopiji svakog gena, imaju mnogo izraženije predispozicije za razvoj različitih formi kancera, što je u mnogim slučajevima posljedica gubitka ili inaktivacije normalnih kopija gena u somatskim ćelijama.
Teorijski gledano, pomenuti oblici i njihove modifikacije, u ovoj kategoriji interakcije nealelnih gena, određuju sljedeće omjere fenotipova u F2 generaciji mogućih reproduktivnih parova:
- recesivna epistaza – 9 (AB) : 3 (Ab) : 4 (3aB) + 1(ab);
- dominantna epistaza (modificirajuća interakcija dominantnog supresora) – 12 (9AB + 3Ab) : 3 (aB) : 1 (ab);
- komplementacija – 9 (AB) : 7 (3Ab + 3aB + 1ab);
- modificirajuća interakcija recesivnog supresora – 13 (9AB + 3Ab + 1ab) : 3 (aB);
- adicija efekata dominantnih gena – 9 (AB) : 6 (3Ab + 3aB) : 1 (ab);
- duplikacija lokusa (uz obostrano prisustvo dominantnih gena) – 15 (9AB + 3Ab + 3aB) : 1 (ab).[21][38]
Kvantitativna svojstva
[uredi | uredi izvor]Fenotipska ekspresija nasljedne komponente ukupne varijacije određenog kvantitativnog svojstva determinirana je djelovanjem više gena (poligena – poligensko nasljeđivanje). Osnovni oblik interakcije nealelnih gena u odgovarajućoj poligenskoj seriji je adicija pojedinačnih – obično malih – efekata alelnih varijanti uključenih lokusa. Ova konstatacija se podjednako odnosi na genetičku kontrolu tipičnih kvantitativnih svojstava kao i na količinske odrednice karaktera u kojima određeni kvantiteti (ili njihove kombinacije) prelaze u (konvencionalne) kvalitete, tj. na tzv. pražna ("threshold") kvalitativna svojstva. Međutim, treba istaknuti da se u svim varijantama svojih aplikacija poligenska teorija bavi nasljednom determinacijom metričkih i merističkih karaktera. U literaturi se relativno često susreću primjeri koji u poligenske osobine svrstavaju sve komponente individualnog fenotipa kontrolirane genetičkim determinatorima sa dva ili više lokusa. Ta činjenica zahtijeva nešto konkretnije razmatranje problema prepokrivanja pojmova (i pojava) oligogenskog i poligenskog nasljeđivanja. Teorijski gledano, poligenska serija može da sadrži od dva lokusa do (gotovo) beskonačno mnogo gena. S druge strane, pod oligogenskim nasljeđivanjem se podrazumijeva pojava genetičke kontrole pojedinih fenotipskih svojstava malim brojem genskih lokusa, uz obavezno prisustvo "major" gena u oligogenskom bloku. Pošto je utjecaj negenetičkih činilaca i "minor" gena iz odgovarajuće serije na fenotipsko ispoljavanje ovakvih osobina gotovo beznačajan, one se obično tretiraju kao monogenske.[22]
(Supra)molekulska organizacija nasljednog materijala
[uredi | uredi izvor]Hromosomi
[uredi | uredi izvor]Molekuli DNK i geni nisu haotično razasuti po protoplazmi, nego su precizno ugrađeni u više organizacione i funkcionalne strukture – hromosome. Skup svih hromosoma jedne ćelije je njena hromosomska garnitura. Stalnost i ponovljivost najbitnijih numeričkih, morfoloških i strukturnih svojstava hromosoma i njihovih garnitura, osnova su funkcionalne cjelovitosti organizma i međugeneracijskih veza organske vrste kojoj pripadaju. Zato se ta i druga stabilna svojstva hromosomske garniture opravdano smatraju "ličnom kartom" svake vrste živih bića. U tom genetičkom "dokumentu" je zapisan ne samo ukupni program njenih bioloških posebnosti, nego i podaci o "osobenim znacima" svake pripadajuće individue. Drugim riječima, sastav hromosomske garniture s obzirom na broj, veličinu, oblik i sadržaj hromosoma, temelj je genetičke posebnosti i prepoznatljiva konstanta ljudske vrste.
Hromosomi (grč. chroma = boja, soma = tijelo) osnovni su i glavni sastojci jedra. Pod svijetlosnim mikroskopom su vidljivi i pojedinačno raspoznatljivi samo u toku ćelijske diobe, posebno ako se oboje određenim prijemčivim bojama (po čemu su i dobili ime). Sadrže oko 15% DNK i oko 70% kratkolančanih proteina (histoni), dok ostatak čini RNK. U kompletnom sastavu (prije ćelijske diobe) svaki hromosom je sastavljen od dvije uzdužno priljubljene hromatide. Uzdužnu osnovu svake hromatide čini hromonema – nukleoproteinska nit, građena od pripadajuće molekule DNK i proteina. Ona je mnogostruko spiralizovana, namotana i izuvijana, što omogućava da u relativno malu zapreminu hromosoma stane na hiljade puta duža molekula DNK. Zahvaljujući tome, sve molekule DNK u jednoj ljudskoj ćeliji ukupne dužine od gotovo 2 m (oko 174 cm), ugrađene su u svega 46 hromosoma. Svaka od dvije "sestrinske" hromatide istog hromosoma sadrži po jednu identičnu kopiju iste molekule DNK nastale u nizu ćelijskih dioba, od začeća (zigota) do odraslog organizma. U toku ćelijske diobe hromatide se razdvajaju i svaka od njih se u novonastalim "kćerima" ponovo udvostručava, kompletirajući tako polazni dvohromatidni sastav hromosoma. U svim narednim ćelijskim diobama opisani ciklus se precizno ponavlja: dvohromatidni hromosom – mitoza – jednohromatidni hromosom – duplikacija – dvohromatidni hromosom. Oblik i veličina svakog hromosoma se mjenjaju tokom ciklusa ćelijske radljivosti, što posebno ovisi o stupnju spiralizacije i kondenzovanosti hromoneme, ali i od svojstava njegovih ostalih organizacionih struktura. Spiraliziranost (izuvijanost) hromosoma se povećava, a njihova dužina opada od interfaze ka metafazi, od koje ka novoj interfazi napreduje proces despiralizacije, odnosno izduživanja. Na osnovu toga, na obojenim preparatima hromosomi se uočavaju kao izuvijane niti (profaza), a mogu biti i štapićasti (metafaza) ili potkovičasti (anafaza). Pored hromoneme, u fizičkoj organizaciji hromosoma pod običnim svjetlosnim mikroskopom može se raspoznati još nekoliko njegovih funkcionalnih dijelova, kao što su: primarno suženje u kojem je centromera sa kinetohorom, sekundarno suženje, satelit (sa drškom), heterohromatin i završni region ili telomera.
Nukleinske kiseline
[uredi | uredi izvor]

Sve poznate pojave i procesi biološkog nasljeđivanja počivaju na osobenostima strukture i funkcije nukleinskih kiselina. To su složene organske tvari velikih lančanih molekula – polimeri (makromolekule) – sastavljene od niza karika (monomera), koje se nazivaju nukleotidi. Molekule nukleinskih kiselina sadrže mnoštvo nukleotida (tj. one su polinukleotidi); u jednom molekulu može ih biti i na desetine hiljada, što nukleinske kiseline svrstava u kategoriju najkrupnijih bioloških makromolekula. Nukleotidi nisu jednostavne građe; svaki od njih se sastoji od tri komponente: dušična baza, pentoza i fosfatna grupa – ostatak fosforne kiseline, nastao njenom ugradnjom u ovaj složeni spoj, dajući mu kiselinski karakter. Prema strukturi nukleotida, odnosno građi i funkciji polimera koje oni tvore, razlikujemo dva osnovna tipa njihovih jedinjenja; to su dezoksiribonukleinska (DNK) i ribonukleinska (RNK) kiselina.[14][20][21][22][37][38][39]
Strukture nukleinskih kiselina
[uredi | uredi izvor]Nukleinske kiseline su složene organske makromolekule koje učestvuju u pohrani, prijenosu i ekspresiji genetičke informacije. To su linearni polimeri koji se sastoje od različitih nukleotida, odnosno monomera. Svaki nukleotid se sastoji od tri komponente:
- dušična baza,
- pentoza (petougljični šećer) i
- fosfatna grupa – ostatak fosforne kiseline, nastao njenom ugradnjom u ovaj složeni spoj, dajući mu kiselinski karakter.[31][32][40]
Nukleotidi su međusobno povezani preko fosfatne grupe. Do uspostavljanja tzv. 3', 5' fosfodiesterske veze dolazi reakcijom kondenzacije hidroksilnih grupa na suprotnim krajevima nukleotida. Sinteza zahtijeva energiju (nukleotidi u reakciju stupaju kao nukleozid-trifosfati) i informaciju (genetski određeni slijed koji čini postojeća molekula DNK). Nukleotidi se prepoznaju po principu uparivanja baza i vežu s obzirom na poredak komplemenata u predlošku.
Prema strukturi nukleotida, odnosno građi i funkciji polimera koje oni tvore, razlikujemo dva osnovna tipa njihovih jedinjenja; to su:
- dezoksiribonukleinska DNK- sadrži petougljični šećer dezoksiribozu, nosilac je genetičke informacije u jedru i reproducibilnim citoplazmatskim strukturama, može da sadrži i do 250 miliona nukleotidnih parova;[41] i
- ribonukleinska RNK kiselina - sadrži petougljični šećer ribozu; učestvuje u transkripciji i translaciji genetičke informacije tokom sinteze proteina; ne sadrži više od nekoliko hiljada nukleotida.[41] Prema specifičnosti svoje funkcije razlikujemo sljedeće tipov RNK molekula:
- iRNK (eng. mRNA, glasnička RNK) – učestvuje u transkripciji genetičkog koda u jedru, prolaskom kroz jedrovu membranu u citoplazmi učestvuje u procesu translacije;
- rRNK (ribosomska RNK) – uz ribosomske proteine predstavljaju gradivne komponente ribosoma, organela na kojima se odvija sinteza proteina (translacija);
- tRNK (transportna RNK) – ima ulogu prijenosnika aminokiselina do ribosoma gdje učestvuje u sintezi polipeptidnih lanaca;
- ostale nekodirajuće RNK (male nekodirajuće RNK – engl. snRNA, mikro RNK - ''miRNK'', male posredničke RNK – engl. siRNA).[24][39][41]
Reprodukcija
[uredi | uredi izvor]Razmnožavanje ili reprodukcija (prokreacija, propagacija) biološki proces je u kojem roditeljske jedinke stvaraju potomstvo. Razmnožavanje je fundamentalno svojstvo sistema koji su poznati kao život. Ukratko, razmnožavanje je jedna od temeljnih diferencijalnih odrednica između žive i nežive supstance. Iako neki kristali također imaju sposobnost umnožavanja, za razliku od njih, živa bića ostvaruju samoobnovljivo i samoregulatorno autonomno potomstvo. Tako ostvaruju međugeneracijski genetički kontinuitet pripadajuće vrste. Svaki pojedinačni organizam postoji kao rezultat razmnožavanja. Postoje dva oblika reprodukcije:
- spolni (seksualni)
- bespolni (aseksualni).[42]
Spolna reprodukcija obično zahtijeva seksualnu interakciju dva organizama ili njihovih gameta. U aseksualnoj reprodukciji, svaki organizam se može razmnožiti i bez učešća drugog organizma. Ovakva reprodukcija nije ograničena samo na jednoćelijskih organizme. I kloniranju organizma je oblik bespolne reprodukcije. Bespolnom reprodukcijom organizam stvara svoje genetički slične ili identične kopije. Spolna reprodukcija je obično praćena spolnom interakcijom dvaju organizama ili gameta iste vrste, po jedan od svakog spola, a za proizvodnju potomačkih organizama čije su genetičke karakteristike izvedene od svojstava oba roditelja.
Svi oblici reprodukcije u suštini počivaju na umnožavanju molekula DNK, što omogićava umnožavanje ćelija i tkiva, razvoj organa i organizama.
Ekspresija gena
[uredi | uredi izvor]
Ekspresija gena je proces kojim se informacija iz gena prepisuje i prevodi u funkcionalni genski produkt. Ovi proizvodi su obično proteini, ali i ne-proteinski kodirajući geni, kao što su tRNK ili snRNK (mala nuklearna RNK), proizvodi su funkcionalne RNK. Proces ekspresije gena je svojstven svim poznatim oblicima života - eukariota (uključujući i višećelijske organizme), prokariota (bakterija i archaea), a koje koriste virus - za generiranje makromolskih sistema za održavanje životnih struktura i funkcija.[40][43]
Nekoliko koraka u procesu genske ekspresije mogu biti modulirani, uključujući i transkripciju, preradu RNK, translaciju i post-modifikaciju proteina.
Regulacija ekspresije gena daje ćeliji mogućnost kontrole nad strukturom i funkcijom, a to je osnova za ćelijsku diferencijaciju, morfogenezu i svestranu prilagodljivost bilo kog organizma.
Genska regulacije može biti i osnova evolucijskih promjene, jer kontrola nad vremenom , mjestom i količinom ekspresije gena može imati dubok utjecaj na funkcije gena u ćeliji ili u višećelijskim organizmima.
U genetici, ekspresija gena je najfundamentalnija razina na kojoj genotip utiče na formiranje fenotipa. Genetički kod iz molekula DNK interpretira se putem genske ekspresije, čije osobenosti, u interakciji sa epigenetičkom i vanjskom sredinom, formiraju individualni fenotip. Takvi fenotipovi su obično izraz sinteze proteina koji kontroliraju građu i funkciju organizma, odnosno djeluju kao njihovi regulatori – enzimi, koji kataliziraju specifične metaboličke puteve karakterizacije organizma.[31][33][34][44]
Prerada RNK, procesuiranje (splicing)
[uredi | uredi izvor]
Prerada RNK, eng. splicing = srastanje (egzona), najznačajnija je post-translacijska modifikacija primarnog transkripta i zrenja iRNK.
Dok transkripcija kodirajućih gena za sintezu prokariotskih proteina ide preko iRNK, transkripcija eukariotskih gena daje primarni transkript RNK (pre-iRNK), koji se mora proći procesuiranje u nizu modifikacija da postane zrela iRNK.
To uključuje 5' "kaptažu", koja je uređena enzimskim reakcijama koje dodaju 7-metilguanozine (m7G) na 5' kraj pre-iRNK i na taj način štite RNK od degradacije putem egzonukleaza. Tako je 7G kaptažni faktor tada vezan u heterodimer (CBC20/CBC80), koji pomaže iRNK ilaz u citoplazmu i štite RNK od dekaptaže
Druga modifikacija je 3 otkrivanje i poliadenilacija. Ako je poliadenilacijski signal (5'AAUAAA-3 ') prisutan u pre-iRNK signal, obično se javljaju između sekvenci proteina i terminatora. Pre-iRNK se prvo rascijepi, a zatim se niz ~ 200 adenina (A) dodaje da formiraju poli (A) rep, koji RNK štiti od degradacije. Poli (A) rep je vezan više za proteine (PABP) neophodne za eksport iRNK i ponovno pokretanje translacije.
Većina eukariotskih pre-iRNK sastoji od naizmjeničnih segmenata zvanih egzoni i introni. U procesu prerade, RNK-protein katalizirajući kompleks poznat kao splajsosom, koji katalizira dvije trans-esterifikacijske reakcije,koe uklanjaju intron i oslobađaju ga u obliku omčaste (laso) strukture, a zatim uvezuju susjedne egzone. U određenim slučajevima, neki introni ili egzoni mogu biti uklonjeni ili zadržani u zrelim iRNK. Ova takozvana alternativna prerada (splicing ) stvara niz različitih transkripata porijeklom iz jednog gena, jer te transkripte potencijalno može prevesti u različite proteine, čime prerada proširuje složenost ekspresije eukariotskih gena.
Regulacija ekspresije gena
[uredi | uredi izvor]Hromosom E. coli se sastoji od kružne molekule DNK (4,7 x 106 bp) koja kodira nekoliko hiljada različitih proteina, od kojih se samo neki sintetiziraju u određenom momentu. Neki proteini bakterijske ćelije su konstitutivni, tj. sintetiziraju se kontinuirano, nezavisno od trenutnih uslova, dok su drugi inducibilni i njihova sinteza je regulisana u skladu s intracelularnom koncentracijom pojedinih metabolita. Bakterije obično žive u vrlo promjenljivim uslovima, tako da enzimi koji su ćeliji potrebni u jednom trenutku ubrzo mogu postati suvišni, a iznenada se može pojaviti potreba za nekim drugim enzimima. Genom bakterija je organizovan tako da omogućuje veliku fleksibilnost u pogledu ekspresije pojedinih gena. Bakterija može da odgovori na promjene uslova veoma brzo, sintezom enzima koji su joj u datom trenutku neophodni, i prestankom sinteze onih za koje trenutno nema supstrata. Skoro kompletna regulacija ekspresije gena kod bakterija se odvija na nivou transkripcije. Geni bakterija su grupisani tako da se jedan do drugog nalaze oni koji kodiraju funkcionalno povezane enzime, najčešće enzime jednog biohemijskog puta. Cijeli set takvih gena sadrži samo jedan promotor i transkribuje se kao jedna transkripciona jedinica, a iRNK je policistronska. Set gena koji predstavlja jednu ekspresionu jedinicu, tj. uključuje strukturne gene i elemente koji kontrolišu njihovu ekspresiju, nazvan je operonom. Takva organizacija genoma omogućuje efikasnu i koordinisanu regulaciju seta gena, interakcijom između regulatornog proteina i zajedničkog promotora. Indukcija sinteze pojedinih enzima je veoma brza (obično traje samo nekoliko minuta) zahvaljujući i tome što su procesi transkripcije i translacije spregnuti. Translacija započinje na 5'-kraju iRNK čija je sinteza još u toku. Bakterijske iRNK su kratkoživeće, degradiraju već 1-3 minute poslije transkripcije čime se izbjegava sinteza onih proteina koji ćeliji više nisu potrebni. Osnovna saznanja o mehanizmima putem kojih se kontroliše aktivnost pojedinih gena u bakterijskim ćelijama pružila su ispitivanja regulacije sinteze inducibilnih enzima.



Regulacija transkripcije laktoznog operona - negativna kontrola
[uredi | uredi izvor]Prvi model regulacije ekspresije gena kod bakterija predložili su Jacob i Monod 1961. godine, na osnovu izučavanja sinteze enzima koji su uključeni u razgradnju laktoze kod bakterije E. coli. U bakterijskom genomu se nalaze tri strukturna gena (lacZ, lacY i lacA ) koji kodiraju glavne enzime za razgradnju laktoze: 0-galaktozidazu (katalizuje razgradnju laktoze do glukoze i gataktoze), P-galaktozid permeazu (omogućava transport laktoze kroz plazma membranu) i P-tiogalaktozid acetil-transferazu (fiziološka uloga joj nije utvrđena). Ova tri gena čine jednu transkripcionu jedinicu, tzv. laktozni operon (lac operon) čiji se promotor (lacP) nalazi uzvodno od gena lacZ. Uzvodno od promotora smješten je regulatorni gen (lac-1) koji predstavlja zasebnu transkripcionu jedinicu (ima svoj promotor) i transkribuje se u monocistronsku iRNK. Ova iRNK kodira protein koji ima ulogu represora transkripcije lac operona.
U toku ispitivanja mehanizma regulacije transkripcije lac operona, izolovan je i prečišćen laktozni represor (lac++ represor) – protein koji se vezuje za niz nukleotida nazvan operator. Ovaj niz sadrži 21 bp i prisutan je u genomu E. coli u samo jednoj kopiji, a lociran je unutar promotorskog regiona lacP. Laktozni represor je tetramer koji ima visok afinitet prema operatoru (lacO). Kada se represor veže za operator, on blokira pristup RNK polimerazi i sprečava transkripciju strukturnih gena vezanih za taj promotor. S druge strane, represor ima i vezivno mjesto za šećer alolaktozu (izomer D-laktoze koji je u ćeliji prisutan onda kada je prisutna i laktoza). Kada koncentracija alolaktoze u bakterijskoj ćeliji dostigne određeni nivo, ona se vezuje za represor, izazivajući njegovu alosteričnu promjenu, usljed koje slabi njegov afinitet prema operatoru, tako da represor disocira sa operatora. Sada je transkripcija gena ponovo omogućena. Ova pojava se naziva derepresija, a ovakav vid kontrole, zasnovan na konformacionoj promjeni represora izazvanoj vezivanjem šećera, je alosterična kontrola. Kao rezultat derepresije, ćelija počinje da sintetiše enzime neophodne za razgradnju laktoze. Kada se razgradi sva prisutna laktoza, a u ćeliju iz okoline ne dospijeva nova, represor se ponovo vezuje za operator i sprečava transkripciju strukturnih gena lac operona. Prema tome, bakterija sintetiše enzime za razgradnju laktoze samo onda kada je laktoza (odnosno alolaktoza) prisutna u ćeliji, a ne i onda kada je nema.
Do sada su poznati mnogi slični primjeri kontrole transkripcije. U svim ovakvim slučajevima, specifičan ligand (kao alolaktoza), koji se naziva induktor, biva prepoznat od strane represora koji imaju visok afinitet prema operatorima. Vezivanje induktora za represor "uključuje" transkripcijsku jedinicu u blizini operatora, slabljenjem veze između represora i operatora. Međutim, poznati su i primjeri kada vezivanje induktora za represor dovodi do takve alosterske promjene represora usljed koje se njegov afinitet prema operatoru povećava, a transkripcijska jedinica ostaje "zaključana". Znači, u nekim slučajevima, kao što je lac operon, povećana koncentracija induktora stimulira, dok u drugim slučajevima inhibira transkripciju gena. lpak, u oba slučaja radi se o istom regulatornom mehanizmu, jer se u oba slučaja transkripcija odvija u odsustvu regulatornog proteina (represora), a ne odvija u njegovom prisustvu. Zato se ovakav tip kontrole naziva negativna kontrola.
Regulacija transkripcije laktoznog operona - pozitivna kontrola
[uredi | uredi izvor]Alternativa negativnoj regulaciji je pozitivna kontrola, tj. regulacija transkripcije aktivatorima. Neke transkripcione jedinice u genomu E. coli imaju relativno slaba mjesta za vezivanje RNK polimeraze (tzv. slabe promotore), pa je vezivanje ovog enzima moguće samo uz pomoć proteina aktivatora koji se vezuju za DNK u neposrednoj blizini RNK polimeraze.
"Jačina", tj. efikasnost promotora zavisi od redoslijeda nukleotida u karakterističnim, evolutivno očuvanim dijelovima promotorskog regiona od kojih se jedan nalazi 10, a drugi 35 nukleotida uzvodno od mjesta na kome počinje transkripcija. Najefikasniji bakterijski promotori na poziciji -10 sadrže niz TATAAT, a na -35 niz TTGACA. Molekula RNK polimeraze se specifično vezuje za niz na poziciji -35, dok onaj na poziciji -10 omogućuje da transkripcija započne na nukleotidu +1. Aktivatori se vezuju za nizove nukleotida koji se nalaze u neposrednoj blizini mjesta za koje se vezuje RNK polimeraza i za razliku od represora, koji onemogućuju vezivanje enzima, aktivatori to vezivanje olakšavaju. Po svemu ostalom, oni veoma liče na represore. Oni se često vezuju za induktore koji povećavaju ili smanjuju njihov afinitet prema DNK i na taj način "uključuju" ili "isključuju" odgovarajuće transkripcione jedinice. Ovakav način regulacije aktivnosti gena označen je kao pozitivna kontrola, jer se transkripcija odvija samo u prisustvu regulatornog proteina.
Osnovni izvor energije za bakteriju E. coli je glukoza. Kada je u ćeliji prisutna dovoljna količina glukoze, tada je inhibirana ekspresija svih gena koji kodiraju enzime uključene u razgradnju drugih katabolita, kao što su laktoza, arabinoza i galaktoza. Ovaj fenomen je poznat kao represija katabolita, i njime se sprečava nepotrebno dupliranje enzimskih sistema koji učestvuju u produkciji energije. Otkrivanju ovog fenomena prethodilo je zapažanje da je u prisustvu glukoze u bakterijskoj ćeliji koncentracija cikličnog AMP-a (cAMP-a) manja nego u odsustvu glukoze i da se dodavanjem cAMP-a može prevazići represija katabolita izazvana glukozom. Naime, transport glukoze kroz membranu bakterijske ćelije dovodi do defosforilacije jednog enzima koji mora biti fosforilisan da bi aktivirao adenilat ciklazu, tako da unos glukoze u ćeliju uvek dovodi do snižavanja koncentracije cAMP-a.
Nađeno je da bakterija sadrži protein označen kao CAP (od eng. catabolite gene activator protein) ili CRP (od eng. cAMP receptor protein), koji se sastoji od dvije subjedinice i vezuje cAMP. Vezivanje cAMP-a izaziva veliku konformacionu promjenu ovog proteina, a njegova funkcija je da se u kompleksu s cAMP-om vezuje za lac operon (i neke druge operone), stimulišući njegovu transkripciju u odsustvu lac represora. Prema tome, CAP je pozitivan regulator, odnosno aktivator transkripcije lac operona, za razliku od lac represora koji je negativan regulator. Za sada još uvijek nije sasvim jasno na koji način kompleks CAP-cAMP stimuliše inicijaciju transkripcije na slabom promotoru laktoznog i drugih operona. Jedna mogućnost je direktna interakcija ovog kompleksa s RNK polimerazom, a druga je promjena konformacije DNK u oblasti promotora, koja olakšava inicijaciju transkripcije. U svakom slučaju, ovakav mehanizam regulacije transkripcije lac operona omogućava bakterijskoj ćeliji da u odsustvu glukoze dođe do potrebne energije razgradnjom laktoze, jer kada je koncentracija glukoze u ćeliji niska, koncentracija cAMP-a pa prema tome i kompleksa CAP-cAMP uvijek raste, što dovodi do ubrzane transkripcije lac operona.
Neki regulatorni proteini kod bakterija mogu se vezati na više mjesta u genomu i izvršiti represiju transkripcije jednog operona, a aktivaciju transkripcije drugog, što praktično znači da jedan isti protein može imati i ulogu represora i ulogu aktivatora. Način djelovanja regulatornog proteina zavisi od rastojanja između mjesta na DNK za koje se vezuje regulatorni protein i mjesta za koje se vezuje RNK polimeraza. Ako se ta dva mjesta preklapaju, onda vezivanje regulatornog proteina onemogućuje vezivanje enzima pa protein djeluje kao represor transkripcije. Ukoliko se vezivna mjesta nalaze u blizini, onda vezivanje regulatornog proteina može olakšati vezivanje RNK polimeraze i stimulisati inicijaciju transkripcije pa u tom slučaju protein deluje kao aktivator transkripcije.
Interesantan primjer regulacije transkripcije, u kome jedan isti protein vrši i pozitivnu i negativnu kontrolu u istom operonu, je regulacija transkripcije arabinoznog operona (araBAD operona) E. coli, koji kodira enzime za razgradnju L-arabinoze. Transkripciju ovog operona reguliše kompleks CAP-scAMP i protein AraC (produkt gena araC) koji vezuje L-arabinozu. Mehanizam regulacije transkripcije araBAD operona sastoji se u sljedećem: 1. u odsustvu proteina AraC, RNK polimeraza započinje transkripciju gena araC, što ima za posljedicu sintezu proteina AmC. Operon araBAD se nalazi nizvodno od gena araC i njegova transkripcija se tada održava na bazalnom nivou; 2. kada je koncentracija glukoze u bakterijskoj ćeliji visoka, tada je koncentracija cAMP-a niska, pa je i koncentracija kompleksa CAP-cAMP, također, niska. Protein AmC tada sprečava transkripciju araBAD operona (bakterija nema potrebe da razgrađuje arabinozu, jer dovoljno energije dobija razgradnjom glukoze). Situacija je slična i kada u bakterijskoj ćeliji nema L-arabinoze, jer bakterija nema potrebu za enzimima za razgradnju ovog šećera. Protein AraC se vezuje za tri mjesta. To su araI1 (nalazi se u okviru promotora araBAD operona), araO1 (nalazi se u okviru promotora gena araC) i araO2 (nalazi se u 5' nekodirajućem regionu gena araC). Niz araO1 je operator gena araC i kada se protein AraC za njega veže, transkripcija gena araC je blokirana. Da bi transkripcija operona araBAD bila onemogućena, protein AraC mora biti istovremeno vezan i za segment araI1 i za araO2. Pošto je niz araO2 veoma udaljen od araI1, vjerovatno je da se DNK savija u petlju tako da protein AraC kao dimer ili oligomer može da bude istovremeno vezan za oba ova mjesta, blokirajući transkripciju araBAD operona (negativna regulacija); 3. kada je u ćeliji prisutna L-arabinoza, ona se kao induktor vezuje za protein AraC, dovodeći do takve konformacione promjene ovog proteina da se on radije vezuje za niz araI2 u promotorskom regionu operona araBAD, nego za araO2. To dovodi do otvaranja petlje DNK. Ako je istovremeno koncentracija cAMP-a u ćeliji visoka (u odsustvu glukoze), kompleks CAP-cAMP se vezuje za mjesto između araO1 i araI1. Kombinovano dejstvo dva kompleksa (CAP-cAMP i AraC-arabinoza) uključuje njihovu direktnu interakciju i praćeno je aktivacijom RNK polimeraze, koja počinje da transkribuje araBAD operon (pozitivna kontrola). Gen araC ostaje blokiran proteinom AraC, koji ostaje vezan za araO1.
Regulacija transkripcije triptofanskog operona – atenuacija
[uredi | uredi izvor]Atenuacija je mehanizam kontrole transkripcije kojim bakterija reguliše ekspresiju mnogih operona koji kodiraju enzime uključene u biosintezu aminokiselina. Ovaj mehanizam je bio otkriven kada je izučavana regulacija transkripcije triptofanskog operona (trp operon) bakterije E. coli koji kodira pet polipeptida. Ovih pet polipeptida grade tri enzima koji učestvuju u biosintezi triptofana. Ustanovljeno je da se geni L-P operona koordinisano eksprimiraju pod kontrolom trp represora, dimernog proteina koji se sastoji od dvije identične subjedinice. Trp' represor je produkt gena trpR, koji se nalazi u okviru zasebne transkripcione jedinice. On vezuje L-triptofan gradeći kompleks koji se specifično vezuje za trp operator (trpO) i time 70 puta smanjuje brzinu transkripcije trp operona. Vezivanje triptofana za represor dovodi do takve alosterične promjene represora koja omogućuje njegovo istovremeno vezivanje i za operator. Uz to i sam triptofan formira H-vezu s fosfatnom grupom na DNK, tako da učvršćuje vezu između represora i operatora, odnosno djeluje kao korepresor (sprečava sopstvenu sintezu). Trp represor kontroliše transkripciju ne samo trp operona, već još najmanje dva operona: trpR operona i aroH operona (kodira sintezu jednog od tri izoenzima, koji katalizuju biosintezu horizmata, prekursora aromatičnih aminokiselina).
U početku se smatralo da je sinteza triptofana kod E. coli u potpunosti kontrolisana sistemom trp represor-operator. Međutim, nađeno je da nizvodno od trpO postoji još jedan kontrolni element. Ispred prvog strukturnog gena u trp operonu (trpE) nalazi se čeoni niz (trpL) dužine 162 bp i u okviru njega niz dužine oko 30 bp koji ,također, ima ulogu kontrolnog elementa. U odsustvu triptofana, sintetiše se policistronska iRNK dužine 6720 nukleotida koja obuhvata i čeoni niz trpL. Kada koncentracija triptofana u bakteriji raste, brzina transkripcije trp operona opada kao rezultat stvaranja kompleksa trp represor-korepresor. Među iRNK koje se sintetišu zapaža se povećana proporcija kratkih transkripata dužine oko 140 nukleotida koji odgovaraju 5' kraju trpL niza. To znači da u prisustvu triptofana dolazi do prerane terminacije transkripcije trp operona i zato je kontrolni element odgovoran za ovu pojavu nazvan atenuatorom. Pokazalo se da atenuator sadrži četiri komplementa RNK segmenta koji mogu da formiraju dvije različite intramolekulske zavojnice: između segmenata 2 i 3, odnosno 3 i 4, ali tako da formiranje jedne od njih onemogućava formiranje druge. Segmenti 3 i 4 su bogati nukleotidima G i C, a zajedno s nekoliko uzastopnih U koji slijede, čine normalan terminacioni signal za RNK polimerazu.
Transkripcija se može nastaviti poslije ovog terminacionog signala samo u odsustvu triptofana. Segment I je karakterističan po tome što sadrži dva uzastopna kodona za triptofan (tandemski kodon). Da bi se razumio mehanizam atenuacije trp operona, važno je imati na umu da translacija kod prokariota započinje ubrzo pošto se sintetiše 5'-kraj iRNK i teče uporedo s transkripcijom. Mehanizam atenuacije se sastoji u tome da RNK polimeraza koja je izbjegla represiju započinje transkripciju. Ubrzo poslije transkribovanja Šajn-Dalgarnovog niza (mjesto vezivanja male ribosomske subjedinice) koji se nalazi u okviru čeonog niza trpL, ribosom se vezuje za ovaj niz i započinje translaciju. Ako je u ćeliji prisutan triptofan, tada su prisutni i kompleksi Trp-tRNKTrp, tako da iza RNK polimeraze napreduje i ribosom preko triptofanskog tandemskog kodona u segmentu 1 atenuatora. Ribosom sprečava da se stvori ukosnica izmedu segmenata 1 i 2, ali je zato favorizovano stvaranje ukosnice između segmenata 3 i 4 koji grade terminacioni signal. Transkripcija se zato prerano završava. Ako u ćeliji nema triptofana, ribosom se zaustavlja na triptofanskom tandemskom kodonu u segmentu 1 atenuatora, očekujući da se Trp-tRNKTrp, koje nema, veže za A mjesto. Pošto je ribosom zaostao, omogućeno je stvaranje ukosnice između segmenata 2 i 3, a time je spriječeno stvaranje terminacionog signala, tj. ukosnice između segmenata 3 i 4. RNK polimeraza tada nastavlja transkripciju duž cijelog operona, sintetišući policistronsku iRNK koja će poslužiti kao informacija za sintezu enzima neophodnih za biosintezu triptofana. Ovaj regulatorni mehanizam se zasniva na koncentraciji Trp-tRNKTrp u ćeliji, koja zavisi od koncentracije triptofana. Odsustvo triptofana utječe na ekspresiju trp operona na dva načina: uklanjanjem represora, čime se brzina transkripcije povećava oko 70 puta i atenuacijom, čime se brzina transkripcije povećava još 8-10 puta, tako da transkripcija može biti ukupno ubrzana do 700 puta. Na sličan način je kod bakterija regulisana i transkripcija nekih drugih operona, kao što su his operon (kodira enzime koji učestvuju u biosintezi histidina) i ilv operon (kodira enzime koji učestvuju u biosintezi izoleucina, leucina i valina).[31][40]
Promjene genetičkog materijala
[uredi | uredi izvor]Postoje sam dva izvora nasljedne promjenljivosti: to su mutacije, kao genetičke novosti, i genetičke rekombinacije, tj. rearanžmani postojećeg genetičkog materijala.
Mutacije
[uredi | uredi izvor]Mutacija (lat. mutatio – promjena, zamjena) kvalitativna je i/ili kvantitativna promjena u genetičkom materijalu koja nije uzrokovana segregacijom ili rekombinacijom. Mutacije mogu uzrokovati promjene u pojedinačnim obilježjima (fenotipa). Organizam s mutacijom se naziva mutant.
Promjenljivost nasljednog materijala predstavlja genetičku osnovu sveukupne biološke raznolikosti u vremenu i prostoru, promatrajući živi svijet u cjelini i svaku vrstu živih bića posebno. Mutacije su moguće na različitim nivoima organizacije genetičkog materijala. Mutacije, dakle, predstavljaju jedini suštinski izvor nasljedne, individualne varijacije. Nastaju slučajnim promjenama u strukturi i količini DNK. Mutageneza (proces nastajanja mutacija) može biti (indukcijom ili spontano) izazvana različitim fizičkim, hemijskim i biološkim faktorima vanjske i unutrašnje sredine, ali efekat mutiranog gena samo slučajno može predstavljati direktan "odgovor" (protuakciju) na odgovarajući mutageni agens.[21][32][45]
Efekti mutacija su manje ili više fenotipski vidljivi, zavisno od promjenljivosti, jer se javljaju kao posljedica materijalnih promjena u hemijskoj strukturi i kvantitetu genetičke informacije, tj. dezoksiribonukleinske kiseline (DNK). Sve ostale pojave i oblici nasljedne varijacije rezultat su rearanžmana (rekombinacija) postojećeg genetičkog materijala ili različitih efekata njegove interakcije s unutrašnjom i vanjskom sredinom.
Od količine zahvaćenog genetičkog materijala i njegovog značaja za normalnu organizaciju i funkciju organizma ili njegovih pojedinih komponenata, odnosno od prirode interakcije novonastalog alela s postojećim alelnim varijantama mutirajućeg gena (recesivna mutacija) se, npr. ispoljava samo u homozigotnom stanju). Poznato je, naime, da krupne mutacije (makromutacije) po pravilu imaju upadljive, najčešće (sub)letalne efekte. Međutim, čak i izmjena samo jedne azotne baze u lancu DNK (mikromutacija) može u značajnoj mjeri izmijeniti strukturu, a naročito funkciju proteina čiju sintezu kontrolira njen zahvaćeni segment (gen). Tako se, naprimjer, izmjenom samo jedne aminokiseline na šestoj poziciji u beta–lancu hemoglobina (valin – glutaminska kiselina), umjesto normalnog hemoglobina A (čiju sintezu šifrira alel HbA), javila patološka varijanta krvnog pigmenta – hemoglobin S (kontrolirana alelom HbS).[22][34]
Prema efektima na adaptivnu vrijednost, mutacije mogu biti korisne, štetne ili neutralne. Imajući u vidu činjenicu da svaki specifični genom (pa i ljudski) predstavlja evolutivno izbalansiranu cjelinu, postaje jasno zašto su korisne mutacije uistinu prava rijetkost. I pored toga, ukoliko ih podržava prirodno odabiranje, njihovo prisustvo u populaciji postaje sve uočljivije. Generalno uzevši (živi svijet u cjelini), s obzirom na količinu i poziciju zahvaćenog genetičkog materijala, mutacije mogu biti genske, hromosomske, genomske i plazmatske (ekstranuklearne) mitohondrijske i plastidne).
Genske mutacije
[uredi | uredi izvor]
Genske mutacije zahvaćaju pojedinačne gene po čemu su i dobile naziv. One nisu vidljive pod mikroskopom. Obično se dijele na autosomne i heterosomne genske mutacije s obzirom na kojim se hromosomu nalazi mutirani gen. Nastaju izmjenom u hemijskoj strukturi funkcionalne sekvence DNK, koja zauzima određeni genski lokus i kontrolira odgovarajuće funkcije, odnosno osobine organizma. Prema prirodi interakcije sa postojećim genima istog lokusa, novonastali aleli mogu biti dominantni, recesivni ili među njima nema odnosa funkcionalne dominacije. Suglasno konvencionalnim kriterijima, novonastali mutanti se mogu označiti kao: izomorf, amorf, hipomorf, hipermorf, neomorf i antimorf, pri čemu prefiksi ovih odrednica označavaju prirodu i smjer mutiranja funkcije ishodišnog alela ("divljeg tipa").
Stroga pravila komplementarne autoreprodukcije genetičkog materijala, na kojima inače počiva stabilnost i ponovljivost karakterističnih osobina svih živih bića, u relativno rijetkim slučajevima bivaju narušena. Tako, npr. prilikom duplikacije nekog polu-lanca DNK, za jedan od adenina može se pogrešno vezati citozin, pa umjesto normalnog para A–T nastaje neočekivani A–C. Kada je riječ o polaznom polu-lancu (s adeninom), već nakon prve diobe promatrane molekule DNK, u procesu njegove duplikacije, ta greška će biti ispravljena i sve njegove naredne kopije će na pogođenom mjestu imati normalni A–T par nukleotida. Međutim, polu-lanac s pogrešno ugrađenim citozinom će se u prvoj normalnoj duplikaciji vezati s prirodno komplementarnom bazom guaninom u par C–G, koji nije karakerističan za datu poziciju u izvornom lancu DNK. Time se mutacija stabilizira, a novi par ponavlja u nizu narednih kopija izmijenjene DNK. Genske mutacije su, prema tome, posljedica greške u kopiranju (duplikaciji) lanaca DNK. Promjena samo jednog para nukleotida u zahvaćenom genu može imati krupne posljedice u njegovoj funkciji.
Mutabilnost pojedinih gena uveliko varira, a u prosjeku iznosi oko 10−5 (jedna mutacija na 100.000 gameta). Ta naoko zanemarljiva frekvencija, međutim, postaje impozantna u svjetlu podataka o ukupnom broju genskih lokusa u ljudskom genomu – rezultati sekvenciranja ljudskog genoma pokazali su da se taj broj kreće do 30.000. Uvažavajući pomenute činjenice, lahko se može proračunati (3 x 104 x 10−5) da svaki treći čovjek (30%) potencijalno nosi najmanje jednu svježu mutaciju.
Hromosomske mutacije
[uredi | uredi izvor]Hromosomske mutacije zahvataju hromosome i vidljive su pod mikroskopom. Razlikuju se numeričke i strukturne promjene u pojedinim parovima homologa u hromosomskoj garnituri.
Numeričke hromosomske mutacije predstavljaju pojedine oblike aneuploidije: nulisomiju (nedostatak oba homologa), monosomiju (nedostatak jednog homologa), trisomiju (jedan homolog više) i teorijski moguće stepene polisomije (kvadrisomija itd.). Strukturne hromosomske mutacije se pak ispoljavaju kao nedostatak (delecija – deficija) ili višak (duplikacija) jednog dijela nekog hromosoma. U ovoj kategoriji mutacija relativno su česte i pojave nenormalnog rasporeda pojedinih dijelova unutar hromosoma (transpozicija) ili njihovog premještanja na neki drugi hromosom (translokacija), te obrtanja pojedinih segmenata hromosoma (za 180° – inverzija), što rezultira obrnutim rasporedom lokusa na mutiranoj sekvenci.[46]
Genomske mutacije
[uredi | uredi izvor]Genomske mutacije imaju za posljedicu izmjenu normalnog diploidnog hromosomskog broja (''2n'') za n, tj. za jedan ili više haploidnih setova hromosoma (euploidija: haploidija, triploidija, poliploidija). Prema porijeklu dodatnih garnitura, poliploidija može biti autopoliploidija (uvišestručavanje soptvenog genoma) ili alopoliploidija (heteroploidija: dodavanje stranih genoma putem hibridizacije).[5][34][47][48][49][50][51]
Citoplazmatske mutacije
[uredi | uredi izvor]- Plazmatske mutacije (plazmamutacije, vanjedarne mutacije) posebna su kategorija mutacija. Za razliku od genskih, hromosomskih i genomskih, koje se događaju u jedru – odigravaju se u citoplazmatskim nosiocima genetičkog materijala (kao npr. u mitohondrijalnoj i plastidnoj DNK) [39].
Rekombinacije
[uredi | uredi izvor]Genetička rekombinacija ili kratko rekombinacija je proizvodnja potomaka sa kombinacijom osobina po kojoj se razlikuju od svojih roditelja. U eukariota genetičke rekombinacije se dešavaju tokom mejoze putem, spolne reprodukcije, dajući set genetičke informacije koja se mogu dalje nasljedno prenositi od roditelja na potomstvo, u nizu generacija posmatrane vrste organizama. Većina rekombinacije se javljaju u prirodi. Tokom mejoze u eukariota, rekombinacije uključuje uparivanje homolognih hromosoma. To može biti praćeno razmjenom informacija između hromosoma. Ta razmjena se može desiti i bez fizičke razmjene (a dio genetskog materijala se kopira iz jednog u drugi hromosom, bez doniranja i razmjene dijelova hromosoma) (vidi SDSA put na slici); ili lomljenja i ponovnog spajanja DNK lanaca, koji čini nove molekule DNK. Rekombinacija se može pojaviti i tokom mitoze eukariota, što obično uključuje dvije sestrinske hromatide formirane nakon hromosomskih replikacija. U ovom slučaju, nema novih kombinacija alela jer su sestrinske hromatide obično identične. U mejozi i mitozi, rekombinacije se javlja između homolognih dijelova hromosoma, odnosno molekula DNK. U mejozi, nesestrinske hromatide homolognih hromosoma se međusobno uparuju, tako da se rekombinacije dešava između nesestrinskih sudionika konjugacije hromosoma. U oba meiotic i mitotska ćelija, rekombinacije između homolognih hromozoma je zajednički mehanizam koji se javlja u DNK reparaciji.[32][44]
Genetički rekombinacije i rekombinantna DNK reparacija također se javlja i kod bakterija i archaea, koje imaju aseksualnu reprodukciju.
Rekombinacija se može inducirati i u laboratoriji, podešavanjem in vitro, producirajući rekombinantnu DNK za različite potrebe koje uključuju i proizvodnju vakcina i medicinskih preparata.
- Tokom mejoze, genetičkim rekombinacijama obično prethodi formiranje sinapsi (uparivanje homolognih hromosoma).
Rekombinacije su katalizirane putem mnogih različitih enzima. Rekombinaze su ključni enzimi koji kataliziraju sve faze transfera lanaca tokom rekombinacije. RecA, glavna rekombinaza Escherichia coli, odgovorna je za popravak DNK dvostrukog lanca. U kvasca i drugih eukariotskih organizama, postoje dvije rekombinaze, potrebne za popravak dvostrukih lanaca. RAD51 protein je potreban za mitotska i meiotske rekombinacije, dok je popravak DNK odgovoran je DMC1 gen koji kodira specifični proteine za mejotska rekombinacije. U archaea, ortolog bakterijske RecA proteina je RadA.
Prirodno odabiranje i evolucija
[uredi | uredi izvor]Selekcija, u kontekstu evolucije, favoriziranje je ili eliminiranje određene osobine ili alela unutar populacije. Ovaj faktor evolucije omogućava da određeni fenotipovi imaju tendenciju da budu reprodukcijski uspješniji, što znači da ostavljaju više potomaka i svojih gena u narednu generaciju nego što rade drugi. Kada ove osobine imaju genetičke osnove, odabir može povećati njihovu prevalenciju jer potomci će naslijediti gene koji kontroliraju osobine njihovih roditelja.[52][53]
Kada je selekcija intenzivna i uporna, adaptivne osobine postaju univerzalnie u populaciji ili vrsti, za koje se onda može reći da evoluiraju.
Dugotrajna pozitivna selekcija jednog alela, neminovno vodi ka smanjenju učestalosti ostalih u populaciji i – u konačnici – do potpune eliminacije drugog ili drugih. Brzina eliminacije zavisi od snage selekcijskog pritiska, interakciji alelnih gena, heterozigotnosti, vezanosti pogođenih lokusa za gene visoke adaptacijske vrijednosti i neke druge odnose u genetičkoj strukturi populacije, kao i uvjetima života, uključuju ći ograničenja resursa (hrana, stanište prostor, saučesnici) i postojanje mogućih prijetnji (predatori, bolesti, nepovoljne vremenske prilike). Djelovanje svih tih faktora je, međutim, uključeno u kompleks koji se označava kao selekcijski pritisci.
U prirodnoj selekciji, čak ni najprilagođeniji fenotipovi nisu dovoljno adaptirani da bi bili apsolutno pošteđeni od njenog djelovanja.
Prirodno odabiranje je evolucijska snaga koja (logično) prepoznaje samo fenotipove, a skupa s njima favorizira ili onemogućuje odgovarajuće alelogene, dok je u vještačkoj selekciji moguće birati i poželjne genotipove.
Selekcija efikasno djeluje putem diferenciranog nataliteta, ali i razlika u mortalitetu životnoj sposobnosti (vigor) individual u pogođenoj populaciji. Pritom su osobito značajni adaptivna vrijednost i intenzitet selekcijskog pritiska.
- Prirodna selekcija je, po imenu, najpoznatiji oblik selekcije.
- Podkategorije prirodne selekcije su također ponekad razlikuju. Među njima su:
- spolno odabiranje,
- ekološko odabiranje.
Selekcija ne garantira da će najpovoljnije osobine ili aleli postati prevladavajući unutar populacije. Drugi proces u determiniranju frekvencije gena u populaciji se zove genetički drift, koji djeluje na gene koji nisu pod selekcijom. No, drift ne može prevladati samu prirodnu selekciju, jer je slučajni faktor, dok je prirodno odabiranje zapravo trajna evolucijska sila. S obzirom na izbor čak i tzv štetnih alela oni mogu postati univerzalna komponenta genskog fonda jedne vrste. To je rizik prvenstveno u slučaju "slabog" izbora (npr. zarazne bolesti sa veoma niskom stopom smrtnosti) ili male veličine populacije. Iako ponekad mogu postati osnovana štetnih alela, odabir može djelovati negativno, kao i pozitivno.
- negativna selekcija smanjuje prevalenciju osobina koje smanjuju "kapacitet za uspjeh" (adaptivnu vrijednost ili , kako se često formulira fitnes), dok
- pozitivna selekcija povećava prevalenciju adaptivne osobine.
U biološkom raspravama , negativna selekcija ponekad je nazivana odabitanje protiv, dok su oni pod pozitivne selekcije su, rekao je da se odabranje za.
Genotip i okolinski uvjeti
[uredi | uredi izvor]
Iako genom svake jedinke sadrži kompletnu genetičku informaciju za sve elemente građe i funkcije organizma,okolinski faktori također imaju značajnu ulogu u određivanju konačnog fenotipa. U tom pogledu, zanimljive su pojave pripitomljenih životinja, fenomeni poznati kao "priroda protiv njege". Jedan od primjera je mutacija koja izaziva osjetljivost na temperaturu. Iako postoje i ekstremni suprotni slučajevi, obično izmjena jedne aminokiseline u sekvenci proteina ne mijenja njegovo ponašanje i interakciju s produktima drugih gena, ali može destabilizirati njihovu strukturu. U uvjetima povišenih temperatura, molekule se brže kreću i sudaraju, što rezultira time da protein mijenja normalnu strukturu i postaje nefunkcionalan. Međutim, pod niskim temperaturama, sutruktura proteina je stabilna kao i njegova funkcija. Ovaj tip mutacije se javlja kod boje krzna sijamskih mačaka, gdje enzim koji kontrolira boju krzna, na visokoj temperaturi biva destabiliziran i gubi funkciju.[54] U ohlađenim dijelovima kože (noge, uši, rep i lice), enzim je aktivan pa takva mačka na tim dijelovima ima tamnije krzno.
Okolina može također imati dramatičan uticaj na ispoljavanje nasljednih boleti kod čovjeka. Primjer može biti fenilketonurija.[55] Mutacija koja izaziva ovu "grešku" metabolizma fenilalanina onemogućava njegovo razlaganje, što izaziva toksično nakupljanje srednje molekule u metaboličkom lancu, što izaziva jake simptome progresivne mentalne zaostalosti. Međutim, ako osoba s fenilokenturijom pridržava odgovarajućih strogih dijeta, bez fenilalanina fenotipsi će se ispoljavati kao i osobe bez te mutacije.
Rašireni način za procjenu relativnog udjela okolinskih faktora na ispoljavanje određenog genotipa je blizanački metod, koji počiva na poređenju serija jednojajnih i dvojajnih blizanaca ili braće/sestara iz višestrukih trudnoća. Budući da su jednojajni blizanci klon istog zigota, oni su genetički identični. Dvojajni su, međutim, isto toliko različiti ili slični kao i braća i/ili sestre koje nisu iz iste trudnoće. Porodeći međusobnu podudarnost fenotipova u serijama jednojajnih i dvojajnih blizanaca, moguće je procijeniti uticaj okolinskih faktora na ispoljavanje posmatranih poremećaja. Jedan poznati primjer istraživanja višestruke trudnoće su Genain četvorke, koje su bile jednojajne i sve sa šizofrenijom.[56]
Istraživanje i tehnologija
[uredi | uredi izvor]Model organizmi
[uredi | uredi izvor]
Iako su početna genetička istraživanja nasljednosti kod mnogih vrsta organizama, vrememnom su se pojavila i specijalizuirane problem objekti istraživanju genetike određenih grupa organizama. Ta činjenica je podsticala buduća istraživanja da svoje projekte osmisle na provjereno podobnim organizmima. Tako je nekolicina organizama postali modelni biološki sistemi u većini genetičkih istraživanja, tj. postali su modelni organizmi.[57] Najčešćem pročavani problem genetičkih istraživanja kod modelnih organizama, dosad su bili regulaciji djelovanja gena, uticaj gena u razvoj i genetičke osnove karcinoma. Model organizmi, u svim biološkim istraživanjima, su odabrani zbog nihovih podobnosti, kao što su:
- kratko generacijsko vrijeme, tj. kratak period od začeća do postizanja spolne zrelosti I
- jednostavno održavanje u laboratorijskim uvjetima, i
- jednostavna manipulacija osnovnim jedinicama proučavanja.
Uz sve te uvjete, jednostavna manipulacija genima učinila je neke organizme popularnim modelima za različita istraživanja. Naširoko korišteni modelni organizmi u genetici su Escherichia coli, biljka Arabidopsis thaliana (poznata kao "biljna vinska mušica"), pivski kvasac (Saccharomyces cerevisiae), obla glista (Caenorhabditis elegans, vinska mušica (Drosophila melanogaster) i obični miš (Mus musculus).
Istraživanja u medicinskoj genetici
[uredi | uredi izvor]Medicinska genetika istražuje kako genetičke ke varijacije mogu uticati na ljudsko zdravlje i bolesti, te kako njima upravljati. Kada se traga za nepoznatim genom koji je možda povezan s određenom bolesti, često koriste vezani geni i genetičke karte s rodoslovom, kako bi se procijenila pozicija, sa bolešću povezanog, lokusa u genomu pacijenta. Na razini populacije, testiraju se modeli Mendelovskog slučajnog izbora parnjaka, pristup koji može biti vrlo koristan za slučajeve poligenskog nasljeđivanja osobina. To su one koje ne ispoljavaju funkciju samo Kada se gen-kandidat pronađe, daljnje istraživanje se obično nastavlja na odgovarajućem (ortolognom) genu modelnih organizama. Uz istraživanje genetičkih bolesti, intenzivan razvoj I povećana dostupnost tehnika za mijenjanje gena, doveli su i do farmakogenetike, koja istražuje uticaj genotipa na odgovore organizma na uzimanje određenih lijekova.
Podložnost razvoju raka je individualno određena, jer je rak ima genetičku osnovu. Proces razvoja raka u tijelu je ustvari kombinacija raznih događaja, uključujući I njihove kombinaciuju I dinamiku. Tokom ćelijskih dioba, u tijelu često se dešavaju mutacije. Iako ih potomstvo neće naslijediti, mogu uticati na ponašanje ćelija nositelja, što ponekad dovodi do njihovog bržeg rasta i proliferacijske – nekontrolirane diobe. Postoje biološki mehanizmi koji u normalnim stanjima mogu zaustaviti ovaj process, jer se takvim ćelijama šalju se signali koji bi trebali izazvati smrt ćelije, ali u podložnim slučajevima se dese mutacije koje izazivaju ignoriranje ove poruke. U tijelu se javlja unutrašnji proces prirodne selekcije i na kraju se mutacije nagomilvaaju, potičući sopstveni rast, tj. stvarajući kancerogene tumore koji rastu i zauzimaju pogođena tjelesna tkiva.
Tehnike istraživanja
[uredi | uredi izvor]U solidno opremljenim laboratorijama, može se manipulirati i samom DNK. Restrikcijski enzimi se protom obično koriste za rezanje DNK na određenom dijelu sekvence, stvarajući, između ostalih, i tražene fragmente DNK. Ti fragmenti se mogu vizualizirati korištenjem gelne elektroforeze, koja ih razdvaja, prema njihovoj dužini, odnosno pokretljivosti u električnom polju.
Zatim DNK ligaza omogućava da se sekvence DNK povežu, pa se njihovim spajanjem iz raznih izvora, može napraviti rekombinantna DNK. Ova odrednica se često povezuje s genetički modificiranim organizmima, jer se oni dobijaju unošenjem stranih sekvenci DNK genom tretiranih ćelija I organizama. Kao vektori unosa poželjnih segmenata DNK u određeni genom, obično se uzimaju plazmidi – kratki kružni dijelovi DNK s nekoliko gena na njima. Ubacivanjem plazmida u bakterije i njihovim uzgojem na hranljivoj podlozi (agaru), mogu se u bakterijama (koje se brzo razmnožavaju) klonirati uneseni fragmenti molekula DNK. Tako je, naprimjer, u bakteriju Escherichia coli, putem pogodnog plazmida, ubačen ljudski gen za sintezu insulina, a njene kolonije zatim produciraju insulin, koji je odavno u komercijalnoj upotrebi.
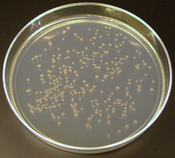
DNK se može umnožavati (amplificirati) i procedurom lančane reakcije polimerazom (PCR).[58] Na matrici određene kratke sekvence DNK, PCR može izolirati i eksponencijalno umnožiti određeni segment DNK. Budući da se može amplificirati iz veoma malik količina DNK, PCR se također često koristi za otkrivanje prisustva neke određene sekvence DNK u biološkim tragovima, uključujući i one koji su forenzički i medicinski zanimljivi.
DNK sekvenciranje i genomika
[uredi | uredi izvor]Među temeljne nove tehnologije genetičkih istraživanja svakaku ulazi sekvenciranje DNK molekula, što omogućava prepoznavanje redoslijeda nukleotida u molekulama DNK i njenim ciljanm sekvencama. Ovaj postupak su razvili Frederick Sanger i suradnici 1977. godine, a danas se rutinski koristi za sekvenciranje DNK različitih vrsta I oblika života.[59][60] Ovom tehnologijom je moguće analizirati I one molekulske sekvence koje se dovode u vezu sa mnogim ljudskim bolestima. Smanjivanje troškova sekvenciranja, utvrđene su genomske sekvence mnogih organizama, koristeći prito I komputerizirane programe za povezivanje sekvenci više fragmenata. Takvom tehnikom je također sekvenciran i ljudski genom, što je omogućilo završetak Projekta ljudskog genoma 2003. godine.[61] Nove tehnologije za sekvenciranje dramatično snižavaju cijenu sekvenciranja DNK, a mnogi se nadaju da će se cijena za ponovno sekvenciranje ljudskog genoma sniziti na prihvatljive iznose za najširi krug zaineresiranih osoba. Rastuća količina podataka o sekvenciranim genomima otvorila je novo polje genetike, nazvano genomika, nauke koja koristi kompjutacijske alate za analizu dijelova cijelog genoma nekog organizma. Genomika se također može smatrati dijelom bioinformatike.
Područja genetike
[uredi | uredi izvor]Područja genetike su: antropogenetika, bioinformatika, citogenetika, evolucijska genetika, farmakogenetika, filogenetika, forenzička genetika, genealoška genetika, genetičko inženjerstvo, genetika čovjeka, genetika ponašanja, genetika starenja, genomika, humana genetika, klasična genetika, kvantitativna genetika, medicinska genetika, molekulska genetika, obratna genetika, poljoprivredna genetika, populacijska genetika, proteomika i razvojna genetika, standardna genetika, šumarska genetika.
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ Alberts B., Johnson A., Lewis J., Raff M., Roberts K., Walter P. (2002): Molecular Biology of the Cell. Garland Science New York.
- ^ Hartl D., Jones E. (2005). Genetics: Analysis of Genes and Genomes. Jones & Bartlett Publishing, Burlington, MA, USA.
- ^ Lodish H., Berk A., Zipursky L. S., Matsudaira P., Baltimore D., Darnell J. (2000). Molecular Cell Biology. Scientific American Books New York.
- ^ Pierce B. A. (2013) Genetics: A Conceptual Approach, Fifth Edition, W.H. Freeman and Company, New York.
- ^ a b Brown T A (2011) Introduction to Genetics: A Molecular Approach, 1st edition, Garland Science - Taylor & Francis, New York.
- ^ Hartwell L., Silver L. M., Leroy Hood, Michael Goldberg, Ann Reynolds, Ruth Veres (2010) Genetics: From Genes to Genomes, 4th edition, McGraw-Hill Science/Engineering/Math, New York, USA.
- ^ Allison L. A. (2007) Fundamental Molecular Biology, Blackwell Publishing, Malden, MA, USA.
- ^ Primrose S. B., Twyman R. M. (2006) Principles of Gene Manipulation and Genomics, 7th edition, Blackwell Publishing, Malden, MA, USA.
- ^ Brooker R. J. (2014) Genetics: Analysis and Principles, 5th edition McGraw-Hill Higher Education, New York, USA.
- ^ Mendel G. (1866): Versuche über Pflanzen–Hybriden. Verhandlungen des Naturforschenden Vereines in Brün, Bd. IV, für den Jahr 1865, Abhandlungen, 3-47, Bürn. In: Křizenský J., Němec B. (1965): Fundamenta genetica. Publishing house of the Czechoslovak Academy of Science, Prague, Moravian Museum, Brno.
- ^ a b Alberts B., Johnson A., Lewis J., Raff M., Roberts K., Walter P. (2002):Molecular biology of the cell, 4th Edition Garland Science, New York, ISBN 0-8153-3218-1.
- ^ a b Hartl D., Jones E. (2005): Genetics: Analysis of genes and genomes, 6th Edition, Jones & Bartlett, New York, ISBN 0-7637-1511-5
- ^ Lodish H. et al.(2000): Molecular cell biology, 4th Edition. Scientific American Books, New York, ISBN 0-7167-3136-3.
- ^ a b c Lawrence E. (1999): Henderson's Dictionary of biological terms. Longman Group Ltd., London, ISBN 0-582-22708-9.
- ^ "Nature Publishing Group : science journals, jobs, and information". nature.com. Pristupljeno 31. 1. 2016.[mrtav link]
- ^ "Nature Publishing Group : science journals, jobs, and information". nature.com. Pristupljeno 31. 1. 2016.[mrtav link]
- ^ WatsonJ. D., Crick F. (1953): Genetical implications of the structure of deoxyribonucleic acid. Nature, 171: 964–967.
- ^ Betz F. (2010): |Managing science: Methodology and organization of research, Springer, ISBN 978-1-4419-7488-4.
- ^ "Managing Science". google.com. Pristupljeno 31. 1. 2016.
- ^ a b Krebs J. E., Goldstein E. S., Kilpatrick S., T. (2014): Lewin's Genes XI. Jones & Bartlett Publishing, Burlington, ISBN 978-1449-65985-1.
- ^ a b c d King R. C., Stransfield W. D. (1998): Dictionary of genetics. Oxford niversity Press, New York, Oxford, ISBN 0-19-50944-1-7; ISBN 0-19-509442-5.
- ^ a b c d Lincoln R. J., Boxshall G. A. (1990): Natural history - The Cambridge illustrated dictionary. Cambridge University Press, Cambridge, ISBN 0 521 30551-9.
- ^ Hartl D., Jones E. (2005): Genetics: Analysis of genes and genomes, 6th Edition, Jones & Bartlett, New York, ISBN 0-7637-1511-5.
- ^ a b Krebs J. E., Goldstein E. S., Kilpatrick S., T. (2014): Lewin's Genes XI. Jones & Bartlett Publishing, Burlington, MA, USA.
- ^ Yu J., Hu S., Wang J., et al. (2002):|A draft sequence of the rice genome (Oryza sativa L. ssp. indica).Science, 296 (5565): 79–92.
- ^ Carninci P., Hayashizaki Y. (2007): Noncoding RNA transcription beyond annotated genes. Curr. Opin. Genet. Dev. 17 (2): 139–44.
- ^ Claverie J. M. (2005): Fewer genes, more noncoding RNA. Science, 309 (5740): 1529–1530.
- ^ Iratxeta C. et al(2007): Towards completion of the Earth's proteome. Nature EMBO reports, 8 (12): 1135–1141.
- ^ Palidwor G., Navarro M. A.: http://www.nature.com/embor/journal/v8/n12/full/7401117.html.
- ^ Bajrović K, Jevrić-Čaušević A., Ed. (2005): Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-1-8.
- ^ a b c d Kapur Pojskić L., Ed. (2014): Uvod u genetičko inženjerstvo i biotehnologiju, 2. izdanje. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 978-9958-9344-8-3.
- ^ a b c d Hadžiselimović R., Pojskić N. (2005): Uvod u humanu imunogenetiku. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-3-4.
- ^ a b Berberović LJ., Hadžiselimović R. (1986): Rječnik genetike. Svjetlost, Sarajevo, ISBN 86-01-00723-6.
- ^ a b c d Hadžiselimović R. (2005): Bioantropologija – Biodiverzitet recentnog čovjeka. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-2-6.
- ^ Cavali-Sforza L. L., Bodmer W. F. (1999): The genetics of human populations. Dover PublicTIONS, Inc., Mineola, New York, ISBN 0-486-40693-8.
- ^ Nussbaum R. L. et al.(2007): Genetics in Medicine. Saunders, Philadelphia
- ^ a b MacLeod A., Sikora K. (1984): Molecular biology and human diseases. Blackwell Scientific Publications, Oxford, ISBN 0-632-01167-X.
- ^ a b Alberts B. et al. (1983): Molecular biology of the cell. Garland Publishing, Inc., New York & London, ISBN 0-8240-7283-9.
- ^ a b c Hartl D, Jones E (2005). Genetics: Analysis of Genes and Genomes. Jones & Bartlett Publishing, Burlington, MA, USA.
- ^ a b c Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Ed. (2005): Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-1-8.
- ^ a b c Alberts B., Johnson A., Lewis J., Raff M., Roberts K., Walter P. (2008): Molecular Biology of the Cell, Garland Science, Taylor & Francis Group NY, USA
- ^ Greška kod citiranja: Nevaljana oznaka
<ref>; nije naveden tekst za reference s imenomauto16 - ^ Greška kod citiranja: Nevaljana oznaka
<ref>; nije naveden tekst za reference s imenomauto14 - ^ a b Ibrulj S., Haverić S., Haverić A. (2008): Citogenetičke metode – Primjena u medicini . Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo,ISBN 978-9958-9344-5-2.
- ^ Campbell N.eil (2005). Biology. Benjamin/ Cummings, San Francisco ISBN 0-07-366175-9.
- ^ Ibrulj S., Haverić S., Haverić A. (2008): Citogentika - primjena u medicini. Institut za genetičko inženjerstvo i biotehnologiju, Sarajevo.
- ^ Benjamin A. Pierce (2013) Genetics: A Conceptual Approach, Fifth Edition, W.H. Freeman and Company, New York.
- ^ Leland Hartwell, Lee M. Silver, Leroy Hood, M|ichael Goldberg, Ann Reynolds, Ruth Veres (2010) Genetics: From Genes to Genomes, 4th edition, McGraw-Hill Science/Engineering/Math, New York, USA.
- ^ Allison L. A. (2007) Fundamental Molecular Biology, Blackwell Publishing, Malden, MA, USA. .
- ^ Primrose S. B., Twyman R. M. (2006): Principles of Gene Manipulation and Genomics, 7th edition, Blackwell Publishing, Malden, MA, USA.
- ^ Robert J. Brooker (2014) Genetics: Analysis and Principles, 5th edition McGraw-Hill Higher Education, New York, USA.
- ^ Bell G. (1997): Selection: The mechanism of evolution. Chapman & Hall, New York, ISBN 0-412-05521-X. (2nd edition published in 2008 by Oxford University Press, ISBN 0-19-856972-6)
- ^ Paramonov A. A. (1959): Kurs darvinizma. "Veselin Masleša", Sarajevo.
- ^ Imes D. L. et al. (2006): Albinism in the domestic cat (Felis catus) is associated with a tyrosinase (TYR) mutation.Animal genetics, 37 (2): 175–178.
- ^ http://www.nlm.nih.gov/medlineplus/phenylketonuria.html.
- ^ Rosenthal D. (1964): The Genain quadruplets: a case study and theoretical analysis of heredity and environment in schizophrenia. Basic Books, New York ISBN B0000CM68F.
- ^ http://www.loci.wisc.edu/outreach/text/model.html Arhivirano 13. 3. 2008. na Wayback Machine. The use of model organisms in Instruction University of Wisconsin: Wisconsin Outreach Research Modules
- ^ Lodish et al. (2000): http://www.ncbi.nlm.nih.gov/books/bv.fcgi?highlight=PCR&rid=mcb.section.1718 Chapter 7: 7.7. Polymerase Chain Reaction: An Alternative to Cloning.
- ^ Brown T. A. (2002): Genomes, 2nd edition, Bios, Oxford, ISBN 1-85996-228-9.
- ^ http://www.ncbi.nlm.nih.gov/books/bv.fcgi?rid=genomes.section.6452: Methodology for DNA Sequencing.
- ^ http://www.ornl.gov/sci/techresources/Human_Genome/home.shtml Arhivirano 15. 3. 2008. na Wayback Machine, Human Genome Project Information, Human Genome Project.
Vanjski linkovi
[uredi | uredi izvor]- Genetika u programu In Our Time na BBC. (poslušaj sada) (en)

