Kinezin



Kinezin je protein iz klase motornih proteina koji se nalazi u eukariotskim ćelijama.
Kinezini se kreću duž mikrotubulskih (MT) filamenata i pokreću hidrolizu adenozin trifosfata (ATP), tako da djeluju kao ATPaze. Aktivno kretanje kinezina podržava nekoliko ćelijskih funkcija, uključujući i mitozu, mejozu i transport ćelijskog naboja: kao u aksonskom transportu. Većina kinezina se kreće prema pozitivnom kraju mikrotubule koji, u većini ćelija, podrazumijeva transportirajuće punjenje: kao kod proteina i membranskih komponenti od centra ćelije prema periferiji. Ovaj oblik transporta je poznat kao anterogradni transport. Nasuprot tome, dineini su proteinski motori koji se kreću u pravcu negativnog kraja mikrotubule.
Kinezini[uredi | uredi izvor]
Kinezini su otkriveni kao anterogradni međućelijski transportni motori koji počivaju na fumnkcijasma mikrotubula (MT).[1] Osnivački član ove superfamilije, kinesin-1, izoliran je kao heterotetramerni – brza aksonska organela transportnog motora koja se sastoji od dvije identične motorne podjedinice (KHC) i dva "lahka lanca" (KLC) preko pečišćavanja mikrotubulskog afiniteta neuronskih ekstrakata.[2] Nakon toga su, drugačije usmjereni heterotrimerni plus krajevi, označeni kao kinezin-2, koji sadrže od dva različita KHC vezane motorne podjedinice i dodatnu podjedinicu "KAP", prečišćene do ekstrakta jaja/embriona Echinodermata.[3] a je najpoznatiji je po svojoj ulozi u transportu proteinskog kompleksa (IFT čestice) uz aksoneme tokom biogeneze cilija.[4] Molekulskogenetički i genomski pristupi doveli su do spoznaje da je kinezini čine raznovrsnu natporodicu motora koji su, u eukariota, odgovorni za više unutarćelijskih pokreta .[5][6][7][8] Genom sisara, naprimjer, kodira više 40 kinezinskih proteina,[9] organiziranih u najmanje 14 porodica zvanih, od kinezin-1 do kinezin-14.[10]
Strutura[uredi | uredi izvor]
Sveukupna struktura[uredi | uredi izvor]
Članovi superfamilije kinezina variraju u veličini, ali prototip – kinezin-1 je heterotetramer čije motorne podjedinice (teški lanci ili KHCS) formiraju proteinski dimer (molekulski par) koji veže dva lahka lanca (KLC).
Teški lanac kinezina-1 sadržui loptastu glavu (motorni domen) na kraju amino kraja, priključenu kroz kratki, fleksibilni vratni linker za dršku – dugi, centralni alfa –heliksni spiralno namotani domen – koji završava u C-kraju repnog domena koji ga povezuje sa lahkim lanacims. Peteljkke dva KHCS se prepliću da formiraju spiralnu zavojnicu, što usmjerava dimerizacije dva KHC. U većini slučajeva prevezeni teret se veže za lahke lance kinezina, na TPR motivnu sekvencu PCK, ali u nekim slučajevima teret se veže I za C-krajeve domena teških lanaca.[11]
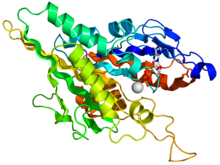
Motorni domen kinezina[uredi | uredi izvor]
| Motorni domen kinezina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identifikatori | |||||||||
| Simbol | Motorni domen kinezina | ||||||||
| Pfam | PF00225 | ||||||||
| InterPro | IPR001752 | ||||||||
| SMART | SM00129 | ||||||||
| PROSITE | PS50067 | ||||||||
| SCOP2 | 1bg2 / SCOPe / SUPFAM | ||||||||
| CDD | cd00106 | ||||||||
| |||||||||
Glava kinezina se može shvatiti kao njegov potpis, a njena aminokiselinska sekvenca je dobro konzervirana među različitim kinesinima. Svaka glava ima dva odvojena mjesta vezanja: jedno za mikrotubule i drugo za ATP. ATP veza i hidroliza, kao i oslobađanje ADP mijenjaju konformaciju domena mikrotubulskog vezanja i orijentaciju vrata – lijevo u odnosu na glavu; to dovodi u kretanja kinezina. Nekoliko strukturnih elemenata glave, uključujući centralni domen beta-stranice i prekidač domena I i II, upleteni su kao posrednici u interakcije između dva vezanja i vratnog domena. Kinezini su strukturno srodni sa G protein ima, koji hidroliziraju GTP, umjesto ATP. Nekoliko konstruktivnih elementa su istovjetni se dijele u dvije porodice, posebno Switch I i Switch II domeni.
Transport tereta[uredi | uredi izvor]
U ćeliji, male molekule, kao što su plinovi i glukoza difundiraju tamo gdje su potrebne. Velike molekule koje su sintetizirane (ćelijske energane) su prevelike (u citosolu) da bi mogle da se difuzno kreću do svojih odredišta. Ulogu transportera velikih tereta do odredišta imaju motoni protein. Kinezini su motorni proteini koji obavljaju takav transport tereta unidirigiranom “šetnjom “, zajedno sa putevima mikrotubula, hidrolizirajući jednu molekulu adenozin trifosfata (ATP) na svakom koraku.[13] Mislilo se da hidroliza ATP snabdijeva energijom svaki korak, otpuštajući energiju i gurajući je prema glavi slijedećeg mjesta vezanja.[14] Međutim, predloženo je da se glava difundira prema naprijed, a snaga vezanja na mikrotubule je ono što vuče zajednički teret.[15] Pored toga, virusa HIV, naprimjer, kinezin se koristi za taloženje virusnih čestica nakon kompletiranja.[16] Postoje značajni dokazi da teret, u uvjetima in vivo, teret prenosi više motora.[17][18][19][20]
Pravac kretanja[uredi | uredi izvor]
Motorni proteini putuju u određenom pravcu duž mikrotubule. To je zato što je mikrotubula polarna, a glava se veže samo na mikrotubule u jednom pravcu, dok vezanje ATP daje svoj pravac na svakom koraku, uz proces poznat kao zipiranje vratnog linkera (na principu “zip-zatvarača” na odjeći, npr.).[21]
Većina kinezina se kreće prema plus kraju mikrotubula što, u većini ćelija, podrazumijeva transport tereta od centra ćelije prema periferiji. Ovaj oblik transporta je poznat kao anterogradni transport / ortrogradni transport. Porodica protein kinezina-14, kao što je kod Drosophila melanogaster, nezaraznih bolesti, pupoljaka kvasaca KAR3 i Arabidopsis thaliana ATK5, idu u suprotnom pravcu, prema minus krajevima mikrotubula.[22]
Poznate su različite vrste proteinskih motora, kao što su dineini, koji se kreću prema minus kraju mikrotubule. Tako se teret transportira sa periferije ćelije prema centru, naprimjer iz vršne dugmadi jednog neuronskog aksona u tijelo ćelije (somu). Ovo je poznato kao retrogradni transport.
Cin8, član porodice kinezina-5, ima novu mogućnost prebacivanja smjera. Dokazano je da je usmjerenje na minus kraj (za razliku od ostatka poznatih kinezina) kada su vezani za jednu mikrotubulu, a plus-kraj podešen na umrežavanje antiparalelnih mikrotubula (pritiskom na minus završavaju udaljeni, a povlačenjem plusa - jedni prema drugima). Ovakvo dualno usmjerenje je uočeno u istim uvjetima u kojima slobodne molecule Cin8 kreću prema kraju minus, ali unakrsno povezani Cin8 kreću prema plus krajevima svake umrežene mikrotubule. Predlaže se da je ova jedinstvena sposobnost rezultat stvaranje spojnice sa drugim Cin8 motorima, što pomaže da ispunie ulogu dineina u pupajućem kvascu.[23]
Predloženi mehanizmi kretanja[uredi | uredi izvor]
Kinezin ostvaruje transport "hodajući" duž mikrotubule. Za objašnjenje ovog kretanja predložena su dva mehanizma.
- U mehanizmu "dlan-o-dlan”, kinezinske glave naizmjenično idu jedna duž druge (poput traljanja dlanova), u vodećoj poziciji.
- Mehanizam "glista " podrazumijeva de kinezinska glava uvijek vodi, napreduje korak prije nego što joj priđu prateći dijelovi (poput kretanja kišne gliste).
Uprkos nekim preostalim kontroverzama, eksperimentalni dokazi ukazuju da je prvopomenuti mehanizam vjerovatniji.[24][25]
Vezanje i hidroliza ATP uzrokuju da kinezin putuje u vidu "mehanizma klackalice" oko tačke nosača.[26][27] Ovaj mehanizam počiva na zapažanju da je vezanje ATP na ne-nukleotidno, stanje vezanja mikrotubule dovodi do naginjanja domena kinezinskih motora u odnosu na mikrotubule. Prije ovog naginjanja , linker vrata nije u stanju da spoji svoju vezanu motornu glavu prema konformaciji naprijed. Naginjanje koje izaziva ATP, pruža mogućnost za vratni linker da uđe u ovu konformaciju. Ovaj model je baziran na Cryo-EM modeluima mikrotubulski vezanih struktura kinezina koji predstavljaju početak i kraj stanja procesa, ali ne može riješiti precizne detalje tranzicije između struktura.
Teorijsko modeliranje kinezina[uredi | uredi izvor]
Predloženi su brojni teorijski modele molekulskih motora kinezinskih proteina.[28][29][30] U teorijskim istraživanjima susreću se mnogi izazovi, s obzirom na preostale nesigurnosti o ulozi proteinskih struktura, preciznost način pretvaranja hemijske energije ATP u mehanički rad, kao I uloge kojeimaju termalne fluktuacije. Ovo je prilično aktivno područje istraživanja. Postoji posebna potreba za pristupima koji bolje nalaze vezu sa molekulskom arhitekturom proteina i podaima koji su dobijeni iz eksperimentalnih istraživanja.
Kinezin i mitoza[uredi | uredi izvor]
U posljednjih nekoliko godina, utvrđeno je da molekulski motori koji počivaju na mikrotubulama (uključujući i broj kinezina) imaju značajnu ulogu u mitozi (tj. ćelijskoj diobi, uopće). Kinezini su važni za pravilnu dužinu diobenog vretena i da budu uključeni i u klizne mikrotubule osim vretena, tokom prometafaze i metafaze, kao i depolizirajuće minus krajeve mikrotubulnih centrosoma tokom anafaza.< ref name="Goshima">Goshima G, Vale RD (august 2005). "Cell cycle-dependent dynamics and regulation of mitotic kinesins in Drosophila S2 cells". Mol. Biol. Cell. 16 (8): 3896–907. doi:10.1091/mbc.E05-02-0118. PMC 1182325. PMID 15958489.CS1 održavanje: upotreba parametra authors (link)</ref> Posebno, porodica proteia kinezina-5 djeluje unutar odvjenih mikrotubula vretena, dok porodica kinezina 13 djeluje na depolimerizaciju mikrotubula.
Odavno je, međutim, poznato, da kinezini učestvuju u formiranju i regulaciji funkcije, kako niti, tako i poluniti diobenog vretena, odnosno kinetici hromosoma tokom ćelijskih dioba.[31][32][33][34]
Članovi superfamilije kinezina[uredi | uredi izvor]
Superfamilija ljudskih kinezina uključije sljedeće proteine, čija je je nomenklatura razvijena i standardizirana u zajednici istraživača kinezina. Razvrstali su u 14 porodica pod nazivima, od kinezin-1 do kinezin-14:
- 1A – KIF1A, 1B – KIF1B, 1C – KIF1C = kinezin-3
- 2A – KIF2A, 2C – KIF2C = kinesin-13
- 3B – KIF3B or 3C – KIF3C ,3A - KIF3A = kinezin-2
- 4A – KIF4A, 4B – KIF4B = kinezin-4
- 5A – KIF5A, 5B – KIF5B, 5C – KIF5C = kinezin-1
- 6 – KIF6 = kinezin-9
- 7 – KIF7 = kinezin-4
- 9 – KIF9 = kinezin-9
- 11 – KIF11 = kinezin-5
- 12 – KIF12 = kinesin-12
- 13A – KIF13A, 13B – KIF13B = kinezin-3
- 14 – KIF14 = kinezin-3
- 15 – KIF15 = kinezin-12
- 16B – KIF16B = kinezin-3
- 17 – KIF17 = kinezin-2
- 18A – KIF18A, 18B – KIF18B = kinezin-8
- 19 – KIF19 = kinezin-8
- 20A – KIF20A, 20B – KIF20B = kinezin-6
- 21A – KIF21A, 21B – KIF21B = kinezin-4
- 22 – KIF22 = kinezin-10
- 23 – KIF23 = kinezin-6
- 24 – KIF24 = kinezin-13
- 25 – KIF25 = kinezin-14
- 26A – KIF26A, 26B – KIF26B = kinezin-11
- 27 – KIF27 = kinezin-4
- C1 – KIFC1, C2 – KIFC2, C3 – KIFC3 = kinezin-14
Laki lanci kinezina-1:
Asocirani proteini kinezina-2:
- KAP-1, KAP3 or KIFAP3
Također pogledajte[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ Vale RD (2003). "The molecular motor toolbox for intracellular transport". Cell. 112 (4): 467–80. doi:10.1016/S0092-8674(03)00111-9. PMID 12600311.
- ^ Vale RD, Reese TS, Sheetz MP (1985). "Identification of a novel force-generating protein, kinesin, involved in microtubule-based motility". Cell. 42 (1): 39–50. doi:10.1016/S0092-8674(85)80099-4. PMC 2851632. PMID 3926325.CS1 održavanje: upotreba parametra authors (link)
- ^ Cole DG, Chinn SW, Wedaman KP, Hall K, Vuong T, Scholey JM (1993). "Novel heterotrimeric kinesin-related protein purified from sea urchin eggs". Nature. 366 (6452): 268–70. doi:10.1038/366268a0. PMID 8232586.CS1 održavanje: upotreba parametra authors (link)
- ^ Rosenbaum JL, Witman GB (2002). "Intraflagellar transport". Nat. Rev. Mol. Cell Biol. 3 (11): 813–25. doi:10.1038/nrm952. PMID 12415299.CS1 održavanje: upotreba parametra authors (link)
- ^ Yang JT, Laymon RA, Goldstein LS (mart 1989). "A three-domain structure of kinesin heavy chain revealed by DNA sequence and microtubule binding analyses". Cell. 56 (5): 879–89. doi:10.1016/0092-8674(89)90692-2. PMID 2522352.CS1 održavanje: upotreba parametra authors (link)
- ^ Aizawa H, Sekine Y, Takemura R, Zhang Z, Nangaku M, Hirokawa N (decembar 1992). "Kinesin family in murine central nervous system". J. Cell Biol. 119 (5): 1287–96. doi:10.1083/jcb.119.5.1287. PMC 2289715. PMID 1447303.CS1 održavanje: upotreba parametra authors (link)
- ^ Enos AP, Morris NR (1990). "Mutation of a gene that encodes a kinesin-like protein blocks nuclear division in A. nidulans". Cell. 60 (6): 1019–27. doi:10.1016/0092-8674(90)90350-N. PMID 2138511.CS1 održavanje: upotreba parametra authors (link)
- ^ Meluh PB, Rose MD (1990). "KAR3, a kinesin-related gene required for yeast nuclear fusion". Cell. 60 (6): 1029–41. doi:10.1016/0092-8674(90)90351-E. PMID 2138512.
- ^ Hirokawa N, Noda Y, Tanaka Y, Niwa S (2009). "Kinesin superfamily motor proteins and intracellular transport". Nat. Rev. Mol. Cell Biol. 10 (10): 682–96. doi:10.1038/nrm2774. PMID 19773780.CS1 održavanje: upotreba parametra authors (link)
- ^ Lawrence CJ, Dawe RK, Christie KR, Cleveland DW, Dawson SC, Endow SA, Goldstein LS, Goodson HV, Hirokawa N, Howard J, Malmberg RL, McIntosh JR, Miki H, Mitchison TJ, Okada Y, Reddy AS, Saxton WM, Schliwa M, Scholey JM, Vale RD, Walczak CE, Wordeman L (oktobar 2004). "A standardized kinesin nomenclature". J. Cell Biol. 167 (1): 19–22. doi:10.1083/jcb.200408113. PMC 2041940. PMID 15479732.CS1 održavanje: upotreba parametra authors (link)
- ^ Hirokawa N, Pfister KK, Yorifuji H, Wagner MC, Brady ST, Bloom GS (mart 1989). "Submolecular domains of bovine brain kinesin identified by electron microscopy and monoclonal antibody decoration". Cell. 56 (5): 867–78. doi:10.1016/0092-8674(89)90691-0. PMID 2522351.CS1 održavanje: upotreba parametra authors (link)
- ^ PDB 1BG2; Kull FJ, Sablin EP, Lau R, Fletterick RJ, Vale RD (1996). "Crystal structure of the kinesin motor domain reveals a structural similarity to myosin". Nature. 380 (6574): 550–5. Bibcode:1996Natur.380..550J. doi:10.1038/380550a0. PMC 2851642. PMID 8606779.CS1 održavanje: upotreba parametra authors (link)
- ^ Schnitzer MJ, Block SM (1997). "Kinesin hydrolyses one ATP per 8-nm step". Nature. 388 (6640): 386–390. doi:10.1038/41111. PMID 9237757.CS1 održavanje: upotreba parametra authors (link)
- ^ Vale RD, Milligan RA (april 2000). "The way things move: looking under the hood of molecular motor proteins". Science. 288 (5463): 88–95. Bibcode:2000Sci...288...88V. doi:10.1126/science.288.5463.88. PMID 10753125.
- ^ Mather WH, Fox RF (2006). "Kinesin's biased stepping mechanism: amplification of neck linker zippering". Biophys. J. 91 (7): 2416–26. doi:10.1529/biophysj.106.087049. PMC 1562392. PMID 16844749.CS1 održavanje: upotreba parametra authors (link)
- ^ Gaudin, Raphaël (2012). "Critical role for the kinesin KIF3A in the HIV life cycle in primary human macrophages". J Cell Biol. 199 (3): 467–479. doi:10.1083/jcb.201201144.
- ^ Gross SP, Vershinin M, Shubeita GT (juni 2007). "Cargo transport: two motors are sometimes better than one". Current Biology. 17 (12): R478–86. doi:10.1016/j.cub.2007.04.025. PMID 17580082.CS1 održavanje: upotreba parametra authors (link)
- ^ Hancock WO (august 2008). "Intracellular transport: kinesins working together". Current Biology. 18 (16): R715–7. doi:10.1016/j.cub.2008.07.068. PMID 18727910.
- ^ Kunwar A, Vershinin M, Xu J, Gross SP (august 2008). "Stepping, strain gating, and an unexpected force-velocity curve for multiple-motor-based transport". Current Biology. 18 (16): 1173–83. doi:10.1016/j.cub.2008.07.027. PMC 3385514. PMID 18701289.CS1 održavanje: upotreba parametra authors (link)
- ^ Klumpp S, Lipowsky R (novembar 2005). "Cooperative cargo transport by several molecular motors". Proceedings of the National Academy of Sciences of the United States of America. 102 (48): 17284–9. arXiv:q-bio/0512011. doi:10.1073/pnas.0507363102. PMC 1283533. PMID 16287974.CS1 održavanje: upotreba parametra authors (link)
- ^ Rice S, Lin AW, Safer D, Hart CL, Naber N, Carragher BO, Cain SM, Pechatnikova E, Wilson-Kubalek EM, Whittaker M, Pate E, Cooke R, Taylor EW, Milligan RA, Vale RD (1999). "A structural change in the kinesin motor protein that drives motility". Nature. 402 (6763): 778–84. doi:10.1038/45483. PMID 10617199.CS1 održavanje: upotreba parametra authors (link)
- ^ Ambrose JC, Li W, Marcus A, Ma H, Cyr R (april 2005). "A minus-end-directed kinesin with plus-end tracking protein activity is involved in spindle morphogenesis". Mol. Biol. Cell. 16 (4): 1584–92. doi:10.1091/mbc.E04-10-0935. PMC 1073643. PMID 15659646.CS1 održavanje: upotreba parametra authors (link)
- ^ Roostalu, J.; Hentrich, C.; Bieling, P.; Telley, I. A.; Schiebel, E.; Surrey, T. (2011). "Directional Switching of the Kinesin Cin8 Through Motor Coupling". Science. 332 (6025): 94–99. doi:10.1126/science.1199945.
- ^ Yildiz A, Tomishige M, Vale RD, Selvin PR (2004). "Kinesin Walks Hand-Over-Hand". Science. 303 (5658): 676–8. Bibcode:2004Sci...303..676Y. doi:10.1126/science.1093753. PMID 14684828.CS1 održavanje: upotreba parametra authors (link)
- ^ Asbury CL (2005). "Kinesin: world's tiniest biped". Current Opinion in Cell Biology. 17 (1): 89–97. doi:10.1016/j.ceb.2004.12.002. PMID 15661524.
- ^ Sindelar CV, Downing KH (2010). "An atomic-level mechanism for activation of the kinesin molecular motors". Proc Natl Acad Sci U S A. 107 (9): 4111–6. doi:10.1073/pnas.0911208107. PMC 2840164. PMID 20160108.CS1 održavanje: upotreba parametra authors (link)
- ^ Lay Summary (2010). "Life's smallest motor, cargo carrier of the cells, moves like a seesaw". PhysOrg.com.
- ^ Atzberger PJ, Peskin CS (2006). "A Brownian Dynamics model of kinesin in three dimensions incorporating the force-extension profile of the coiled-coil cargo tether". Bull. Math. Biol. 68 (1): 131–60. doi:10.1007/s11538-005-9003-6. PMID 16794924.CS1 održavanje: upotreba parametra authors (link)
- ^ Peskin CS, Oster G (1995). "Coordinated hydrolysis explains the mechanical behavior of kinesin". Biophys. J. 68 (4 Suppl): 202S–210S, discussion 210S–211S. PMC 1281917. PMID 7787069.CS1 održavanje: upotreba parametra authors (link)
- ^ Mogilner A, Fisher AJ, Baskin RJ (2001). "Structural changes in the neck linker of kinesin explain the load dependence of the motor's mechanical cycle". J. Theor. Biol. 211 (2): 143–57. doi:10.1006/jtbi.2001.2336. PMID 11419956.CS1 održavanje: više imena: authors list (link)
- ^ Campbell N. A.; et al. (2008). Biology. 8th Ed. Person International Edition, San Francisco. ISBN 978-0-321-53616-7. Eksplicitna upotreba et al. u:
|author=(pomoć) - ^ Sofradžija A., Šoljan D., Hadžiselimović R. (2004). Biologija 1. Svjetlost, Sarajevo. ISBN 9958-10-686-8.CS1 održavanje: više imena: authors list (link)
- ^ Alberts B.; et al. (2002). Molecular Biology of the Cell, 4th Ed. Garland Science. ISBN 0-8153-4072-9. Eksplicitna upotreba et al. u:
|author=(pomoć) - ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Eds. (2005). Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB) Sarajevo. ISBN 9958-9344-1-8.CS1 održavanje: više imena: authors list (link)
Dopunska literatura[uredi | uredi izvor]
- Lawrence CJ, Dawe RK, Christie KR, Cleveland DW, Dawson SC, Endow SA, Goldstein LS, Goodson HV, Hirokawa N, Howard J, Malmberg RL, McIntosh JR, Miki H, Mitchison TJ, Okada Y, Reddy AS, Saxton WM, Schliwa M, Scholey JM, Vale RD, Walczak CE, Wordeman L (oktobar 2004). "A standardized kinesin nomenclature". J. Cell Biol. 167 (1): 19–22. doi:10.1083/jcb.200408113. PMC 2041940. PMID 15479732.CS1 održavanje: upotreba parametra authors (link)
Vanjski linkovi[uredi | uredi izvor]
- MBInfo - Kinesin transports cargo along microtubules Arhivirano 25. 3. 2016. na Wayback Machine
- Animated model of kinesin walking
- Ron Vale's seminar:"Cytoskeletal Motor Proteins"
- Animation of kinesin movement ASCB image library
- Murphy, V.F. (12. 5. 2004). "Microtubule Based Movement". tissue.medicalengineer.co.uk. Arhivirano s originala, 22. 7. 2007. Pristupljeno 10. 12. 2015.
- The Inner Life of a Cell, 3D animation featuring a Kinesin transporting a vesicle Arhivirano 7. 12. 2008. na Wayback Machine
- The Kinesin Homepage
| Kinesin na Wikimedia Commonsu. |

