Koštanomorfogenetski proteini
Koštanomorfogenetski proteini (BMP) su grupa faktora rasta također poznatih kao citokini i kao metabologeni.[1] Prvobitno otkriveni svojom sposobnošću da induciraju formiranje kostiju i hrskavica, za BMP se sada smatra da čine grupu ključnih morfogenetskih signala, orkestrirajući arhitekturu tkiva u cijelom tijelu.[2] Važno funkcioniranje BMP signala u fiziologiji je naglašeno mnoštvom uloga disregulirane BMP signalizacije u patološkim procesima. Kancerozna bolest često uključuje pogrešnu regulaciju BMP signalnog sistema. Odsustvo signalizacije BMP-a je, naprimjer, važan faktor u progresiji raka debelog crijeva,[3] i obrnuto, prekomjerna aktivacija BMP signalizacije nakon refluksom izazvanog ezofagitisa provocira bolest zvanu Barrettov jednjak i stoga je ključna u razvoju adenokarcinoma jednjaka.[4]
Rekombinantni humani BMP (rhBMP) koriste se u ortopedskim aplikacijama kao što su spinalna fuzija, neunioni i oralna hirurgija. Američka agencija za hranu i lijekove (FDA) odobrila je rhBMP-2 i rhBMP-7 su odobreni za neke namjene. rhBMP-2 uzrokuje više obrasle kosti nego bilo koji drugi BMP i široko se koristie.
Medicinska upotreba
[uredi | uredi izvor]BMP za kliničku upotrebu proizvode se primjenom tehnologije rekombinantne DNK (rekombinantni ljudski BMP; rhBMP). Rekombinantni BMP-2 i BMP-7 odobreni su za upotrebu kod ljudi.
rhBMP se koriste u oralnoj hirurgiji.[5][6][7] BMP-7 je također nedavno pronašao primjenu u liječenju hronične bolesti bubrega (CKD). Pokazalo se da BMP-7 na mišjim životinjskim modelima poništava gubitak glomerul zbog skleroze.
Neetiketirana upotreba
[uredi | uredi izvor]Iako se rhBMP-2 i rhBMP-7 koriste u liječenju različitih stanja povezanih s kostima, uključujući spinalnu fuziju i neunionazor, rizici ovog tretmana koji nisu propisani nisu shvaćeni.[8] Dok su rhBMP odobreni za specifične primjene (spinalne slabinske fuzije s prednjim pristupom i neraspoloženim tibijama), do 85% cjelokupne upotrebe BMP-a je neetiketirano.[8] rhBMP-2 koristi se široko u drugim tehnikama fuzije lijećenja slabinske kičme (npr. korištenjem stražnjeg pristupa, prednjih ili stražnjih vratnopršljenskih fuzija[8]).
Alternativa autotransplantatu kod neizraslih dugih kostiju
[uredi | uredi izvor]Američka Uprava za hranu i lijekove (FDA) je 2001. odobrila rhBMP-7 (kao OP-1; Stryker Corporation - Stryker Biotech) za izuzeće kao humanitarnig uređaja, alternativu autotranspslantat u kod neraspoloživih dugih kostiju.[8] 2004. godine, izuzeće od humanitarnog uređaja prošireno je kao alternativa autograftu za posterolateralnu fuziju.[8] Godine 2002, rhBMP-2 (Infuse; Medtronic) odobren je za prednje slabinske međutjelesne fuzije (ALIF) sa uređajem za slabnsku fuziju.[8] 2008. odobren je za popravak posterolateralne slabinske pseudartroze, otvorene frakture tibijske osovine sa fiksacijom unutarmedulskim noktom.[8] U ovim proizvodima, BMP se isporučuju na mjesto fraktura, tako što se ugrađuje u koštani implantat i postepeno oslobađaju, kako bi se omogućilo formiranje kosti, jer stimulacija rasta BMP-ima mora biti lokalizirana i održavana nekoliko sedmica. BMP-ovi se eluiraju pročišćenim kolagenskim matriksom koji se implantira na mjesto prijeloma.[9] rhBMP-2 pomaže u rastu kosti bolje od bilo kojeg drugog rhBMP-a, tako da se klinički mnogo više koristi.[9] Postoji "malo debata ili kontroverzi" o efikasnosti rhBMP-2 za rast kosti radi postizanja fuzije kičme,[9] i Medtronic generira 700 miliona dolara godišnje od prodaje svojih proizvoda.[10]
Kontraindikacije
[uredi | uredi izvor]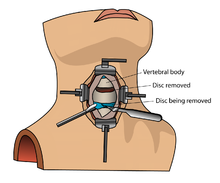
Koštanomorfogenetski protein (rhBMP) ne bi se trebao rutinski koristiti u bilo kojem tipu fuzije prednjeg dijela vratne kičme, kao što je prednja vratna diskektomija i fuzija.[11] Postoje izvještaji o ovoj terapiji koja uzrokuje oticanje mehkog tkiva što zauzvrat može uzrokovati komplikacije opasne po život zbog poteškoća pri gutanju i pritiska na respiratorni trakt.[11]
Funkcija
[uredi | uredi izvor]BMP stupaju u interakciju sa specifičnim receptorima na površini ćelije, koji se nazivaju receptori koštanomorfogenetskih proteina (BMPRs).
Transdukcija signala kroz BMPR rezultira mobilizacijom članova porodice proteina SMAD. Signalni putevi koji uključuju BMP, BMPR i SMAD važni su u razvoju srca, centralnog nervnog sistema i hrskavice, kao i postneonatusnog razvoja kostiju.
Oni imaju važnu ulogu tokom embrionskog razvoja na embrijski obrazac i ranu formaciju skeleta. Kao takav, poremećaj signalizacije BMP može uticati na tjelesni plan embrija u razvoju. Naprimjer, BMP4 i njegovi inhibitori nogin i hordin pomažu u regulaciji polarnosti embriona (tj. obrasca od leđa prema naprijed). Konkretno, BMP-4 i njegovi inhibitori imaju glavnu ulogu u neurulaciji i razvoju nervne ploče. BMP-4 signalizira ektodermskim ćelijama da se razviju u ćelije kože, ali lučenje inhibitora iz mezoderma u osnovi blokira djelovanje BMP-4, kako bi se omogućilo ektodermu da nastavi svojim normalnim tokom razvoja nervnih ćelija. Osim toga, lučenje BMP-a krovne ploče u kičmenoj moždini u razvoju pomaže u određivanju dorzalnih senzornih interneurona.[12]
Kao član natporodice beta transformirajućih faktora rasta, BMP signalizacija reguliše različite embrijske obrasce tokom fetusnog i embrionskog razvoja. Naprimjer, signalizacija BMP-a kontrolira ranu formaciju Mullerovog kanala (MD) koji je cjevasta struktura u ranoj fazi embrijskog razvoja i na kraju postaje ženski reproduktivni trakt. Hemijska inhibicija BMP signala u kokošijem embriju izazvala je poremećaj invaginacije MD i blokirala zadebljanje epitela u regiji koja formira MD, što ukazuje da signali BMP imaju ulogu u ranom razvoju MD.[13] Štaviše, BMP signalizacija je uključena u formiranje prednjeg i stražnjeg crijeva,[14] uzorkovanje crijevnih resica i endokardnu diferencijaciju. Resice doprinose povećanju efikasne apsorpcije hranljivih materija, širenjem površine tankog crijeva. Pojačavanje ili gubitak funkcije signalizacije BMP-a promijenilo je oblikovanje klastera i pojavu resica u intestinalnom modelu miša.[15] BMP signal izveden iz miokarda je također uključen u endokardnu diferencijaciju tokom razvoja srca. Inhibirani BMP signal u embrijskom modelu zebrice uzrokovao je snažno smanjenje endokardne diferencijacije, ali je imao samo mali učinak na razvoj miokarda.[16] Osim toga, preslušavanje Notch-Wnt-Bmp potrebno je za radijalno oblikovanje tokom razvoja pužnica miša na antagonizirajući način.[17]
Mutacije u BMP i njihovim inhibitorima povezane su s brojnim ljudskim poremećajima koji utiču na skelet.
Nekoliko BMP se također naziva 'morfogenetski proteini izvedeni iz hrskavice' (CDMP), dok se drugi nazivaju faktor diferencijacije rasta (GDF).
BMP su također uključeni u adipogenezu i funkcionalnu regulaciju masnog tkiva.[18] BMP4 favors white adipogenesis, whereas BMP7 activates brown fat functionality; BMP inhibitors are also involved in this regulation [18]
Tipovi
[uredi | uredi izvor]
Prvobitno je otkriveno sedam takvih proteina. Od njih, šest (BMP2 do BMP7) pripada natporodici protein transformirajućih faktora rasta. BMP1 je metaloproteaza. Od tada je otkriveno još trinaest BMP-ova, koji su svi u TGF-beta porodici, čime je ukupan broj porastao na dvadeset.[9] Sadašnjaa nomenklatura prepoznaje samo 13, jer su mnogi drugi stavljeni pod naziv faktora diferencijacije rasta.
| BMP | Poznate funkcije | Genski lokus |
|---|---|---|
| BMP1 | BMP1 ne pripada TGF-β porodici proteina. To je metaloproteaza koja djeluje na prokolagen I, II i III. Učestvuje u razvoju hrskavice. | Hromosom: 8; Lokacija: 8p21 |
| BMP2 | Djeluje kao disulfidni vezani homodimer i inducira formiranje kostiju i hrskavice. Kandidat je za medijatora retinoida. Ima ključnu ulogu u diferencijaciji osteoblasta. | Hromosom: 20; Lokacija: 20p12 |
| BMP3 | Indukuje formiranje kostiju. | Hromosom: 14; Lokacija: 14p22 |
| BMP4 | Reguliše formiranje zuba, udova i kostiju iz mezoderma. Također ima ulogu u sanaciji prijeloma, formiranju epiderme, formiranju dorzalno-ventralne ose i razvoju jajničkih folikula. | Hromosom: 14; Lokacija: 14q22-q23 |
| BMP5 | Obavlja funkcije u razvoju hrskavice. | Hromosom: 6; Lokacija: 6p12.1 |
| BMP6 | Ima ulogu u integritetu zglobova kod odraslih. Kontroliše homeostazu gvožđa, regulacijom hepcidina. | Hromosom: 6; Lokacija: 6p12.1 |
| BMP7 | Ima ključnu ulogu u diferencijaciji osteoblasta. Indukuje proizvodnju SMAD1. Takođe je ključan za razvoj i popravku bubrega. | Hromosom: 20; Lokacija: 20q13 |
| BMP8a | Učestvuje u razvoju kostiju i hrskavice. | Hromosom: 1; Lokacija: 1p35–p32 |
| BMP8b | Eksprimiran u hipokampusu. | Hromosom: 1; Lokacija: 1p35–p32 |
| BMP10 | Može imati ulogu u trabekulaciji embrijskog srca. | Hromosom: 2; Lokacija: 2p14 |
| BMP11 | Kontroliše anteriorno-posteriorno oblikovanje. | Hromosom: 12; Lokacija: 12p |
| BMP15 | Može imati ulogu u razvoju oocita i folikula. | Hromosom: X; Lokacija: Xp11.2 |
Reference
[uredi | uredi izvor]- ^ Reddi AH, Reddi A (2009). "Bone morphogenetic proteins (BMPs): from morphogens to metabologens". Cytokine & Growth Factor Reviews. 20 (5–6): 341–2. doi:10.1016/j.cytogfr.2009.10.015. PMID 19900831.
- ^ Bleuming SA, He XC, Kodach LL, Hardwick JC, Koopman FA, Ten Kate FJ, van Deventer SJ, Hommes DW, Peppelenbosch MP, Offerhaus GJ, Li L, van den Brink GR (Sep 2007). "Bone morphogenetic protein signaling suppresses tumorigenesis at gastric epithelial transition zones in mice". Cancer Research. 67 (17): 8149–55. doi:10.1158/0008-5472.CAN-06-4659. PMID 17804727.
- ^ Kodach LL, Wiercinska E, de Miranda NF, Bleuming SA, Musler AR, Peppelenbosch MP, Dekker E, van den Brink GR, van Noesel CJ, Morreau H, Hommes DW, Ten Dijke P, Offerhaus GJ, Hardwick JC (maj 2008). "The bone morphogenetic protein pathway is inactivated in the majority of sporadic colorectal cancers". Gastroenterology. 134 (5): 1332–41. doi:10.1053/j.gastro.2008.02.059. PMID 18471510.
- ^ Milano F, van Baal JW, Buttar NS, Rygiel AM, de Kort F, DeMars CJ, Rosmolen WD, Bergman JJ, VAn Marle J, Wang KK, Peppelenbosch MP, Krishnadath KK (Jun 2007). "Bone morphogenetic protein 4 expressed in esophagitis induces a columnar phenotype in esophageal squamous cells". Gastroenterology. 132 (7): 2412–21. doi:10.1053/j.gastro.2007.03.026. PMID 17570215.
- ^ "Medtronic Receives Approval to Market Infuse Bone Graft for Certain Oral Maxillofacial And Dental Regenerative Applications". Arhivirano s originala, 16. 3. 2012. Pristupljeno 19. 1. 2011.
- ^ Wikesjö UM, Qahash M, Huang YH, Xiropaidis A, Polimeni G, Susin C (Aug 2009). "Bone morphogenetic proteins for periodontal and alveolar indications; biological observations - clinical implications". Orthodontics & Craniofacial Research. 12 (3): 263–270. doi:10.1111/j.1601-6343.2009.01461.x. PMID 19627529. Arhivirano s originala, 5. 1. 2013.
- ^ Moghadam HG, Urist MR, Sandor GK, Clokie CM (Mar 2001). "Successful mandibular reconstruction using a BMP bioimplant". The Journal of Craniofacial Surgery. 12 (2): 119–127. doi:10.1097/00001665-200103000-00005. PMID 11314620.
- ^ a b c d e f g Ong KL, Villarraga ML, Lau E, Carreon LY, Kurtz SM, Glassman SD (Sep 2010). "Off-label use of bone morphogenetic proteins in the United States using administrative data". Spine. 35 (19): 1794–800. doi:10.1097/brs.0b013e3181ecf6e4. PMID 20700081. S2CID 11664755.
- ^ a b c d Even J, Eskander M, Kang J (Sep 2012). "Bone morphogenetic protein in spine surgery: current and future uses". The Journal of the American Academy of Orthopaedic Surgeons. 20 (9): 547–52. doi:10.5435/JAAOS-20-09-547. PMID 22941797.
- ^ John Fauber (22. 10. 2011). "Doctors didn't disclose spine product cancer risk in journal". Milwaukee Journal Sentinel. Pristupljeno 12. 5. 2013.
- ^ a b North American Spine Society (februar 2013), "Five Things Physicians and Patients Should Question", Choosing Wisely: an initiative of the ABIM Foundation, North American Spine Society, arhivirano s originala, 11. 11. 2013, pristupljeno 25. 3. 2013, which cites
- Schultz, Daniel G. (1. 7. 2008). "Public Health Notifications (Medical Devices) - FDA Public Health Notification: Life-threatening Complications Associated with Recombinant Human Bone Morphogenetic Protein in Cervical Spine Fusion". Food and Drug Administration. Pristupljeno 25. 3. 2014.
- Woo EJ (Oct 2012). "Recombinant human bone morphogenetic protein-2: adverse events reported to the Manufacturer and User Facility Device Experience database". The Spine Journal. 12 (10): 894–9. doi:10.1016/j.spinee.2012.09.052. PMID 23098616.
- ^ Andrews, Madeline (19. 9. 2017). "BMPs direct sensory interneuron identity in the developing spinal cord using signal- specific not morphogenic activities". eLife. 6. doi:10.7554/eLife.30647. PMC 5605194. PMID 28925352.
- ^ Yuji, Yoshiko (2016). "Early formation of the Mullerian duct is regulated by sequential actions of BMP/Pax2 and FGF/Lim1 signaling". Development. 143 (19): 3549–3559. doi:10.1242/dev.137067. PMID 27578782.
- ^ Mariana, et al. (2017). "Genomic integration of Wnt/β-catenin and BMP/Smad1 signaling coordinates foregut and hindgut transcriptional programs". Development. 144 (7): 1283–1295. doi:10.1242/dev.145789. PMC 5399627. PMID 28219948.
- ^ Katherine, et al. (2016). "Villification in the mouse: Bmp signals control intestinal villus patterning". Development. 143 (3): 427–436. doi:10.1242/dev.130112. PMC 4760312. PMID 26721501.
- ^ Sharina, et al. (2015). "Myocardium and BMP signaling are required for endocardial differentiation". Development. 142 (13): 2304–2315. doi:10.1242/dev.118687. PMC 4510589. PMID 26092845.
- ^ Vidhya, et al. (2016). "Notch-Wnt-Bmp crosstalk regulates radial patterning in the mouse cochlea in a spatiotemporal manner". Development. 143 (21): 4003–4015. doi:10.1242/dev.139469. PMC 5117145. PMID 27633988.
- ^ a b Blázquez-Medela, Ana M.; Jumabay, Medet; Boström, Kristina I. (4. 1. 2019). "Beyond the bone: Bone morphogenetic protein signaling in adipose tissue". Obesity Reviews. 20 (5): 648–658. doi:10.1111/obr.12822. ISSN 1467-789X. PMC 6447448. PMID 30609449.
- ^ Ducy P, Karsenty G (2000). "The family of bone morphogenetic proteins". Kidney Int. 57 (6): 2207–14. doi:10.1046/j.1523-1755.2000.00081.x. PMID 10844590.
Dopunska literatura
[uredi | uredi izvor]- Reddi AH (1997). "Bone morphogenetic proteins: an unconventional approach to isolation of first mammalian morphogens". Cytokine Growth Factor Rev. 8 (1): 11–20. doi:10.1016/S1359-6101(96)00049-4. PMID 9174660.
- Bessa PC, Casal M, Reis RL (Jan 2008). "Bone morphogenetic proteins in tissue engineering: the road from the laboratory to the clinic, part I (basic concepts)". Journal of Tissue Engineering and Regenerative Medicine. 2 (1): 1–13. doi:10.1002/term.63. hdl:1822/13420. PMID 18293427. S2CID 13038950. Arhivirano s originala, 18. 10. 2012.
Vanjski linkovi
[uredi | uredi izvor]- BMP: The What and the Who Arhivirano 13. 1. 2010. na Wayback Machine
- BMPedia - the Bone Morphogenetic Protein Wiki
- Bone Morphogenetic Proteins na US National Library of Medicine Medical Subject Headings (MeSH)
- Chen D, Zhao M, Mundy GR (Dec 2004). "Bone morphogenetic proteins". Growth Factors (Chur, Switzerland). 22 (4): 233–241. doi:10.1080/08977190412331279890. PMID 15621726. S2CID 22932278.
- Cheng H, Jiang W, Phillips FM, Haydon RC, Peng Y, Zhou L, Luu HH, An N, Breyer B, Vanichakarn P, Szatkowski JP, Park JY, He TC (Aug 2003). "Osteogenic activity of the fourteen types of human bone morphogenetic proteins (BMPs)". The Journal of Bone and Joint Surgery. American Volume. 85-A (8): 1544–52. doi:10.2106/00004623-200308000-00017. PMID 12925636. link

