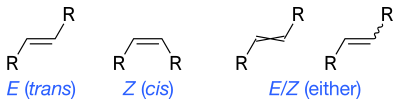Skeletna formula

Skeletna formula – ponekad zvana i linijsko-uglovna formula – organskog spoja je tip of molekulske strukturne formule koja ukratko predstavlja strukturno vezanje molekule i neke detalje njene molekulske geometrije. Prikazuje se dvodimenzijski, kao na stranici papira. Uključuje uvažavanje određenih konvencija za prikazivanje atoma ugljika i vodik, koji su najučestaliji i organskoj hemiji.
Tehniku je u organskoj hemiji razvio Friedrich August Kekulé von Stradonitz. Skeletne formule postale su sveprisutne u organskoj hemiji, dijelom i zato što se relativno brzo i jednostavno crtaju. Njihovi atomi obično se prikazuju kao crta koja završava ili sa vrhovima, uz pretpostavku da svi ugljikovi atomi imaju valenciju 4, a ugljik-vodik veze, obično nisu prikazane eksplicitno, pretpostavljajući da kompletiraju svaku C valenciju. Skeletna formula pokazuje skeletnu strukturu ili skelet molekule, koji se sastoji od skeletnih atoma koji čine molekulu.[1][2][3]
Iako Haworthove i Fischerove projekcije izgledaju slično skeletnim formulama, postoje razlike u korištenim konvencijama, koje posmatrač treba biti svjestan kako bi razumio pojedinosti molekule.
Skelet
[uredi | uredi izvor]Skeletna struktura organskog spoja je serija vezanih atoma, koje čine bitne strukture spoja. Kostur se sastoji od lanaca, grana i / ili prstenova spojenih atoma. Skeletni atomi osim ugljika ili vodika nazivaju se "heteroatomi".[4]
Za atome skeleta vezani su atomi vodika i/ili raznih supstituenatae. Vodik je najuobičajeniji neugljični atom koji se veže za ugljik, pojednostavljeno, nije eksplicitno ucrtan (u prikaz). Osim toga, atomi ugljika uglavnom nisu označeni kao takvi izravno (tj. sa "C"), a heteroatomi uvijek izričito navedeni kao takvi (tj. pomoću "N" za dušik, "O" za kisik itd). Heteroatomi i druge grupe atoma koje dovode do relativno visoke stope hemijske reaktivnosti, odnosno uvođenje posebnih i zanimljivih karakteristika u spektru spojeva nazivaju se funkcijske grupe, jer oni daju molekuli funkciju. Heteroatomi i funkcijske grupe poznati su kao "supstituenati", jer se smatraju zamjenom za atom vodika koji je prisutan u matičnim ugljikovodikovim organskim supstancama.
Implicitni atomi ugljika i vodika
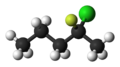
[uredi | uredi izvor]Naprimjer, na slici ispod, prikazuje se skeletni formula heksana. Ugljikov atom označen kao C1 izgleda da ima samo jednu vezu, tako da moraju za njega biti vezana i tri vodika, kako bi njegov ukupan broj veza bio četiri. Ugljikov atom označen kao C3 ima dvije veze sa drugim ugljicima i stoga je vezan sa dva atoma vodika. Kugla-priključak model stvarne molekulske strukture heksana, kao što je određeno rendgenskom kristalografskom strukturom, prikazan je za usporedbu; ugljikovi atomi prikazani su kao crne kugle, a vodikovi atomi kao bijeli.[5][6][7][8][9]


Napomena: Nije važno sa kojeg kraja lanca počinje numeracija, sve dok si dosljedan u crtanju dijagrama. Sažeta formula ili IUPAC ime će potvrditi orijentaciju. Neke molekule će se prepoznati bez obzira na orijentaciju. Bilo koji atoma vodika vezan za neugljikov atom je podrazumijevajući (eksplicitno). U etanolu, C2H5OH, naprimjer, vodikov atom koji je vezan za kisik, označen je simbolom H, dok njegov i atomi koji su vezani za ugljik nisu direktno označeni. Linije koje predstavljaju representing veze heteroatom-vodik obično su izostavljene zbog jasnoće i kompaktnosti, tako da su funkcijske grupe kao što je hidroksilna najčešće napisane kao -OH umjesto -O-H. Ove veze su ponekad izvučene u potpunosti kako bi se istaklo njihovo prisustvo kada učestvuju u mehanizmima reakcije . U nastavku, za usporedbu, prikazan je kugla-priključak model stvarne trodimenzijske strukture molekule etanola u fazi plina (određeno mikrotalasne spektroskopije, lijevo), Lewisovom strukture (u sredini) i skeletna formula (desno).


Izričiti (eksplicitni) heteroatomi
[uredi | uredi izvor]Svi atomi osim ugljika i vodika označeni su svojim hemijskim simbolima, naprimjer Cl za hlor, O za kisik, Na za natrij, i sl. Ovi atomi su (u kontekstu organske hemije) zajednički poznati kao heteroatomi.
Simboli pseudoelemenata
[uredi | uredi izvor]Postoje i simboli koji se pojavljuju u biti simbola hemijskih elemenata, ali predstavljaju određene vrlo česte supstituenate ili ukazuju na neodređeno članove grupe elemenata. Oni su poznati kao simboli pseudoelemenata ili organski elementi. Najšire upotrebljavani od njih je simbol Ph, koji predstavlja fenil grupu. Spisak sim,bola pseudoelementa prikazan je ispod.
Elementi
[uredi | uredi izvor]Alkil grupe
[uredi | uredi izvor]- R za bilo koju alkil grupu ili čak bilo koji supstituent uopće
- Me za metil grupu
- Et za etil grupu
- n-Pr za propil grupu
- i-Pr za izopropil grupu
- Bu za butil grupu
- i-Bu za izobutil grupu
- s-Bu za sekundarnu butil grupu
- t-Bu za tercijarnu butil grupu
- Pn za pentil grupu
- Hx za heksil grupu
- Hp za heptil grupu
- Cy za cikloheksil grupu
Aromatski supstituenti
[uredi | uredi izvor]- Ar za bilo koji aromatski supstituent
- Bn za benzil grupu
- Bz za benzoil grupu
- Mes za mesitil grupu
- Ph ili Φ za fenil grupu
- Tol za tolil grupu
- Cp za ciklopentadienil grupu
- Cp* za pentametilciklopentadienil grupu
Funkcijske groupe
[uredi | uredi izvor]- Ac za acetil grupu (Ac je također i simbol elementa aktinij. Međutim, aktinij se gotovo nikada ne susreće u organskoj hemiji, tako da upotreba Ac u predstavljanju acetil grupe nikada ne izazivaju zabunu)
Odlazeće grupe
[uredi | uredi izvor]Za daljnje informacije, vidi članak Odlazeća grupa
Zaštitne grupe
[uredi | uredi izvor]Zaštitna grupa ili zaštitne grupe su uvedene u molekulu hemijskom modifikacijom funkcijske grupe da dobije hemoselectivnost u kasnijoj kemijskoj reakciji, olakšavajući od višestepene organske sinteze.
- Cbo za karboksibenzil grupu (stariji naziv)
- Cbz za karboksibenzil grupu (stariji naziv)
- Z za karboksibenzil grupu
Višestruke veze
[uredi | uredi izvor]Dva atoma mogu biti vezana dijeleći više od jednog para elektrona. Uobičajene veze ugljika su jednostruke, dvostruke i trostruke. Jednostruke veze su najčešće i predstavljene su jednom, punom linijom između dva atoma u skeletnim formulama. Dvostruke veze označavaju dvije paralelne linije, a trostruke veze prikazani su kao tri paralelne linije. U naprednijim teorijama vezivanja, postoje necijele vrijednosti reda veze. U ovim slučajevima, kombinacije punih i isprekidanih linija ukazuju na cijele i ne-cijele dijelove reda veze.
-
Heks-3-en ima unutrašnju ugljik-ugljik dvostruku vezu -
Heks-1-en ima terminalnu dvostruku vezu -
Heks-3-in ima unutrašnju has ugljik-ugljik trostruku vezu -
Heks-1-in ima terminalnu ugljik-ugljik trostruku vezu
Napomena: U gornjoj galeriji, dvostruke veze su prikazane crvenom bojom, a trostruke veze u plavoj boji.
Za jasnoću - višestruke veze obično nisu obojene u skeletnim formulama.
Benzenski prstenovi
[uredi | uredi izvor]
Benzenski prstenovi su uobičajeni u organskim spojevima. Za predstavljanje delokalizacvije elektrona preko šestougljičnog prstena, ucrtava se krug unutar šesterougla jednostrukih veza. Ovaj stil, zasnovan na tome predložio je Johannes Thiele, koji je vrlo uobičajen u uvodnim školskim tekstovima organske hemije.

Alternativni stil koji je češći u akademskim krugovima je predložio je Friedrich August Kekule von Stradonitz . Iako se može smatrati netačnim, jer podrazumijeva tri jednostruke veze i tri dvostruke veze (benzen bi po trome bio cikloheksa-1,3,5-trien), svi kvalifikovani hemičari su u potpunosti svjesni delokalizacija u benzenu. Kekuleova strukture su korisni za jasno crtanje mehanizma reakcije.
Stereohemija
[uredi | uredi izvor]
Stereohemija se dogovorno označava u skeletnim formulama:[10]
-
Kugla-priključak model
(R)-2-hloro-2-fluoropentana -
Skeletna formula
(R)-2-hloro-2-fluoropentana -
Skeletna formula
(S)-2-hloro-2-fluoropentana -
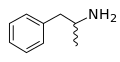
Skeletna formula amfetamina, obilježavajuća smjesa stereoizomera R (levoamfetamina) i S (dekstroamfetamina)
Relevantne hemijske veze mogu biti prikazani na nekoliko načina:
- Punim linijama predstavlja se kovalentna veza u ravni papira ili ekrana.
- Puni klinovi predstavljaju veze koje ističu ravni papir ili ekran, prema posmatraču.
- blijedi klinovi ili isprekidane linije (debela ili tanka) predstavljaju veze koje ukazuju na ravan papir ili ekran, od posmatrača.
- Valovita linija predstavlja bilo nepoznatu stereohemiju ili mješavinu dva moguća stereoizomera u tom trenutku.
Rano korištenje ovog označavanja može se pratiti natrag do Richarda Kuhna koji je u publikaciji 1932. godine koristio pune debele i isprekidane linije. Moderni klinovi su popularizirani u 1959., u udžbeniku „Organska hemija“ ("Organic Chemistry"; autori: Donald J. Cram i George S. Hammond).[11] Skeletne formule mogu prikazati cis i trans izomerima alkena. Valovite jednostruke veze su standardni način za predstavljanje nepoznate ili neodređene stereohemije ili mješavine izomera (kao kod četveroglavih stereocentara). Ponekad se koristi poprečna dvostruka veza; više se ne smatra prihvatljivim stil za opću upotrebu, ali i dalje može biti potreban za kompjuterski softver.[10]
Vodikove veze
[uredi | uredi izvor]
Vodikove veze se obično označavaju tačkastim ili isprekidanim linijama.
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ General, Organic, and Biological Chemistry, H. Stephen Stoker 2012
- ^ Voet D, Voet J. . (1995). Biochemistry, 2nd Ed. Wiley, http://www.wiley.com/college/math/chem/cg/sales/voet.html. Vanjski link u parametru
|publisher=(pomoć)CS1 održavanje: upotreba parametra authors (link) - ^ Atkins P., de Paula J. (2006). Physical chemistry, 8th Ed. San Francisco: W. H. Freeman. ISBN 0-7167-8759-8.
- ^ IUPAC Recommendations 1999, Revised Section F: [https://web.archive.org/web/20161219173833/http://www.chem.qmul.ac.uk/iupac/sectionF/RF5.html Arhivirano 19. 12. 2016. na Wayback Machine Replacement of Skeletal Atoms
- ^ Whitten K.W., Gailey K. D. and Davis R. E. (1992). General chemistry, 4th Ed. Philadelphia: Saunders College Publishing. ISBN 0-03-072373-6.
- ^ Petrucci R. H., Harwood W. S., Herring F. G. (2002). General Chemistry, 8th Ed. New York: Prentice-Hall. ISBN 0-13-014329-4.CS1 održavanje: više imena: authors list (link)
- ^ Laidler K. J. (1978). Physical chemistry with biological applications. Benjamin/Cummings. Menlo Park. ISBN 0-8053-5680-0.
- ^ Weast R. C., Ed. (1990). CRC Handbook of chemistry and physics. Boca Raton: Chemical Rubber Publishing Company. ISBN 0-8493-0470-9.
- ^ Binder H. H. (1999). Lexikon der chemischen Elemente. Stuttgart: S. Hirzel Verlag. ISBN 3-7776-0736-3.
- ^ a b J. Brecher (2006). "Graphical representation of stereochemical configuration (IUPAC Recommendations 2006)" (PDF). Pure and Applied Chemistry. 78 (10): 1897–1970. doi:10.1351/pac200678101897. Referenca sadrži prazan nepoznati parametar:
|1=(pomoć) - ^ The Historical Origins of Stereochemical Line and Wedge Symbolism William B. Jensen Journal of Chemical Education 2013 90 (5), 676-677 doi:10.1021/ed200177u
Vanjski linkovi
[uredi | uredi izvor]- Drawing organic molecules from chemguide.co.uk