Hlor
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hlor u periodnom sistemu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hemijski element, Simbol, Atomski broj | Hlor, Cl, 17 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serija | Halogeni | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupa, Perioda, Blok | 17, 3, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izgled | žuto-zeleni gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zastupljenost | 0,19[1] % | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomska masa | 35,453[2][3] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomski radijus (izračunat) | 100 (79) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentni radijus | 99[4] pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsov radijus | 175 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronska konfiguracija | [Ne] 3s2 3p5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Broj elektrona u energetskom nivou | 2, 8, 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. energija ionizacije | 1251,2 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. energija ionizacije | 2298 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. energija ionizacije | 3822 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. energija ionizacije | 5159 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. energija ionizacije | 6542 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6. energija ionizacije | 9362 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7. energija ionizacije | 11018 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikalne osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Agregatno stanje | gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristalna struktura | ortorompska | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gustoća | 3,2149[5] (na 0 °C, 1013 mbar) kg/m3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetizam | dijamagnetičan ( = −2,3 · 10−8)[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka topljenja | 171,6 K (−101,5 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka ključanja | 238,5[7] K (−34,6 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molarni volumen | (čvrst) 17,39 · 10−6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota isparavanja | 20,4[7] kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota topljenja | 3,203 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pritisak pare | 6,78 · 105[5] Pa pri 293 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brzina zvuka | 206[6] m/s pri 298 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifična toplota | 480 J/(kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplotna provodljivost | 0,0089 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hemijske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksidacioni broj | ±1, 3, 4, 5, 6, 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksid | ? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrodni potencijal | 1,36 V (Cl + e− → Cl−) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativnost | 3,16 (Pauling-skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sigurnosno obavještenje | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oznake upozorenja | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obavještenja o riziku i sigurnosti | R: 23-36/37/38-50 S: (1/2-)9-45-61 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ako je moguće i u upotrebi, koriste se osnovne SI jedinice. Ako nije drugačije označeno, svi podaci dobijeni su mjerenjima u normalnim uvjetima. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hlor (latinski: chlorium) jeste hemijski element sa simbolom Cl i atomskim brojem 17. Hlor se nalazi u grupi halogenih elemenata (grupa 17) i drugi je najlakši halogen nakon fluora. U standardnim uslovima temperature i pritiska, element je žuto-zeleni gas, pri čemu se nalazi u obliku dvoatomske molekule. Hlor ima najviši afinitet prema elektronu i treću po veličini elektronegativnost među svim reaktivnim elementima. Iz tog razloga, on je vrlo jako oksidirajuće sredstvo. Slobodni hlor je vrlo rijedak na Zemlji, a obično je rezultat direktne ili indirektne oksidacije pomoću kisika.
Najčešći i najuobičajeniji spoj hlora, natrij-hlorid (obična kuhinjska so), bio je poznat iz antičkih vremena. Oko 1630. gasni hlor je prvi put sintetiziran u hemijskoj reakciji, ali nije bio prepoznat kao fundamentalno važna supstanca. Određivanje osobina gasnog hlora sačinio je Carl Wilhelm Scheele, koji je 1774. pretpostavio da se radi o oksidu nekog novog elementa. Međutim, hemičari su 1809. otkrili da je taj gas zapravo čisti hemijski element, što je u svojim radovima potvrdio i Humphry Davy 1810. koji novi element nazvao današnjim imenom, izvedenim iz grčkog χλωρóς (hloros, žuto-zeleni).
Gotovo sav hlor u Zemljinoj kori nalazi se u vidu hlorida u raznim ionskim spojevima, uključujući i kuhinjsku so. On je drugi najrasprostranjeniji halogeni element i 21. najrasprostranjeniji element u Zemljinoj kori. Elementarni hlor se industrijski proizvodi iz slane vode pomoću elektrolize. Veliki potencijal elementarnog hlora za oksidiranje drugih elemenata komercijalno se koristi u sastavu mnogih izbjeljivača i dezinfekcijskih sredstava, a općenito se koristi kao nezamjenjiv reagens u hemijskoj industriji. On se koristi i pri proizvodnji mnogih potrošačkih roba i proizvoda, od čega dvije trećine otpada na organske hemikalije poput polivinil hlorida, kao i mnoge poluproizvode u proizvodnji plastičnih i drugih proizvoda za krajnju potrošnju. Takvi proizvodi obično ne sadržavaju elementarni hlor. Elementarni hlor i spojevi hlora često se koriste kao dezinfekcijsko sredstvo koje se direktno sipa u bazene za kupanje čime se oni čiste.
U obliku hloridnih iona, hlor je neophodan i nezamjenjiv za sva poznata živa bića. Druge vrste spojeva hlora su rijetki u živim organizmima, a vještački proizvedeni organohlorni spojevi mogu biti potpuno inertni ali i veoma otrovni. U gornjim slojevima Zemljine atmosfere, organske molekule koje sadrže hlor poput hlorofluorougljika uključene su u uništavanje ozonskog omotača. Malehne količine elementarnog hlora se generiraju oksidacijom hlorida do hipohlorita u neutrofilima, kao dio imunog odgovora protiv bakterija. Elementarni hlor u visokim koncentracijama je ekstremno opasan i otrovan za sve žive organizme, a koristio se tokom Prvog svjetskog rata kao prvo gasovito hemijsko bojno oružje.
Historija
[uredi | uredi izvor]Najčešći i najuobičajeniji spoj hlora, natrij hlorid, poznat je još od antičkih vremena. Arheolozi su našli dokaze da je kamena so bila korištena još oko 3000 p.n.e. dok se voda iz slanih bunara koristila od 6000 p.n.e.[8] Tek oko 1630. godine, hlor u gasovitom stanju je otkrio flamanski hemičar i fizičar Jan Baptist van Helmont.[9]

Elementarni hlor prvi je dobio i proučavao švedski hemičar Carl Wilhelm Scheele 1774. pa se stoga njemu pripisuje otkriće hlora.[10] On ga je nazvao deflogistovani murijatni kiseli zrak, jer je bio gasovit (stoga nazvan zrak) a dobio ga je iz hlorovodične kiseline (tada poznata kao murijatna kiselina).[10] Međutim, on nije uspio "unaprijediti" otkriveni hlor u hemijske elemente, jer je pogrešno mislio da je iz hlorovodične kiseline zapravo dobio oksid (pogledaje teoriju flogistona).[10] Scheele je novom elementu u ovom "oksidu" dao ime murijatik (muriaticum).[10] I pored toga što je razmišljao na taj način, Scheele je izolirao hlor reakcijom MnO2 (kao minerala piroluzita) sa HCl:[9]
- 4 HCl + MnO2 → MnCl2 + 2 H2O + Cl2
Scheele je zapazio nekoliko osobina hlora: njegov izbjeljivački efekt na lakmus testu, smrtonosno djelovanje na insekte, njegovu žuto-zelenu boju i miris sličan zlatotopki.[11]
U to vrijeme, prihvaćena hemijska teorija bila je: svaka kiselina je spoj koji sadrži kisik (i danas se na holandskom i njemačkom jeziku kisik naziva: sauerstoff ili zuurstof, što bi na bosanskom bilo prevedeno kao kisela supstanca), tako da su brojni hemičari, uključujući Claude Bertholleta, smatrali da je Scheeleov deflogistovani murijatni kiseli zrak kombinacija kisika i još neotkrivenog elementa, murijatika.[12][13][14]
Godine 1809. Joseph Louis Gay-Lussac i Louis-Jacques Thénard pokušali su razložiti deflogistovani murijatski kiseli zrak putem njegove reakcije sa ugljem da bi se tako otpustio element murijatik (i ugljik dioksid).[10] Međutim, nisu uspjeli te su objavili rezultat tog eksperimenta u kojem su razmatrali mogućnost da je deflogistiovani murijatski kiseli zrak zapravo čisti element, ali nisu bili ubijeđeni u to.[15]
Sir Humphry Davy je 1810. pokušao ponovno izvesti isti eksperiment te je zaključio da se radi o hemijskom elementu a ne o spoju.[10] Novi element je nazvao hlor, izvedeno iz grčke riječi χλωρος (hlōros), što znači zeleno-žuti.[16] Naziv halogen znači "onaj koji daje so" prvobitno je korišten kao naziv za hlor 1811. u djelu Johanna Salomo Christopha Schweiggera. Ipak, ovaj pojam se kasnije koristio kao općeniti naziv kojim su se opisivali svi elemente iz porodice hlora (fluor, brom i jod), a nakon sugestije Jacoba Berzeliusa 1842. godine.[17][18] Godine 1823., Michael Faraday je prvi naučnik koji je ukapljio hlor,[19][20] te je demonstrirao ono što se tada zvalo "čvrsti hlor" da zapravo ima strukturu hlor hidrata (Cl2·H2O).[9]
Gasoviti hlor prvi je upotrijebio francuski hemičar Claude Berthollet za izbjeljivanje tekstila 1785. godine.[21][22] Moderna sredstva za izbjeljivanje su rezultat Bertholletovih daljnjih radova, koji je prvi proizveo natrij hipohlorit 1789. u svojoj laboratoriji u kvartu Javel (danas dio Pariza, Francuska) tako što je propuštao gas hlor kroz rastvor natrij karbonata. Nastala tekućina, nazvana "Eau de Javel" ("Žavelska voda"), bila je slabi rastvor natrij hipohlorita. Međutim, ovaj proces nije bio efikasan, te su se tražile metode za alternativnu proizvodnju. Škotski hemičar i industrijalac Charles Tennant prvi je dobio rastvor kalcij hipohlorita ("hlorirani krečnjak"), a nakon toga i čvrsti kalcij hipohlorit (praškasti izbjeljivač).[21] Ovi spojevi su otpuštali vrlo malehne količine elementarnog hlora pa su se mogle mnogo lakše i efikasnije transportovati za razliku od natrij hipohlorita, koji je ostajao kao razblaženi rastvor jer kada bi se pročistio radi uklanjanja vode iz njega, postao bi vrlo opasno i nestabilno oksidativno sredstvo. Na kraju 19. vijeka, E. S. Smith je patentirao metod proizvodnje natrij hipohlorita koji uključuje elektrolizu slane vode čime se dobija natrij hidroksid i gasoviti hlor, koji se zatim miješa dajući natrij hipohlorit.[23] Ovaj proces je poznat kao hloralkalni proces, koji je prvi put 1892. načinjen u industrijskim količinama, a danas je izvor gotovo cjelokupnoj količini proizvedenog elementarnog hlora i proizvodnji natrij hidroksida (dok je povezana reakcija elektrolize na niskim temperaturama, Hookerov proces, danas "odgovoran" za proizvodnju izbjeljivača i natrij hipohlorita).
Rastvori elementarnog hlora se rastvaraju u hemijski alkalnoj vodi (natrij i kalcij hipohlorit) počeli su se prvi put koristiti kao sredstva za dezinfekciju i za zaštitu od truljenja tokom 1820tih u Francuskoj, mnogo prije nastanka germinativne teorije bolesti. Za ovaj rad je najviše zaslužan Antoine-Germain Labarraque, koji je prilagodio Bertholletovu "Žavelsku vodu" za izbjeljivanje i druge preparade od hlora u ovu svrhu. Od tada elementarni hlor bez prestanka služi u antiseptičke svrhe (poput rastvora za tretiranje rana i slično) kao i u svrhu javne sanitacije (naročito pročišćavanje vode u kupaćim bazenima i vode za piće).
Godine 1826. srebro hlorid se koristio za dobijanje prve fotografske slike.[24] Hloroform je 1847. bio prvi anestetik.[24] Polivinil hlorid (PVC) je izmišljen 1912. godine, a prvobitno nije imao nikakvu svrhu niti upotrebu.[24]
Gasoviti hlor je prvi put upotrijebila njemačka vojska kao oružje 22. apila 1915. godine kod Ypresa u Prvom svjetskom ratu,[25][26] a rezultati upotrebe ovog oružja bili su užasni jer se tada gas-maske nisu dijelile vojnicima a postojeće se se vrlo sporo i nezgrapno stavljale na glavu.
Osobine
[uredi | uredi izvor]Fizičke
[uredi | uredi izvor]
Pri standardnim uslovima temperature i pritiska, dva atoma hlora grade dvoatomsku molekulu Cl2.[27] On je žuto-zeleni gas sa snažnim, prodornim mirisom, većini ljudi poznatom po običnom izbjeljivaču u domaćinstvima.[28] Veza između dva atoma u molekuli je relativno slaba (samo 242,580 ± 0,004 kJ/mol), što čini molekulu Cl2 izuzetno reaktivnom. Tačka ključanja pri standardnom pritisku iznosi −34,6 °C, ali se on može ikapljiti pri sobnoj temperaturi pri pritisku iznad 740 kPa.[29]
Iako je elementarni hlor žuto-zelen, hloridni ion kao i drugi halidni ioni, nema boju ni u jednom svom mineralu ili rastvoru (naprimjer u kuhinjskoj soli). Slično tome, (kao i drugi halogeni) atomi hlora ne doprinose bojenju organskih hlorida kada zamijene atom vodika u nekom bezbojnom organskom spoju, kao što je naprimjer tetrahlormetan. Tačka topljenja i gustoća ovih spojeva raste supstituiranjem vodika na mjesto hlora. Spojevi hlora sa drugim halogenim elementima, kao i mnogi oksidi hlora, su vrlo znatno obojeni.
Hemijske
[uredi | uredi izvor]Pored fluora, broma, joda i astata, hlor je član serije halogena koja sačinjava 17 grupu periodnog sistema (ranije označavana kao VII, VIIA ili VIIB). Hlor gradi spojeve sa gotovo svim poznatim elementima dajući spojeve koji se obično nazivaju hloridi. Gasoviti hlor reagira sa većinom organskih spojeva, a može čak i usporiti ili prekinuti sagorijevanje zapaljenih ugljikovodika.[6]
Hidroliza slobodnog hlora ili disproporcioniranje u vodi
[uredi | uredi izvor]Pri 25 °C i atmosferskom pritisku, u jednom litru vode može se rastvoriti 3,26 g ili 1,125 l gasovitog hlora.[30] Rastvori hlora u vodi sadrže hlor (Cl2), hlorvodoničnu kiselinu i hipohlornu kiselinu:
Ova konverzija prema desno se naziva disproporcioniranje, jer se reagens hlor i povećava i smanjuje po formalnom oksidacijskom stanju. Rastvorljivost hlora u vodi se povećava ako voda sadrži rastvorene alkalne hidrokside, pa u tom pogledu, stvara se hlorni izbjeljivač:[31]
- Cl2 + 2 OH− → ClO− + Cl− + H2O
Gasoviti hlor postoji samo u neutralnim ili kiselim rastvorima.
Izotopi
[uredi | uredi izvor]Hlor ima veliki broj izotopa. Među njima, postoje samo dva stabilna izotopa: 35Cl (sa udjelom od 75,77%) i 37Cl (udio 24,23%).[32] Oni zajedno daju hloru prosječnu atomsku masu od 35,4527 g/mol. Polucijelobrojna vrijednost težine hlora je uzrokovala određenu zbunjenost među ranim hemičarima, kada se čak teoretiziralo da su njegovi atomi sastavljeni i od jedinice vodika (vidi Proustov zakon), a tada je postojanje hemijskih izotopa bilo neistraženo.[33]
U prirodi postoje i tragovi radioaktivnog izotopa 36Cl, u odnosu od oko 7x10−13 na svaki atom stabilnog izotopa. Izotop 36Cl nastaje u atmosferi procesom spalacije izotopa 36Ar međudjelovanjem sa protonima iz kosmičkog zračenja. U okruženju ispod površine Zemlje, 36Cl se stvara uglavnom kao rezultat zahvata neutrona od strane izotopa 35Cl ili zahvata muona od strane izotopa 40Ca. Izotop 36Cl se raspada na 36S i 36Ar, sa kombiniranim vremenom poluraspada od 308 hiljada godina. Vrijeme poluraspada ovog izotopa ga čini pogodnim za geološko datiranje u rasponima od 60.000 do milion godina. Osim toga, velike količine 36Cl su proizvedene radijacijom morske vode tokom atmosferskih detonacija nuklearnog oružja između 1952. i 1958. godine. Vrijeme postojanja izotopa 36Cl u atmosferi je oko jedne sedmice. Međutim, kao marker događaja iz 1950tih u podzemnim i površinskim vodama, 36Cl je također koristan za datiranje vode koja je stara manje od 50 godina od današnjih voda. 36Cl se pokazao korisnim i u drugim oblastima geoloških nauka, uključujući datiranje leda i sedimenata.[32]
Rasprostranjenost
[uredi | uredi izvor]Smatra se da u vrijeme Velikog praska nisu nastali atomi hlora. Hlor u svemiru stvoren je i raspršen kroz međuzvjezdani medij nakon pojave supernove tokom r-procesa.[34] Ovako nastali hlor omogućio je zalihe koje su pronađene u Sunčevom sistemu. U meteoritima i na Zemlji, hlor se primarno nalazi kao hloridni ion, rasprostranjen u mineralima. U Zemljinoj kori, hlor je prisutan u prosječnoj koncentraciji od oko 126 ppm,[35] pretežno u mineralima poput halita (natrij hlorid), silvita (kalij-hlorid) i karnalita (kalij magnezij hlorid heksahidrat).
Hloridi su komponenta soli koja je nataložena na kopnu ili rastvorena u okeanima, oko 1,9% mase morske vode su hloridni ioni. U čak i višim koncentracijama hloridi se nalaze u vodi Mrtvog mora i u podzemnim depozitima u slanim bunarima. Većina hloridnih soli je rastvorljivo u vodi, ali se minerali bogati hloridima obično mogu naći u velikim količinama samo u suhim područjima ili duboko ispod zemlje.
U prirodi je poznato preko 2000 organskih spojeva koji sadrže hlor.[36]
Dobijanje
[uredi | uredi izvor]
U industriji, elementarni hlor se proizvodi elektrolizom natrij hlorida rastvorenog u vodi. Ovom metodom, hloroalkalnim procesom koji se razvio 1892. za potrebe industrije, danas se proizvodi gotovo sav industrijski gasoviti hlor.[37] Pored hlora, ovim načinom se dobija i gasoviti vodik te natrij hidroksid (iako je zapravo natrij hidroksid najvažniji među tri industrijska proizvoda koji se dobijaju u ovom procesu). Proces se odvija u skladu sa sljedećom hemijskom jednačinom:[38]
- 2 NaCl + 2 H2O → Cl2 + H2 + 2 NaOH
Elektroliza svih hloridnih rastvora odvija se u skladu sa sljedećim jednačinama:
- Katoda: 2 H+(aq) + 2 e− → H2(g)
- Anode: 2 Cl−(aq) → Cl2(g) + 2 e−
Sveukupni proces: 2 NaCl (ili KCl) + 2 H2O → Cl2 + H2 + 2 NaOH (ili KOH)
U elektrolizi sa ćelijskom dijafragmom, dijafragma od azbesta (ili polimerskih vlakana) odvaja katodu i anodu, onemogućavajući da hlor koji se skuplja na anodi ponovno miješa sa natrij hidroksidom i vodikom koji se izdvaja na katodi.[39] Rastvor soli (slana voda) se neprestano ulijeva u dio gdje je anoda, teče kroz dijafragmu do dijela sa katodom, gdje se proizvodi kaustična soda a slana voda se djelimično razlaže. Metode pomoću dijafragme daju razblaženu i donekle nečistu bazu ali se njima otklanjaju problemi zaštite od curenja i izdvajanja žive u okolinu te su znatno energetski efikasniji. Elektroliza pomoću ćelijske membrane koristi polupropusne membrane kao ionske izmjenjivače. Zasičeni rastvor natrij (ili kalij) hlorida se propušta kroz kontejner sa anodom, odakle izlazi sa manjom koncentracijom.[40] Ova metoda je efikasnija nego ona sa ćelijskom dijafragmom i daje vrlo čisti natrij (ili kalij) hidroksid koncentracije oko 32%, ali je za to potrebno koristiti i veoma čistu slanu vodu.
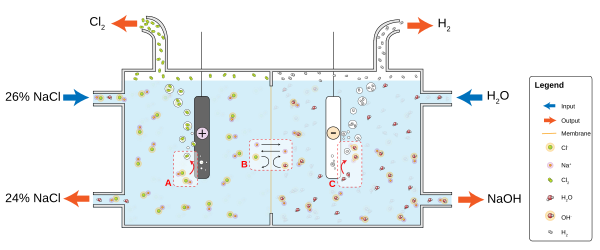
Laboratorijske metode
[uredi | uredi izvor]Male količine gasnog hlora se mogu sačiniti u laboratoriji miješanjem hlorovodične kiseline i mangan dioksida. Alternativno, jake kiseline poput sumporne ili hlorovodične regiraju sa rastvorom natrij hipohlorita istiskujući iz njega gasoviti hlor ali također reagiraju i sa natrij hloratom dajući gasovite hlor i hlor dioksid. U domaćinstvu, dešavaju se nesreće kada rastvori izbjeljivača koji sadrže hipohlorit dođu u dodir sa određenim kiselim sredstvima za čišćenje.
Upotreba
[uredi | uredi izvor]Hlor se koristi za dezinfekciju vode, za dezinfekciju i izbjeljivanje papira i tkanina. Hlor se dosta koristi za izradu proizvoda koji se koriste u svakodnevnici: boje, namirnice, insekticida, plastičnih masa, naftnih produkata, lijekova, rastvarača i bojnih otrova. Hlor se koristi i za dobijanje hlornog kreča i broma. Organska hemija je također područje na kome se primenjuje hlor. Koristi se kao oksidans, a i kao zamjena za atom vodika u organskim jedinjenjima. Upotreba hlora za bjeljenje industrijske celuloze, lana, pamuka i dezinfekciju vode zasniva se na njegovom oksidacionom djelovanju.
Kao oružje
[uredi | uredi izvor]Gas hlor, poznat i kao bertolit, prvi put je korišten kao oružje u Prvom svjetskom ratu 22. aprila 1915. kada su ga njemačke snage upotrijebile u Drugoj bici kod Ypresa u današnjoj Belgiji[41] Prema opisima preživjelih vojnika, on je imao specifičan miris otprilike između ananasa i bibera. Također, imao je metalni okus i neugodno je pekao za grlo i nepce. Hlor može reagirati s vodom u mukoznom sekretu pluća gradeći hlorovodičnu kiselinu koja iritira i može biti smrtonosna. Oštećenja uzrokovana gasovitim hlorom mogu se preventirati aktivnim ugljem ugrađenim u običnim gas-maskama ili metodom filtriranja, koje smanjuju rizik od smrti trovanja hlorom mnogo niže od rizika kod drugih hemijskih oružja. Pionir upotrebe hlora kao hemijskog oružja bio je njemački naučnik Fritz Haber sa Instituta cara Wilhelma u Berlinu, koji je kasnije 1918. dobio Nobelovu nagradu, a u saradnji sa njemačkim hemijskim konglomeratom IG Farben, zajedno razvivši metode otpuštanja gasnog hlora protiv neprijateljskih vojnika ukopanih u rovovima. Navodno je Haberova uloga za upotrebu hlora kao smrtonosnog oružja bila povod njegovoj ženi Clari Immerwahr da počini samoubistvo.[42] Nakon njegove prve upotrebe, hlor su koristile obje zaraćene strane kao hemijsko oružje, ali su ga vrlo brzo zamijenili mnogo smrtonosniji fosgen (ugljik oksihlorid) i senf-gas (bis(2-hloroetil) sulfid).[43] Theodore Gray je u svojoj knjizi The Elements: A Visual Exploration of Every Atom in the Universe napisao: Hlor je korišten kao otrovni gas tokom užasne faze rovovskog ratovanja. Vojnici su postavljali gasne cilindre duž linije fronta, čekajući da vjetar puhne u pravcu neprijateljskih rovova, te su zatim otvarali ventile i pobjegli što prije od njih. Ova praksa, koju je ponekad lično nadgledao Fritz Haber, čovjek čiji je pozitivni doprinos čovječanstvu naveden u članku o dušiku i amonijaku, je postepeno isčezla a iskustvo je pokazalo da je gotovo isti broj vojnika umrlo s obje strane bez obzira ko je upotrijebio gas.[44]
Postoje izvještaji da je u Iraku u sukobima između Kurda i pripadnika Islamske Države također upotrijebljen hlor kao bojni otrov.[45]
Spojevi
[uredi | uredi izvor]Hlor gradi nekoliko kiselina i odgovarajuće soli:
- hlorovodična (sona) kiselina (HCl) i hloridi kao soli
- hipohloritna kiselina (HClO)
- hloritna kiselina (HClO2)
- hloratna kiselina (HClO3)
- perhloratna kiselina (HClO4)
Anorganski spojevi hlora su hloridna kiselina i hloridi, oksikiseline hlora i njihove soli, hlor dioksid ClO2. Poznati su i brojni organo-hlorni spojevi (derivati karboksilnih kiselina, pesticidi, itd...).
Hlor se javlja su svim neparnim oksidacijskim stanjima između -1 i +7, kao i u nultom, elementarnom stanju te oksidacijskom stanju 4 u hlor dioksidu (vidi tabelu ispod, kao i strukturu u hloritima).[46] Hlor obično ima oksidacijsko stanje −1 u velikom broju spojeva, osim u spojevima koji sadrže fluor, kisik i dušik, od koji su svi čak više elektronegativni od hlora. Idući uzlazno po oksidacijskim stanjima, hidrohlorna kiselina se može oksidirati koristeći mangan dioksid ili da se gasoviti vodik hlorid katalitički oksidira u prisustvu zraka dajući elementarni gasoviti hlor.[38]
| oksidacijsko stanje |
naziv | formula | karakteristični spojevi |
|---|---|---|---|
| −1 | hloridi | Cl− | ionski hloridi, organski hloridi, hidrohlorna kiselina |
| 0 | hlor | Cl2 | elementarni hlor |
| +1 | hipohloriti | ClO− | natrij hipohlorit, kalcij hipohlorit |
| +3 | hloriti | ClO− 2 |
natrij hlorit |
| +4 | hlor(IV) | ClO2 | hlor dioksid |
| +5 | hloril, hlorati | ClO− 3 ClO+ 2 |
kalij hlorat, hlorna kiselina, dihloril trisulfat [ClO2]2[S3O10]. |
| +6 | hlor(VI) | Cl2O6 | dihlor heksoksid (gas). U tečnim ili čvrstim disproporcionatima miješaju se oksidacijska stanja +5 i +7, kao ionski hloril perhlorat [ClO2]+[ClO4]− |
| +7 | perhlorat | ClO− 4 |
perhlorna kiselina, perhloratne soli kao što su magnezij perhlorat, dihlor heptoksid |
Hloridi
[uredi | uredi izvor]Kombiniranjem hlora sa gotovo bilo kojim drugim elementom dobijaju se hloridi. Spojevi sa kisikom, dušikom, ksenonom i kriptonom su također dobijeni, ali oni se ne dobijaju direktnim reakcijama elemenata.[47] Hloridi su jedni od najčešćih aniona koji se nalaze u prirodi. Vodik hlorid (HCl) i njegov vodeni rastvor, hlorovodična kiselina, dobijaju se u ogromnim količinama reda miliona tona godišnje, a također i kao vrijedni poluproizvodi. Međutim, nekad se ovi spojevi smatraju nepoželjnim zagađivačima.
Oksidi hlora
[uredi | uredi izvor]Hlor gradi i razne oblike oksida, kao što je prikazano u gornjoj tabeli: hlor dioksid (ClO2), dihlor monoksid (Cl2O), dihlor heksoksid (Cl2O6) i dihlor heptoksid (Cl2O7). Anionski derivati tih istih oksida se također veoma poznati a tu se, između ostalih, nalaze hlorati (ClO−
3), hloriti (ClO−
2), hipohloriti (ClO−) i perhlorati (ClO−
4). Kiseli derivati ovih aniona su hipohlorna kiselina (HOCl), hlorna kiselina (HClO3) i perhlorna kiselina (HClO4). Poznat je i hloroksi kation hloril (ClO2+) a ima istu strukturu kao i hlorit osim što je pozitivnog naboja a hlor u njemu je sa oksidacijskim stanjem +5.[48] Hemijski spoj "hlor trioksid" se ne javlja, ali je u gasovitom obliku pronađen kao dimerski dihlor heksoksid (Cl2O6) sa oksidacijskim stanjem +6. Ovaj spoj u tečnom ili čvrstom stanju disproporcionira u mješavinu oksidacijskih stanja +5 i +7, javljajući se kao ionski spoj hloril perhlorat, [ClO2]+[ClO4]−.[49]
U vrućim koncentriranim alkalnim rastvorima hipohlorit disproporcionira:
- 2 ClO− → Cl− + ClO−
2 - ClO− + ClO−
2 → Cl− + ClO−
3
Natrij hlorat i kalij hlorat se mogu kristalizirati iz rastvora koji se dobijaju pomoću gornjih reakcija. Ako se njihovi kristali zagrijavaju do visokih temperatura, oni idu dalje do konačnog disproporcioniranja:
- 4 ClO−
3 → Cl− + 3 ClO−
4
Ova ista progresija od hlorida do perhlorata se može obaviti i elektrolizom. Na anodi tok reakcije je sljedeći:[50]
Reakcija Elektrodni potencijal Cl− + 2 OH− → ClO− + H2O + 2 e− +0,89 volti ClO− + 2 OH− → ClO−
2 + H2O + 2 e−+0,67 volti ClO−
2 + 2 OH− → ClO−
3 + H2O + 2 e−+0,33 volti ClO−
3 + 2 OH− → ClO−
4 + H2O + 2 e−+0,35 volti
Svaki korak je povezan sa katodom preko:
- 2 H2O + 2 e− → 2 OH− + H2 (−0,83 volti)
Interhalogeni spojevi
[uredi | uredi izvor]Hlor oksidira soli broma i joda do elementarnih broma i joda, respektivno. Međutim, on ne može oksidirati soli fluora do elementarnog fluora. Hlor može graditi razne interhalogene spojeve kao što su hlor fluoridi, hlor monofluoridi (ClF), hlor trifluoridi (ClF3), hlor pentafluoridi (ClF5) i druge. Postoje također i hloridi broma i joda.[51]
Organohlorni spojevi
[uredi | uredi izvor]Hlor se dosta koristi u organskoj hemiji pri reakcijama supstitucije i adicije. Hlor često daje mnoge željene osobine organskim spojevima, djelimično zbog svoje velike elektronegativnosti.
Kao i drugi halidi, hlor također stupa u reakcije elektrofilne adicije, među kojima je jedna od najpoznatijih hloriranje alkena i aromatskih spojeva sa Lewisovom kiselinom kao katalizatorom. Organski spojevi hlora pretežno su manje reaktivni u reakcijama nukleofilne supstitucije u odnosi na odgovarajuće derivate broma i joda, ali su spojevi hlora mnogo jeftiniji. Oni se mogu aktivirati za reakciju supstituiranja sa tosilatnom grupom, ili korištenjem katalitičkih količina natrij-jodida.
Otrovnost
[uredi | uredi izvor]Gasoviti hlor nadražuje sistem za disanje i sluzne žlijezde, u većim količinama izaziva smrt. U zraku se može osjetiti već u količini od 3.5 ppm, ali opasna koncentracija je tek preko 1000 ppm. Da bi se neutralisao udišu se pare etanola, ili razblaženog rastvora amonijaka.
Reference
[uredi | uredi izvor]- ^ Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ^ Michael E. Wieser, Tyler B. Coplen: Atomic weights of the elements 2009 (IUPAC Technical Report). u: Pure Appl. Chem. 2010, str. 1, doi:10.1351/PAC-REP-10-09-14
- ^ IUPAC, Standard Atomic Weights Revised 2013
- ^ Mineralienatlas
- ^ a b Hlor[mrtav link] u GESTIS bazi podataka supstanci
- ^ a b c Weast, Robert C. (gl.ur.): CRC Handbook of Chemistry and Physics CRC (Chemical Rubber Publishing Company), Boca Raton 1990. strn E-129 do E-145. ISBN 0-8493-0470-9.
- ^ a b Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. u: Journal of Chemical & Engineering Data. 56, 2011, str. 328–337, doi:10.1021/je1011086
- ^ "The earliest salt production in the world: an early Neolithic exploitation in Poiana Slatinei-Lunca, Romania". Pristupljeno 10. 7. 2008.
- ^ a b c Greenwood 1997, str. 790.
- ^ a b c d e f "17 Chlorine". Elements.vanderkrogt.net. Pristupljeno 12. 9. 2008.
- ^ Greenwood 1997, str. 793.
- ^ Greenwood 1997, str. 792.
- ^ Ihde, Aaron John (1984). The development of modern chemistry. Courier Dover Publications. str. 158. ISBN 0-486-64235-6.
- ^ Weeks Mary Elvira (1932). "The discovery of the elements. XVII. The halogen family". Journal of Chemical Education. 9 (11): 1915. Bibcode:1932JChEd...9.1915W. doi:10.1021/ed009p1915.
- ^ Gay-Lussac, Joseph Louis; Thénard, Louis-Jacques (1809). "On the nature and the properties of muriatic acid and of oxygenated muriatic acid". Mémoires de Physique et de Chimie de la Société d'Arcueil. 2: 339–358.CS1 održavanje: više imena: authors list (link)
- ^ Sir Humphry Davy (1811). "On a Combination of Oxymuriatic Gas and Oxygene Gas". Philosophical Transactions of the Royal Society. 101: 155–162. doi:10.1098/rstl.1811.0008.
- ^ Greenwood 1997, str. 789.
- ^ Snelders, H. A. M. (1971). "J. S. C. Schweigger: His Romanticism and His Crystal Electrical Theory of Matter". Isis. 62 (3): 328. doi:10.1086/350763. JSTOR 229946.
- ^ "This Month in Physics History September 4, 1821 and August 29, 1831: Faraday and Electromagnetism". Chodos, Alan (ur.), American Physical Society. Pristupljeno 8. 5. 2010.
- ^ O'Connor J J and Robertson E F. "Michael Faraday". School of Mathematics and Statistics, University of St Andrews, Scotland. Pristupljeno 8. 5. 2010.
- ^ a b "Bleaching". Encyclopædia Britannica (9. izd. (1875) i 10. izd. (1902) izd.). Pristupljeno 2. 5. 2012.
- ^ Aspin, Chris (1981). The Cotton Industry. Shire Publications Ltd. str. 24. ISBN 0-85263-545-1.
- ^ "How Products Are Made Volume 2". 1. 5. 2011.
- ^ a b c Jacqueline Brazin. "Chlorine & its Consequences" (PDF). Arhivirano (PDF) s originala, 18. 9. 2006. Pristupljeno 10. 7. 2008.
- ^ "Chlorine – History" (PDF). Arhivirano s originala 1. 10. 2008. Pristupljeno 10. 7. 2008.CS1 održavanje: bot: nepoznat status originalnog URL-a (link)
- ^ "Weaponry: Use of Chlorine Gas Cylinders in World War I". historynet.com. Pristupljeno 10. 7. 2008.
- ^ Kenneth Barbalace (22. 10. 1995). "Chemical Database: Chlorine". EnvironmentalChemistry.com. Pristupljeno 19. 9. 2011.
- ^ "Facts About Chlorine". Emergency Preparedness and Response. United States Centers for Disease Control and Prevention. Arhivirano s originala, 23. 4. 2016. Pristupljeno 19. 9. 2011.
- ^ "SRD134 Chlorine". NIST. Pristupljeno 12. 9. 2012.
- ^ Wiberg 2001, str. 409.
- ^ Greenwood 1997, str. 857–858.
- ^ a b Georges, Audi; Bersillon, O.; Blachot, J.; Wapstra, A.H. (2003). "The NUBASE Evaluation of Nuclear and Decay Properties". Nuclear Physics A. Atomic Mass Data Center. 729: 3–128. doi:10.1016/j.nuclphysa.2003.11.001
- ^ Gamow, George (1967). One Two Three... Infinity: Facts and Speculations of Science (Bantam Science and Mathematics izd.). Bantam. str. 151–154.
- ^ Cameron, A.G.W. (1. 6. 1957). "Stellar Evolution, Nuclear Astrophysics, and Nucleogenesis" (PDF). CRL-41.
- ^ Greenwood 1997, str. 795.
- ^ "Risk assessment and the cycling of natural organochlorines" (PDF). Euro Chlor. Arhivirano s originala (PDF), 26. 7. 2011. Pristupljeno 14. 3. 2015.
- ^ Greenwood 1997, str. 798.
- ^ a b Wiberg 2001, str. 408.
- ^ "The diaphragm cell process". Euro Chlor. Pristupljeno 15. 8. 2007.
- ^ "The membrane cell process". Euro Chlor. Pristupljeno 15. 8. 2007.
- ^ "Battle of Ypres" The Canadian Encyclopedia
- ^ Smil, Vaclav (1. 4. 2004). Enriching the Earth: Fritz Haber, Carl Bosch, and the Transformation of World Food Production. str. 226. ISBN 978-0-262-69313-4.
- ^ "Weapons of War: Poison Gas". First World War.com. Pristupljeno 12. 8. 2007.
- ^ The Elements: A Visual Exploration of Every Known Atom in the Universe, Black Dog & Leventhal Publishers, 2012, ISBN 9781579128951
- ^ Pišmerge: DAIŠ upotrijebio otrovni plin hlor, portal IRIB - Bosanski radio program, 16. mart 2015, pristupljeno 11. augusta 2015.
- ^ Greenwood 1997, str. 806.
- ^ Windholz, Martha, ured. (1976). Merck Index of Chemicals and Drugs, 9th ed. Rahway, N.J.: Merck & Co. ISBN 0-911910-26-3.
- ^ Greenwood 1997, str. 844–850.
- ^ Greenwood 1997, str. 849.
- ^ Cotton, F. Albert and Wilkinson, Geoffrey (1966). Advanced Inorganic Chemistry, 2nd ed. John Wiley & sons. str. 568.CS1 održavanje: više imena: authors list (link)
- ^ Emeléus, H. J (1961). Advances in inorganic chemistry and radiochemistry. str. 133–143. ISBN 978-0-12-023603-9.
Literatura
[uredi | uredi izvor]- Greenwood, Norman N; Earnshaw, Alan (1997). Chemistry of the Elements (2 izd.). Oxford: Butterworth-Heinemann. ISBN 0-08-037941-9.
- Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic Chemistry. Academic Press. ISBN 0-12-352651-5.




