Vanadij
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vanadij u periodnom sistemu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hemijski element, Simbol, Atomski broj | Vanadij, V, 23 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serija | Prelazni metali | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupa, Perioda, Blok | 5, 4, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izgled | srebrenasto-sivi metal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS registarski broj | 7440-62-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zastupljenost | 0,041[1] % | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomska masa | 50,9415[2] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomski radijus (izračunat) | 135 (171) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentni radijus | 153 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsov radijus | ? pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronska konfiguracija | [Ar] 3d34s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Broj elektrona u energetskom nivou | 2, 8, 11, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. energija ionizacije | 650,9 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. energija ionizacije | 1414 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. energija ionizacije | 2830 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. energija ionizacije | 4507 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. energija ionizacije | 6298,7 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikalne osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Agregatno stanje | čvrsto | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohsova skala tvrdoće | 7,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristalna struktura | kubična prostorno centrirana | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gustoća | 6110[3] kg/m3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetizam | paramagnetičan ( = 3,8 · 10−4)[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka topljenja | 2183 K (1910 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka ključanja | 3680[5] K (3407 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molarni volumen | 8,32 · 10-6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota isparavanja | 444[5] kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota topljenja | 21,5[6] kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pritisak pare | 3,06 Pa pri 2175 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brzina zvuka | 4560 m/s pri 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifična toplota | 489[1] J/(kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifična električna provodljivost | 5 · 106 S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplotna provodljivost | 31 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hemijske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksidacioni broj | +5, +4, +3, +2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativnost | 1,63 (Pauling-skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sigurnosno obavještenje | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oznake upozorenja Prah | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obavještenja o riziku i sigurnosti | R: 17-36/37/38 (prah) S: 7-26-33-37-43-60 (prah) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ako je moguće i u upotrebi, koriste se osnovne SI jedinice. Ako nije drugačije označeno, svi podaci dobijeni su mjerenjima u normalnim uvjetima. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vanadij je hemijski element sa simbolom V i atomskim brojem 23. To je čelično-sivi metal s plavim odsjajem. Dosta je tvrd, ali veoma kovan metal, te se ubraja u prelazne metale. U periodnom sistemu, vanadij, zajedno sa težim elementima niobijem, tantalom i dubnijem, sačinjava 5. grupu ili grupu vanadija. Najveći dio vanadija koristi se u takozvanom ferovanadiju za proizvodnju posebnih čelika. Dodatak vanadija u hrom-vanadijskim čelicima dovodi do povećanja žilavosti a time i do povećanja otpornosti čelika.
Element posjeduje različite biološke uloge i značaj, a za mnoge žive organizme je esencijalni mineral. Tako naprimjer vanadij ima određenu ulogu pri upravljanju enzimima koji učestvuju u fosforiliranju, a koriste ga i neke bakterije za fiksiranje dušika. S druge strane, za njega ili njegove spojeve sumnja se da djeluju kao mutageni klastogeni koji izazivaju promjene na hromosomima te su proglašeni otrovima i karcinogenima.[7]
Najpoznatiji spoj vanadija je vanadij(V)-oksid, koji se koristi kao katalizator u proizvodnji sumporne kiseline.
Historija[uredi | uredi izvor]

Metal, za koji se kasnije ispostavilo da je vanadij, otkrio je španski mineralog Andrés Manuel del Río u meksičkoj rudi olova, kasnije nazvanoj vanadinit. Novi element, on je nazvao panhromij zbog njegove raznolikosti u pogledu boja, a kasnije je preimenovan u eritronij jer su njegove soli nakon zakiseljavanja dobijale crvenu boju. Međutim, del Riovo otkriće su opovrgavali Alexander von Humboldt te kasnije i francuski hemičar H.V. Collett-Desotils zbog sličnosti vanadija sa spojevima hroma, te su smatrali da se kod navodnog novog elementa radi o hromu sa određenim primjesama.[8]
Vanadij je ponovno otkrio 1830. godine švedski hemičar Nils Gabriel Sefström. On je ispitivao željezo iz švedskog rudnika željeza Taberg, tako što je rudu otapao u hlorovodičnoj kiselini. Pri tome je pored drugih poznatih materijala otkrio i jedan nepoznati element, koji je u nekim osobinama dosta nalikovao hromu, ali je također pokazivao i osobine svojstvene uraniju. Međutim, nakon kasnijih ispitivanja, nije se radilo o ova dva elementa. Novom elementu dali su ime po Vanadisu, drugom imenu nordijske božice Freye. Nedugo zatim Friedrich Wöhler, koji se sa Berzeliusom već s tim bavio, pružio je dokaz identiteta i povezao vanadij sa ranije opisanim eritronijem.[9][10]
Vanadij u čistom, metalnom obliku prvi je sačinio Henry Enfield Roscoe 1867. putem redukcije vanadij(II) hlorida sa vodikom. Čisti 99,7% vanadij dobili su John Wesley Marden i Malcolm Rich 1925. godine redukcijom vanadij(V) oksida sa kalcijem.[11] U Engleskoj se od 1903. počeo koristiti vanadij za legiranje čelika. Veća upotreba ovog elementa u industriji čelika otpočela je 1905. kada je Henry Ford počeo koristiti vanadijske čelike u proizvodnji svojih automobila.[12]
Osobine[uredi | uredi izvor]
Fizičke[uredi | uredi izvor]
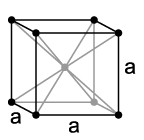
Vanadij je nemagnetični, tvrdi ali kovni teški metal, čelično-plave nijanse. Ima gustoću od 6,11 g/cm3.[12] Čisti vanadij je relativno mehak, ali u prisustvu i najmanje količine primjese drugih elemenata postaje izuzetno tvrd i ima izuzetno veliku mehaničku čvrstoću. Po većini osobina, on nalikuje svom "komšiji" iz periodnog sistema, titaniju. Tačka topljenja čistog vanadija iznosi 1910 °C, a ako su prisutne nečistoće, poput ugljika, ona je znatno viša. Tako naprimjer pri udjelu od oko 10% ugljika, tačka topljenja iznosi oko 2700 °C.[13] Vanadij se kristalizira slično kao hrom ili niobij u kubičnoj prostorno-centriranoj kristalnoj strukturi sa Im3m i parametrom rešetke a = 302,4 pm kao i dvije formulske jedinice po elementarnoj ćeliji.[14]
Ispod kritične temperature od 5,13 K, vanadij postaje superprovodnik.[15] Kao i čisti vanadij, i njegove legure sa galijem, niobijem i cirkonijem također su superprovodnici. Pri temperaturama ispod 5,13 K, kao i metali iz njegove grupe niobij i tantal, vanadij isitnjen u sićušnim grudvicama od po 200 atoma iskazuje neobičnu osobinu električne polarizacije koja do danas nije objašnjena. Osim njega, takvu osobinu imaju samo nemetali.[16][17]
Hemijske[uredi | uredi izvor]
Vanadij nije plemeniti metal i u mogućnosti je reagirati sa mnogim nemetalima. Izložen zraku zadržava metalni sjaj nekoliko sedmica. Međutim, nakon dužeg vremenskog perioda postaje primjetan nastanak zelenkaste korozije. Ukoliko je potrebno konzervirati metalni vanadij, on se mora držati zatvoren u atmosferi argona. Pri visokoj temperaturi napada ga kisik i oksidira u vanadij(V) oksid. I dok sa ugljikom i dušikom reagira tek kad je zagrijan do bijelog usijanja, reakcije sa fluorom i hlorom odvijaju se i u hladnom stanju.
Prema kiselinama i bazama pri sobnoj temperaturi, vanadij je pretežno stabilan zbog svog tankog pasiviziranog sloja oksida. Napada ga samo fluoridna kiselina kao i kiseline koje djeluju snažno oksidirajuće, poput vruće dušične kiseline, koncentrirane sumporne kiseline i carske vode.
Do temperature od oko 500 °C, vanadij može apsorbirati vodik. Pri tome metal postaje veoma krhak i može se vrlo lahko pretvoriti u prah. Vodik se može osloboditi iz vanadija tek pri 700 °C u vakuumu.[12]
Izotopi[uredi | uredi izvor]
Poznato je 25 izotopa vanadija i šest nuklearnih izomera.[18] Samo dva izotopa se javljaju u prirodi. To su izotop 50V sa prirodnom rasprostranjenošću od 0,25% i 51V kojeg ima 99,75%. Izotop 50V je blago radioaktivan. Raspada se sa vremenom poluraspada od 1,5 · 1017 godina tako što 83% izotopa putem elektronskog zahvata prelazi u 50Ti dok 17% izotopa putem β−-raspada prelazi u 50Cr.[18] Oba jezgra se mogu koristiti za ispitivanja sa NMR-spektroskopijom.
Najstabilniji vještački izotopi su 48V sa vremenom poluraspada od 16 dana i 49V koji ima vrijeme poluraspada od 330 dana. Ovi izotopi našli su primjenu u nuklearnoj medicini kao traseri.[13] Svi ostali izotopi i nuklearni izomeri su veoma nestabilni i raspadaju se u vremenu od nekoliko minuta ili sekundi.
Rasprostranjenost[uredi | uredi izvor]


Vanadij na Zemlji je veoma čest hemijski element. U kontinentalnoj Zemljinoj kori njegov udio iznosi oko 120 ppm. Sa sličnim udjelom, u Zemljinoj kori nalaze se i elementi kao što su cirkonij, hlor i hrom. Vanadij se ne javlja samorodan, nego u sklopu raznih minerala. I pored relativno velike rasprostranjenosti, nalazišta vanadija u kojima se on nalazi u većim koncentracijama vrlo su rijetka, jer su i mnogi njegovi minerali veoma rijetki. U usporedbi sa Zemljinom korom, njegov udio u morskoj vodi je znatno niži i kreće se oko 1,3 μg/l.[19]
U najvažnije minerale vanadija uglavnom se ubrajaju vanadati kao što je vanadinit [Pb5(VO4)3Cl], deskloizit, Pb(Zn, Cu) [OH|VO4] i karnotit [K2(UO2)2(VO4)2·3H2O], kao i vanadij-sulfat patronit VS4. Najveći dio vanadija nalazi se u tragovima u sklopu drugih metala, najčešće u rudama željeza poput magnetita. Udio vanadija u titanij-željeznim rudama iznosi većinom između 0,3 i 0,8%,[20] ali u mnogim južnoafričkim rudama može iznositi i do 1,7%.[12]
Biljni i životinjski organizmi također sadrže vanadij, tako naprimjer u čovjekovom organizmu udio vanadija iznosi oko 0,3 mg/kg. Najviše vanadija sadržano je u ćelijskim jedrima ili mitohondrijama. Neki živi organizmi, prije svega neke vrste plaštaša iz klase Ascidiacea i gljiva muhara, imaju sposobnost obogaćivanja vanadija. Kod Ascidiacea udio vanadija je i do 10 miliona puta veći od njegovog udjela u okolnoj morskoj vodi.[13] Zbog udjela vanadija u tim živim bićima, i ugalj i nafta koji su nastali od njih, također sadrže vanadij. Udio vanadija u nafti i uglju iznosi do 0,1 %.[20] Naročito velike udjele vanadija mogu se naći u nafti koja potječe iz Venecuele i Kanade.[13]
U svijetu je 2006. iskopano ukupno 55.700 tona ruda vanadija (preračunato u vidu metala). Najznačajniji proizvođači su Južnoafrička Republika, Kina i Rusija. Vanadij se ne smatra rijetkom sirovinom jer su njegove ukupne poznate rezerve procijenjene na oko 63 miliona tona.[21]
Dobijanje[uredi | uredi izvor]


Dobijanje metalnog vanadija odvija se u nekoliko koraka. Prvo se iz raznih početnih sirovina mora dobiti vanadij(V) oksid. On se dalje može reducirati do elementarnog vanadija, te dalje po potrebi pročišćavati. Moguće polazne sirovine iz kojih se može dobiti vanadij su njegove rude poput karnotita i patronita, titanijsko-željezne rude koje ga također sadržavaju i sirova nafta. Rude vanadija u prošlosti su bile vrlo važne za njegovu proizvodnju, ali danas ne igraju važnu uloge jer su ih zamijenile titanijsko-željezne rude.
Kada se željezne rude sa primjesama vanadija reduciraju u procesu visoke peći, vanadij prvo ostaje u sirovom željezu. Da bi se ono dalje prerađivalo u čelik, tokom njegovog oplemenjivanja kada se u smjesu upuhava kisik. U tom procesu vanadij prelazi u šljaku. Ona sadrži i do 25% vanadij(V) oksida te je vrlo važna sirovina za dobijanje ovog metala. Da bi se dalje dobio čisti vanadij(V) oksid, fino isitnjena šljaka se prži sa oksidirajućim natrijevim solima poput natrij-hlorida ili natrij-karbonata. Time nastaje nerastvorljivi natrij-metavanadat, koji se taloženjem odvaja od ostatka šljake. Dodavanjem kiselina i amonijevih soli ostatak vanadija se istaloži iz šljake u vidu nastalog amonij-polivandata. On se također može pretvoriti u vanadij(V) oksid pomoću žarenja. I iz drugih ruda koje sadrže vanadij također se može dobiti ovaj oksid na isti način. Iz sirove nafte, vanadij se dobija pomoću emulzije dodavanjem vode i magnezij-nitrata u naftu te se ta emulzija izdvaja. Daljnji tok prerade uglavnom odgovara procesu kao i kod željeznih ruda.[12]
Dobijanje metalnog vanadija dešava se pomoću redukcije vanadij(V) oksida sa drugim metalima. Kao redukcijsko sredstvo mogu poslužiti aluminij, kalcij, ferosilicij ili ugljik. S ugljikom nastaju karbidi vanadija, iz kojih se metalni vanadij vrlo teško može odvojiti:
- redukcija sa kalcijem
Da bi se dobio potpuno čisti vanadij, kao redukcijsko sredstvo se mora koristiti relativno skupi kalcij ili aluminij, jer se u postupku sa dosta jeftinijim ferosilicijem ne može postići vrlo visok stepen čistoće vanadija. Dok se pri primjeni kalcija odmah dobija potpuno čisti vanadij, u reakciji sa aluminijem se prethodno dobija legura vanadija i aluminija, iz koje se putem sublimacije u vakuumu izdvaja čisti vanadij. Najveći dio proizvedenog vanadija u svijetu ne troši se u obliku čistog metala, nego u formi legura sa željezom, takozvanim ferovanadijem, u kojem vanadij učestvuje sa najmanje 50%.[12] Da bi se on dobio, nije potrebno prethodno izdvajati čisti vanadij. Umjesto toga, šljaka koja sadrži vanadij i željezo reducira se sa ferosilicijem i kalcij-karbonatom do ferovanadija. Ovako dobijena legura primjenjuje se u većini tehničkih aplikacija.
Najčišći vanadij se može dobiti bilo elektrohemijski ili pomoću van Arkel-de Boerovog procesa. Za to je neophodno čisti vanadij istopiti sa jodom u staklenoj ampuli iz koje je odstranjen zrak. U zagrijanoj ampuli nastaje vanadij(III) jodid koji se na vreloj volframskoj žici raspada na veoma čisti vanadij i elementarni jod.
- redukcija u van Arkel-de Boerovom procesu
Upotreba[uredi | uredi izvor]

Legure[uredi | uredi izvor]
Približno 85% vanadija koji se proizvede u svijetu potroši se u obliku ferovanadijske legure ili kao dodatak za razne čelike.[22] Značajano povećanje čvrstoće u čeliku koji sadrži vrlo malehne količine vandija otkriveno je početkom 20. vijeka. Vanadij gradi stabilne nitride i karbide, što rezultira znatnim porastom čvrstoće čelika.[23] Od tog vremena, vanadijski čelici se koriste u aplikacijama za ramove za bicikle, razne osovine, zupčanike, bregaste osovine i druge kritične dijelove. Postoji dvije grupe legura čelika koji sadrže vanadij. Visokougljične čelične legure sa vanadijem sadrže 0,15% do 0,25% vanadija a brzi alatni čelici imaju udio vanadija od 1% do 5%. Kod takve vrste čelika, može se dostići tvrdoća po Rockwellu (HRC) od 60. HSS čelik se koristi u hirurškim instrumentima i alatima.[24] Neke legure metalurgije praha mogu sadržavati i do 18% vanadija. Veliki sadržaj karbida vanadija u tim legurama u velikoj mjeri povećava otpornost na habanje. Jedna od aplikacija za te legure su alati i noževi.[25]
Vanadij stabilizira beta oblik titanija i povećava njegovu snagu i temperaturnu stabilnost. U smjesi sa aluminijem u titanijskim legurama, vanadij se koristi u proizvodnji mlaznih motora za avione, avionskih oplata i zubnih implantata. Jedna od uobičajenih legura je titanij 6AL-4V, legura titanija sa 6% aluminija i 4% vanadija.[26]
Ostala upotreba[uredi | uredi izvor]

Vanadij je kompatibilan sa željezom i titanijem, pa se zbog toga vanadijske folije koriste za navarivanje titanija na čelik.[27] Osrednja veličina poprečnog presjeka zahvata termalnih neutrona i kratko vrijeme poluraspada izotopa nastalih zahvatom neutrona čini vanadij pogodnim materijalom za unutrašnju strukturu fuzijskog reaktora.[28][29] Nekoliko vanadijskih legura iskazuje superprovodničke osobine. Prvi superprovodnik A15 faze bio je spoj vanadija V3Si, otkriven 1952. godine.[30] Vanadij-galij traka se koristi za superprovodničke magnete (17,5 tesli ili 175.000 gausa). Struktura superprovodničke A15 faze V3Ga slična je onoj kod više uobičajenog Nb3Sn i Nb3Ti.[31]
Najčešći i najpoznatiji oksid vanadija, vanadij-pentoksid V2O5, koristi se kao katalizator u proizvodnji sumporne kiseline putem kontaktnog procesa[32] i kao oksidizacijsko sredstvo u proizvodnji maleinskih anhidrida.[33] Vanadij-pentoksid se također koristi za pravljenje keramike.[6] Drugi oksid vanadija, vanadij-dioksid VO2, koristi se u proizvodnji premaza stakla, koji blokiraju infracrveno zračenje (ali propuštaju vidljivu svjetlost) pri određenoj temperaturi.[34] Vanadij-oksid se također može koristiti za pobuđivanje centara boje u korundu kako bi se kreirao simulirani aleksandritni nakit, iako je aleksandrit u prirodi zapravo hrizoberil.[35]
Mogućnost korištenja vanadijskih redoks parova u obje polućelije, te time i eliminiranja problema međukontaminacije putem difuzije iona kroz membranu jeste prednost vanadijskih redoks punjivih baterija.[36] Vanadat se može upotrebljavati za zaštitu čelika protiv hrđe i korozije putem elektrohemijskog konverzijskog pokrivanja.[37] Litij-vanadij-oksid je predložen za upotrebu u anodama sa velikom gustoćom energije za litij-ionske baterije, pri 745 Wh/L kada se spari sa katodom od litij-kobalt-oksida.[38] Također neki istraživači su predložili da vrlo mala količina vanadija, 40 do 270 ppm, u Wootzovom i Damask-čeliku, u znatnoj mjeri poboljšava čvrstoću materijala, mada nije sasvim jasno šta bi bio izvor vanadija.[39] Litij-vanadij-fosfat je predviđen za nove baterije, a sam je vrlo dobro komercijalno primjenjiv jer su fosfati jeftini a vanadij čini baterije vrlo gusto energetski "pakovane".
Biološki značaj[uredi | uredi izvor]
Spojevi vanadija imaju razne biološke uloge i značaj. Za vanadij je karakteristično da se javlja bilo anionski kao vanadat a također i kationski u vidu VO2+, VO2+ ili V3+. Vanadati imaju veliku sličnost sa fosfatima te u skladu s tim i određene sličnosti u djelovanju. Pošto se vanadati znatno jače vežu na pogodne enzime od fosfata, oni su u mogućnosti da blokiraju enzime fosforiliranja i tako upravljaju tim procesom. To utječe naprimjer na djelovanje natrij-kalij-ATPaze, koja upravlja transportom natrija i kalija u ćelijama. Ova blokada se može vrlo brzo ukloniti pomoću desferioksamina B, stabilnog kompleksa sa vanadatom.[19] Nadalje, vanadij utječe i na apsorpciju glukoze. On ima sposobnost da stimulira glukolizu u jetri i da zaguši "konkurentski" proces glukoneogenezu. Pri tome dolazi do snižavanja nivoa glukoze u krvi.[20] Iz tog razloga istraživa se da li su spojevi vanadija pogodni za tretman dijabetesa tip 2. Međutim, u tim istraživanjima još uvijek nisu postignuti nedvosmisleni rezultati i zaključci.[40] Osim navedenog, vanadij također stimulira i oksidaciju fosfolipida i potiskuje sintezu holesterola tako što inhibira skvalen sintazu, mikrosomalni enzimski sistem jetre. Nasuprot toga, nedostatak vanadija izaziva povećanu koncentraciju holesterola i triglicerida u krvnoj plazmi.[41]
U biljkama vanadij igra ulogu u fotosintezi. On je u mogućnosti da katalizira reakciju za nastanak aminolevulinske kiseline bez enzima. To je vrlo važan prethodnik za pravljenje hlorofila.[19]
Reference[uredi | uredi izvor]
- ^ a b Harry H. Binder (1999). Lexikon der chemischen Elemente. Stuttgart: S. Hirzel Verlag. ISBN 3-7776-0736-3.
- ^ CIAAW, Standard Atomic Weights Revised 2013
- ^ N. N. Greenwood, A. Earnshaw (1988). Chemie der Elemente (1 izd.). Weinheim: VCH. str. 1260. ISBN 3-527-26169-9.
- ^ Weast, Robert C., ured. (1990). CRC Handbook of Chemistry and Physics (70 izd.). Boca Raton: CRC (Chemical Rubber Publishing Company). str. E-129 do E-145. ISBN 0-8493-0470-9.
- ^ a b Yiming Zhang, Julian R. G. Evans, Shoufeng Yang (2011). "Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks". Journal of Chemical & Engineering Data. 56: 328–337. doi:10.1021/je1011086.CS1 održavanje: više imena: authors list (link)
- ^ a b David R. Lide, ured. (2010). "Fluid Properties; Enthalpy of Fusion". CRC Handbook of Chemistry and Physics (90 izd.). Boca Raton, FL: CRC Press/Taylor and Francis. str. 6-135.
- ^ Juan J. Rodríguez-Mercado, Rodrigo A. Mateos-Nava, Mario A. Altamirano-Lozano: DNA damage induction in human cells exposed to vanadium oxides in vitro. u: Toxicology in Vitro 25, br. 8, 2011, str. 1996–2002, doi:10.1016/j.tiv.2011.07.009.
- ^ L. R. Caswell: Andres del Rio, Alexander von Humboldt, and the Twice-Discovered Element (PDF). u: Bull. Hist. Chem.. 2003, 28 (1), str. 35–41.
- ^ N. G. Sefstöm: Über das Vanadin, ein neues Metall, gefunden im Stangeneisen von Eckersholm, einer Eisenhütte, die ihr Erz von Taberg in Småland bezieht. u: Annal. d. Physik, 1831, 97 (1), str. 1–4.
- ^ Pismo Berzeliusa upućeno Wöhleru 22. januara 1831. u djelu: O. Wallach (ur.): Briefwechsel zwischen J. Berzelius und F. Wöhler. Leipzig 1901.
- ^ Vanadium. u: Encyclopædia Britannica. 2008. Encyclopædia Britannica Online, pristupljeno 6. oktobra 2008. (online).
- ^ a b c d e f Günter Bauer et al.: Vanadium and Vanadium Compounds. u: Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim 2000, doi:10.1002/14356007.a27_367.
- ^ a b c d Arnold F. Holleman; E. Wiberg; N. Wiberg (2007). Lehrbuch der Anorganischen Chemie (102 izd.). Berlin: de Gruyter. str. 1542-1543. ISBN 978-3-11-017770-1.CS1 održavanje: više imena: authors list (link)
- ^ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. u: Acta Crystallographica, 1974, 30, str. 193–204, doi:10.1107/S0567740874002469.
- ^ Aaron Waxler, William S. Corack: Superconductivity of Vanadium. u: Physical Review, 1952, 85, (1), str. 85–90, doi:10.1103/PhysRev.85.85.
- ^ T. Krome: Metalle auf Abwegen. Über das ungewöhnliche Tieftemperaturverhalten winziger Metallklumpen. u: Spektrumdirekt.de od 22. maja 2003; sažetak, pristupljeno 23. oktobra 2015.
- ^ Ramiro Moro, Xiaoshan Xu, Shuangye Yin, Walt A. de Heer: Ferroelectricity in Free Niobium Clusters, u: Science, 2003, Vol. 300, br. 5623, str. 1265–1269, doi:10.1126/science.1083247.
- ^ a b G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra (2003). "The NUBASE evaluation of nuclear and decay properties" (PDF). Nuclear Physics. A 729: 3–128. doi:10.1016/S0375-9474(97)00482-X. Arhivirano s originala 24. 7. 2013. Pristupljeno 22. 10. 2015.CS1 održavanje: više imena: authors list (link) CS1 održavanje: bot: nepoznat status originalnog URL-a (link)
- ^ a b c Dieter Rehder: Bioanorganische Chemie des Vanadiums. u: Angewandte Chemie, 1991, 103, str. 152–172.
- ^ a b c Vanadium u: Thieme Chemistry (izdavač): RÖMPP Online – Version 3.13. Georg Thieme Verlag KG, Stuttgart 2011.
- ^ U.S. Geological Survey: Vanadium, Mineral Commodity Summaries, januar 2008. (PDF)
- ^ R. R. Moskalyk; Alfantazi, A. M. (2003). "Processing of vanadium: a review". Minerals Engineering. 16 (9): 793. doi:10.1016/S0892-6875(03)00213-9.CS1 održavanje: više imena: authors list (link)
- ^ Harry Chandler (1998). Metallurgy for the Non-metallurgist. ASM International. str. 6–7. ISBN 978-0-87170-652-2.
- ^ Joseph R. Davis (1995). Tool Materials: Tool Materials. ASM International. ISBN 978-0-87170-545-7.
- ^ Oleg D Neikov; Stanislav Naboychenko; Irina B Mourachova; et al. Handbook of Non-Ferrous Metal Powders: Technologies and Applications. str. 490. ISBN 9780080559407. Pristupljeno 17. 10. 2013. Nepoznati parametar
|datum=zanemaren (prijedlog zamjene:|date=) (pomoć); Eksplicitna upotreba et al. u:|author=(pomoć)CS1 održavanje: više imena: authors list (link) - ^ Manfred Peters; Leyens, C. (2002). "Metastabile β-Legierungen". Titan und Titanlegierungen. Wiley-VCH. str. 23–24. ISBN 978-3-527-30539-1.CS1 održavanje: više imena: authors list (link)[mrtav link]
- ^ N. T. Lositskii; Grigor'ev A. A. Khitrova, G. V. (1966). "Welding of chemical equipment made from two-layer sheet with titanium protective layer (review of foreign literature)". Chemical and Petroleum Engineering. 2 (12): 854–856. doi:10.1007/BF01146317.CS1 održavanje: više imena: authors list (link)
- ^ H. Matsui; Fukumoto, K.; Smith, D. L.; Chung, Hee M.; et al. (1996). "Status of vanadium alloys for fusion reactors". Journal of Nuclear Materials. 233–237 (1): 92–99. Bibcode:1996JNuM..233...92M. doi:10.1016/S0022-3115(96)00331-5. Eksplicitna upotreba et al. u:
|author=(pomoć)CS1 održavanje: više imena: authors list (link) - ^ "Vanadium Data Sheet" (PDF). ATI Wah Chang. Arhivirano s originala (PDF), 25. 2. 2009. Pristupljeno 16. 1. 2009.
- ^ George F. Hardy; Hulm, John K. (1953). "Superconducting Silicides and Germanides". Physical Reviews. 89 (4): 884–884. Bibcode:1953PhRv...89Q.884H. doi:10.1103/PhysRev.89.884.CS1 održavanje: više imena: authors list (link)
- ^ Markiewicz W.; Mains, E.; Vankeuren, R.; et al. (1977). "A 17.5 Tesla superconducting concentric Nb3Sn and V3Ga magnet system". IEEE Transactions on Magnetics. 13 (1): 35–37. Bibcode:1977ITM....13...35M. doi:10.1109/TMAG.1977.1059431. Eksplicitna upotreba et al. u:
|author=(pomoć)CS1 održavanje: više imena: authors list (link) - ^ Eriksen K. M.; Karydis, D. A.; Boghosian, S.; Fehrmann, R. (1995). "Deactivation and Compound Formation in Sulfuric-Acid Catalysts and Model Systems". Journal of Catalysis. 155 (1): 32–42. doi:10.1006/jcat.1995.1185.CS1 održavanje: više imena: authors list (link)
- ^ Michel Abon; Volta, Jean-Claude (1997). "Vanadium phosphorus oxides for n-butane oxidation to maleic anhydride". Applied Catalysis A: General. 157 (1–2): 173–193. doi:10.1016/S0926-860X(97)00016-1.CS1 održavanje: više imena: authors list (link)
- ^ Troy D. Manning; Parkin, Ivan P.; Clark, Robin J. H.; et al. (2002). "Intelligent window coatings: atmospheric pressure chemical vapour deposition of vanadium oxides". Journal of Materials Chemistry. 12 (10): 2936–2939. doi:10.1039/b205427m. Eksplicitna upotreba et al. u:
|author=(pomoć)CS1 održavanje: više imena: authors list (link) - ^ White Willam B.; Roy, Rustum; McKay, Chrichton (1962). "The Alexandrite Effect: And Optical Study" (PDF). American Mineralogist. 52: 867–871.CS1 održavanje: više imena: authors list (link)
- ^ Ludwig Joerissen; Garche, Juergen; Fabjan, Ch.; et al. (2004). "Possible use of vanadium redox-flow batteries for energy storage in small grids and stand-alone photovoltaic systems". Journal of Power Sources. 127 (1–2): 98–104. Bibcode:2004JPS...127...98J. doi:10.1016/j.jpowsour.2003.09.066. Eksplicitna upotreba et al. u:
|author=(pomoć)CS1 održavanje: više imena: authors list (link) - ^ H. Guan; Buchheit R. G. (2004). "Corrosion Protection of Aluminum Alloy 2024-T3 by Vanadate Conversion Coatings". Corrosion. 60 (3): 284–296. doi:10.5006/1.3287733.CS1 održavanje: više imena: authors list (link)
- ^ Koji Kariatsumari. "Li-Ion Rechargeable Batteries Made Safer". Nikkei Business Publications, Inc. Arhivirano s originala, 12. 9. 2011. Pristupljeno 10. 12. 2008. Nepoznati parametar
|datum=zanemaren (prijedlog zamjene:|date=) (pomoć) - ^ J. D. Verhoeven; Pendray, A. H. Dauksch, W. E. (1998). "The key role of impurities in ancient damascus steel blades". Journal of the Minerals, Metals and Materials Society. 50 (9): 58–64. Bibcode:1998JOM....50i..58V. doi:10.1007/s11837-998-0419-y.CS1 održavanje: više imena: authors list (link)
- ^ D.M. Smith, R.M. Pickering; G.T. Lewith (2008). "A systematic review of vanadium oral supplements for glycaemic control in type 2 diabetes mellitus". QJM: An International Journal of Medicine. 101 (5): 351–358. doi:10.1093/qjmed/hcn003.CS1 održavanje: više imena: authors list (link)
- ^ Wissenschaft-Online-Lexika: Pojam Vanadium, u: Lexikon der Biologie; pristupljeno 9. jula 2008.
| Commons ima datoteke na temu: Vanadij |






