Rodij
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rodij u periodnom sistemu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hemijski element, Simbol, Atomski broj | Rodij, Rh, 45 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serija | Prelazni metali | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupa, Perioda, Blok | 9, 5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izgled | srebreno bijeli metal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS registarski broj | 7440-16-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zastupljenost | 1 · 10−7[1] % | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomska masa | 102,90550[2] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomski radijus (izračunat) | 135 (173) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentni radijus | 142 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsov radijus | pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronska konfiguracija | [Kr] 4d85s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Broj elektrona u energetskom nivou | 2, 8, 18, 16, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. energija ionizacije | 719,7 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. energija ionizacije | 1740 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. energija ionizacije | 2997 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikalne osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Agregatno stanje | čvrsto | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohsova skala tvrdoće | 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristalna struktura | kubna plošno centrirana | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gustoća | 12380[3] kg/m3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetizam | paramagnetičan ( = 1,7 · 10−4)[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka topljenja | 2236 K (1963[5] °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka ključanja | 4000[6] K (3727 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molarni volumen | 8,28 · 10−6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota isparavanja | 531[6] kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota topljenja | 21,7 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brzina zvuka | 4700 m/s pri 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifična toplota | 243[7] J/(kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifična električna provodljivost | 23,3 · 106 S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplotna provodljivost | 150 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hemijske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksidacioni broj | 0, +1, +2, +3, +4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksid | Rh2O | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrodni potencijal | 0,76 V (Rh3+ + 3e− → Rh) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativnost | 2,28 (Pauling-skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sigurnosno obavještenje | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oznake upozorenja | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obavještenja o riziku i sigurnosti | R: 11 S: 16-22-24/25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ako je moguće i u upotrebi, koriste se osnovne SI jedinice. Ako nije drugačije označeno, svi podaci dobijeni su mjerenjima u normalnim uvjetima. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Rodij je hemijski element sa hemijskim simbolom Rh i atomskim brojem 45. To je srebreno-sjajni, tvrdi, nereaktivni prelazni metal. U periodnom sistemu, zajedno sa kobaltom, iridijem i majtnerijem spada u 9. grupu odnosno "grupu kobalta". Rodij ima dosta sličnosti sa drugim platinastim elementima poput platine ili paladija. To naprimjer uključuje vrlo slabu reaktivnost karakterističnu za plemenite metale kao i veliku katalitičku aktivnost.
Zbog tih osobina, rodij se koristi pretežno u obliku legura kao katalizator. Kao važan dio katalizatora u motornim vozilima, on pomaže pri redukciji dušikovih oksida. Rodijevi katalizatori se koriste i u nekim industrijskim procesima za proizvodnju određenih hemijskih supstanci, poput proizvodnje šalitre putem Ostwaldovog procesa. Pošto se ovaj metal vrlo rijetko nalazi u prirodi a pri tom ima vrlo veliki obim upotrebe, ubraja se među najskuplje metale uopće. U ljudskom tijelu ga nema, a njegova biološka funkcije nije poznata.[8]
Historija[uredi | uredi izvor]
Rodij je otkrio William Hyde Wollaston 1803. u uzorku rude sirove platine iz Južne Amerike. U istoj rudi, Wollaston i Smithson Tennant otkrili su još tri druga platinska metala: paladij, osmij i iridij. Prvo su rudu otopili u "carskoj vodi" (Aqua regia). Razdvojio se rastvorljivi dio i crni nerastvorljvi ostatak, u kojem je Tennant pronašao osmij i iridij. Wollaston je uspio iz rastvora carske vode istaložiti rodij te neke druge sastojke sa cinkom u prahu.
Nakon odvajanja bakra i olova razblaženom nitratnom kiselinom te ponovnim rastvaranjem u carskoj vodi i dodavanju natrij-hlorida nastao je Na3[RhCl6] · n H2O, da bi nakon isparavanja tekućine preostala ružičasto-crvena so. Iz nje je Wollaston ekstrakcijom sa etanolom i redukcijom sa cinkom uspio dobiti elementarni rodij. Izabrao je ime po starogrčkoj riječi ῥόδεος rhodeos ("ružičasto-crven"), pošto mnogi spojevi rodija pokazuju upravo tu boju.[9]
Od 1820. među prvim načinima upotrebe novih metala bila je izrada vrhova naliv-pera, za šta se upotrebljavala legura rodija i kalaja. Međutim, ona je kasnije zamijenjena tvrđim legurama osmija i iridija.[9]
Osobine[uredi | uredi izvor]

Fizičke[uredi | uredi izvor]
Rodij je srebreno-svijetli, teško topivi, tvrdi plemeniti metal. Dostaje tvrđi od zlata ili platine, ali i pored toga se lahko izvlači u žice i može se kovati. Po mnogim osobinama može se uporediti sa drugim platinskim elementima. Tako naprimjer tačka topljenja rodija iznosi 1966 °C što je između one kod platine (1772 °C) i rutenija (2334 °C). Gustoća elementa od 12,41 g/cm3 također se može porediti sa "susjednim" elementima iz periodnog sistema rutenijem i paladijem. Rodij ima najvišu provodljivost topline i električne struje od svih platinskih metala. Na temperaturi ispod 0,9 K rodij postaje superprovodnik.[10]
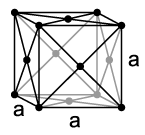
Rodij se kristalizira poput kobalta i iridija u kuglastom kubičnom kristalnom sistemu (tip bakra) sa prostornom grupom Fm3m (br. 225) i sa parametrom rešetke a = 380,4 pm kao i četiri formulske jedinice po elementarnoj ćeliji.[11]
Hemijske[uredi | uredi izvor]
Kao tipični plemeniti metal, rodij je veoma hemijski inertan. Poslije iridija je najmanje reaktivni platinski metal. Reagira sa kisikom i hlorom tek pri temperaturi od 600 do 700 °C gradeći rodij(III)-oksid odnosno rodij(III)-hlorid. Također sa najreaktivnijim halogenom fluorom reagira tek pri visokoj temperaturi dajući rodij(VI)-fluorid. Mineralne kiseline ne napadaju ovaj metal. Jedini izuzetak čini fino isitnjeni rodij, koji se vrlo polahko otapa u carskoj vodi i koncentriranoj sumpornoj kiselini.
Metal reagira sa nekim istopljenim solima te se na taj način može odvojiti iz smjese. Soli, sa kojima je to moguće, su natrij-hidrogensulfat, kalij-disulfat, cijanid i natrij-karbonat. Kisik se rastvara u tečnom rodiju. Pri njegovom hlađenju i očvršćivanju, kisik se iz njega ponovno oslobađa.
Izotopi[uredi | uredi izvor]
Poznata su ukupno 33 izotopa kao i 20 nuklearnih izomera rodija.[12] Prirodni rodij se u potpunosti sastoji iz jednog izotopa 103Rh te stoga spada među 22 poznata jednoizotopna elementa. Vještački izotopi sa najdužim vremenom poluraspada su 101Rh koji se raspada na 101Ru za 3,3 godine (t1/2) putem elektronskog zahvata. Neznatnim dijelom njegov raspad ide preko metastabilnog jezgra izomernim prelazom u 102Rh.[12] Kratkoživuće jezgro izotopa 105Rh sa vremenom poluraspada od 35,88 sati našlo je primjenu u medicini kao traser.
Rasprostranjenost[uredi | uredi izvor]
Rodij je, zajedno sa rutenijem i iridijem, a poslije renija, jedan od najrjeđi neradioaktivnih metala u kontinentalnom dijelu Zemljine kore. Njegov udio na Zemlji iznosi približno 1 ppb (jedan gram na 1.000 tona).[7] U prirodi, rodij se može javljati i u samorodnom obliku, pa je zbog toga priznat i kao mineral. Među najvažnije tiplokalitete rodija ubraju se okrug Stillwater u Montani te zaliv Goodnews na Aljasci. Na tim lokalitetima, rodij prati, između ostalih, druge platinske metale i zlato.[13]
Pored elementarnog rodija, poznati su i neki njegovi minerali kao što su bowieit, genkinit ili miasit. Međutim, i oni su kao i elementarni rodij veoma rijetki te za njegovo dobijanje ne igraju nikakvu važniju ulogu. Najvažnija nalazišta elementa nalaze se u sulfidnim nikl-bakarnim rudama, kojih najviše ima u Južnoafričkoj Republici, Kanadi (Sudbury) i Sibiru. U depozitima zlata u Meksiku također se javlja rodij u značajnijim količinama. Pri preradi ovih ruda, rodij se taloži zajedno sa drugim platinskim metalima te se na kraju obrade mora izdvojiti iz njih.
Dobijanje[uredi | uredi izvor]

Dobijanje metalnog rodija je kao i dobijanje drugih platinskih metala veoma zahtjevno. To se odnosi prvenstveno na sličnost s njima i slabu reaktivnost te grupe elemenata, zbog čega se oni izuzetno teško odvajaju jedan od drugih. Polazna sirovina za dobijanje rodija je anodni mulj koji se taloži kao sporedni proizvodi pri elektrolizi u proizvodnji bakra i nikla. Najprije se mulj rastvara u carskoj vodi. Prvo se rastvara zlato, platina i paladij, dok rutenij, osmij, rodij i iridij kao i srebro u vidu srebro-hlorida preostaje nerastvoreno. Srebro-hlorid se zagrijavanjem sa olovo-karbonatom i nitratnom kiselinom prevodi u rastvorljivi srebro-nitrat i tako uklanja.
Da bi se rodij odvojio od drugih elemenata, nerastvorljivi ostatak se topi zajedno sa natrij-hidrogensulfatom. Nastaje rodij-sulfat (Rh2(SO4)3) koji je rastvorljiv u vodi, koji se može istaložiti s vodom. Rastvoreni rodij se najprije taloži sa natrij-hidroksidom u vidu rodij-hidroksida Rh(OH)3. Sljedeće faze procesa proizvodnje su rastvaranje u hlorovodičnoj kiselini čime nastaje H3[RhCl6] te taloženje sa natrij-nitritom i amonij-hloridom u obliku (NH4)3[Rh(NO2)6]. Da bi se došlo do elementarnog rodija, taj spoj se macerira hlorovodičnom kiselinom čime nastaje rastvorljivi kompleks (NH4)3[RhCl6]. Nakon što se isparavanjem ukloni voda, pomoću vodika se može reducirati do praškastog rodija.
-
- Reakcija amonij-heksahlororodata sa vodikom daje rodij
Izotopi rodija nastaju kao sporedni proizvodi pri cijepanju jezgra uranija 235U te se mogu ekstrahirati iz potrošenih gorivih elemenata. Zbog radioaktivnosti do danas ne postoji niti jedna komercijalna upotreba tako dobijenog rodija.[10]
Rodij se proizvodi u vrlo ograničenom obimu, tako da je svjetska proizvodnja u 2005. iznosila samo 23,5 tone. Od ukupne proizvodnje oko 83,2% se odnosi na Južnoafričku Republiku. Drugi najveći proizvođač je bila Rusija (11,9%) nakon koje slijede Kanada i Zimbabve.
Upotreba[uredi | uredi izvor]

Kao i drugi platinski metali, rodij u mnogim procesima djeluje katalitički. Ne samo metalni rodij djeluje tako, nego i njegovi spojevi i legure sa drugim platinskim metalima, pa se stoga u te svrhe i oni koriste. Osim katalitičkih, postoje i mogućnosti upotrebe rodija u druge svrhe, ali su načini upotrebe vrlo ograničeni zbog njegove visoke cijene.
Najvažnija oblast u kojoj se koristi rodij su katalizatori u vozilima. On u njima služi da omogući i ubrza redukciju dušik-monoksida do elementarnog dušika. Ako se umjesto rodija koristi platina ili paladij, dolazi do prekomjernog nastanka amonijaka i didušik-monoksida.[14] Dio rodija se koristi za katalizatore u industriji dušične kiseline. U takozvanom Ostwaldovom procesu za katalitičko sagorijevanje amonijaka do dušik-monoksida upotrebljavaju se mrežice, koje se sastoje iz legure platine sa rodijem gdje je njegov udio 10%. Korištenjem rodija povećava se postojanost i prinos reakcije u odnosu na korištenje čiste platine.[15] Također i u Andrussowom procesu za proizvodnju cijanovodične kiseline kao katalizatori se koriste legure platine i rodija.[10]
Uvođenje trofaznog katalizatorskog konvertora u vozila, koji je prvi uveo Volvo 1976. znatno je povećalo potražnju za rodijem. Stariji automobilski katalizatori koristili su samo platinu i paladij, dok se u trofaznim katalizatorskim konvertorima dodaje i rodij da bi se smanjila količina ispuštanja dušikovih oksida NOx.[16][17][18]
Metalni rodij se može koristiti i kao pokrivni sloj. S njim se prekrivaju površine za koje se želi da imaju veliku refleksiju svjetlosti pa se stoga on koristi za izradu vrlo skupih ogledala. Istovremeno, pokrivni sloj rodija je izuzetno tvrd i hemijski stabilan. Zbog toga se rodij koristi i za oblaganje satova, okvira za naočale i nakit. On štiti takve predmete od habanja osnovnog metala što je važno naročito za nakit od srebra ili "bijelog" zlata. Proces prekrivanja rodijem naziva se rodiniranje.[19]
Drugi vidovi upotrebe su visokozahtjevni laboratorijski uređaji i aparati, razni grijači ili termo-elementi, koji se prave od legura platine i rodija. Odkako su plemeniti metali ponovno došli u međunarodnu pažnju finansijskih ulagača, postoje i određeni finansijski proizvodi na fizičkoj osnovi rodija. Na osnovu kasnijeg ulaska u industriju poslije otkupa, rodij se uglavnom nudi u obliku praha. Od 2012. ulaganje u metalni rodij je prošireno ponudom rodija u obliku šipki.[20]
Cijena rodija na tržištu je snažno porasla jer je povećana potrošnja kao i potražnja u industriji nakita a svjetska proizvodnja u 2005. iznosila je 25,3 tone.[21] Tako naprimjer cijena je 2003. iznosila oko 475 US$ (u cijenama 2003. to je iznosilo 420 €) po unci (oko 31,1 gram),[22] a u junu 2008. sa cijenom od preko 9.700 dolara po unci (oko 6.230 €) ubrajao se u najskuplje metale uopće,[23][24] ali je poslije toga cijena pala na ispod 1.000 US$ u decembru 2008. Tri godine kasnije, 6. decembra 2011. cijena rodija se oporavila pa je koštao 1.675 US$.[22] Ipak, do kraja 2015. cijena je opet pala na oko 650 US$ po unci.[25]
Spojevi[uredi | uredi izvor]
Rodij gradi spojeve sa oksidacijskim stanjima od -I do +VI. Najstabilnije stanje je +III, dok viša stanja se javljaju pretežno u spojevima sa fluorom, a niža u kompleksima sa ligandima poput ugljik-monoksida, cijanida i fosfana.
Neki spojevi rodija, poput rodij(II)-karboksikompleksa,[26] se istražuju da li su pogodni za liječenje nekih oblika raka. Ti spojevi, kao i slični spojevi platine, su često hepatotoksični.[27][28]
Kompleksi[uredi | uredi izvor]
Neki kompleksi rodija se koriste u tehnički vrlo važnim sintezama organskih hemikalija kao katalizatori. U njih se ubrajaju Wilkinsonov katalizator, koji se sastoji iz kvadratno-planarnog kompleksa rodija sa tri liganda trifenilfosfana (PPh3) i jednim hloridnim ligandom. Jedna od reakcija koju on katalizira jeste hidriranje alkena sa vodikom. Također je moguće zamijeniti ligande sa hiralnim grupama, te na taj način postići asimetrično hidriranje. Takvo hidriranje se koristi, između ostalog, za sintezu aminokiseline L-DOPA.[29] Druga važna reakcija u kojoj se koristi Wilkinsonov katalizator je hidroformiliranje (oksosinteza). Pri toj reakciji se iz alkena, ugljik-monoksida i vodika dobijaju aldehidi.[30]
Rizici[uredi | uredi izvor]
Kompaktni rodij (u većim komadima) je zbog svoje slabe reaktivnosti gotovo bezopasan. Međutim, vrlo sitno načinjeni prah rodija je vrlo lahko zapaljiv i može sagorijevati. Pošto zapaljeni rodij reagira s vodom, za njegovo gašenje smiju se koristiti samo sredstva za gašenje zapaljenih metala (iz klase D).[31] Postoje određena saznanja da rodij i njegovi spojevi imaju karcinogena djelovanja pa su svrstani u kategoriju 3b kancerogenih supstanci.[31]
Kao i drugi ioni teških metala, i ioni rodija kada su u visokim koncentracijama u rastvoru djeluju otrovno. Jedno ispitivanje na epitelnim ćelijama pluća dalo je vrijednost smrtnosne doze LC50 od 1,2 mmol · l−1 za ione rodija.[32]
Vanjski linkovi[uredi | uredi izvor]
| Commons ima datoteke na temu: Rodij |
- The Periodic Table of Videos (University of Nottingham)
- American ElementsArhivirano 11. 10. 2007. na Wayback Machine
- The Element Rhodium, na stranici Jefferson Lab
Reference[uredi | uredi izvor]
- ^ Harry H. Binder (1999). Lexikon der chemischen Elemente. Stuttgart: S. Hirzel Verlag. ISBN 3-7776-0736-3.
- ^ CIAAW, Standard Atomic Weights Revised 2013
- ^ N. N. Greenwood; A. Earnshaw (1988). Chemie der Elemente (1 izd.). Weinheim: VCH. str. 1427. ISBN 3-527-26169-9.CS1 održavanje: više imena: authors list (link)
- ^ Weast, Robert C., ured. (1990). CRC Handbook of Chemistry and Physics. Boca Raton: CRC (Chemical Rubber Publishing Company). str. E-129 do E-145. ISBN 0-8493-0470-9., u ovoj knjizi je navedena vrijednost u g/mol.
- ^ J. A. Vaccari (2002). Materials Handbook. McGraw Hill. ISBN 978-0-07-136076-0.
- ^ a b Yiming Zhang, Julian R. G. Evans, Shoufeng Yang (2011). "Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks". Journal of Chemical & Engineering Data. 56: 328–337. doi:10.1021/je1011086.CS1 održavanje: više imena: authors list (link)
- ^ a b David R. Lide (2003). "Properties of the Elements and Inorganic Compounds". CRC Handbook of Chemistry and Physics (84 izd.). Boca Raton, Florida: CRC Press.
- ^ James E. Huheey, Ellen A. Keiter, Richard L. Keiter (2003). Anorganische Chemie (3 izd.). Berlin: de Gruyter. ISBN 3-11-017903-2.CS1 održavanje: više imena: authors list (link)
- ^ a b W. P. Griffith (2003). "Bicentenary of Four Platinum Group Metals, Part I Rhodium und Palladium". Platinum Metals Review. 47 (4): 175–183.
- ^ a b c Hermann Renner; et al. (2001). "Platinum Group Metals and Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a21_075. Eksplicitna upotreba et al. u:
|author=(pomoć) - ^ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. u: Acta Crystallographica, 1974, B30, str. 193–204.
- ^ a b G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra (2003). "The NUBASE evaluation of nuclear and decay properties" (PDF). Nuclear Physics. A 729: 3–128. Arhivirano s originala 15. 12. 2013. Pristupljeno 10. 2. 2016.CS1 održavanje: više imena: authors list (link) CS1 održavanje: bot: nepoznat status originalnog URL-a (link)
- ^ Anthony; et al. (1990). "Rhodium". Handbook of Mineralogy (pdf) (1 izd.). str. 101. Eksplicitna upotreba et al. u:
|author=(pomoć) - ^ Martin Votsmeier, Thomas Kreuzer, Gerhard Lepperhoff: Automobile Exhaust Control. u: Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2003, doi:10.1002/14356007.a03_189.
- ^ A. F. Holleman, E. Wiberg, N. Wiberg (2007). Lehrbuch der Anorganischen Chemie (102 izd.). Berlin: de Gruyter. str. 1697. ISBN 978-3-11-017770-1.CS1 održavanje: više imena: authors list (link)
- ^ Amatayakul W, Ramnäs Olle (2001). "Life cycle assessment of a catalytic converter for passenger cars". Journal of Cleaner Production. 9 (5): 395. doi:10.1016/S0959-6526(00)00082-2.
- ^ Heck R; Farrauto Robert J. (2001). "Automobile exhaust catalysts". Applied Catalysis A: General. 221: 443. doi:10.1016/S0926-860X(01)00818-3.CS1 održavanje: više imena: authors list (link)
- ^ Heck R; Gulati Suresh; Farrauto Robert J. (2001). "The application of monoliths for gas phase catalytic reactions". Chemical Engineering Journal. 82: 149. doi:10.1016/S1385-8947(00)00365-X.CS1 održavanje: više imena: authors list (link)
- ^ Rodiniranje i pozlaćivanje, pristupljeno 11. februara 2016, (sr)
- ^ "Rhodiumbarren" (jezik: engleski). Arhivirano s originala, 4. 3. 2016. Pristupljeno 27. 4. 2013.
- ^ Savezna uprava za geološke nauke i sirovine SR Njemačke: Rohstoffwirtschaftliche Steckbriefe für Metall- und Nichtmetallrohstoffe, stanje: januar 2007. (PDF) Arhivirano 20. 11. 2010. na Wayback Machine (de)
- ^ a b "Historijske cijene rodija na stranici kitco.com". Arhivirano s originala, 19. 1. 2016. Pristupljeno 13. 2. 2016.
- ^ Dana 19. juna 2008. cijena rodija je dostigla 10.200 US$ (tj. oko 6.580 eura), prije nego što je do novembra 2008. pala na 1.100 US$. (historija cijena) Arhivirano 23. 7. 2013. na Wayback Machine.
- ^ Savezna uprava za geološke nauke i sirovine SR Njemačke: Cijene sirovina, stanje juni 2008. Arhivirano 21. 5. 2014. na Wayback Machine
- ^ Cijena rodija
- ^ Esther B. Royar, Stephen D. Robinson: Rhodium(II)-Carboxylato Complexes. u: Platinum Metals Rev., 1982, 26 (2), str. 65–69 (PDF Arhivirano 24. 9. 2015. na Wayback Machine).
- ^ B. Desoize (2004). "Metals and metal compounds in cancer treatment". Anticancer Res. 24: 1529–1544. PMID 15274320.
- ^ N. Katsaros, A. Anagnostopoulou (2002). "Rhodium and its compounds as potential agents in cancer treatment". Critical Reviews in Oncology Hematology. 42: 297–308. PMID 12050021.
- ^ William S. Knowles: Asymmetrische Hydrierungen (Nobel-Vortrag). u: Angew. Chem., 114, 12, str. 2096–2107, doi:10.1002/1521-3757(20020617)114:12<2096::AID-ANGE2096>3.0.CO;2-Z.
- ^ Christoph Elschenbroich (2005). Organometallchemie (5 izd.). Wiesbaden: Teubner. ISBN 3-519-53501-7.
- ^ a b Rodij[mrtav link] u GESTIS bazi podataka, IFA, pristupljeno 4. aprila 2008.
- ^ Bernd Sures, Sonja Zimmermann: Untersuchungen zur Toxizität von Platin, Palladium und Rhodium. Programm Lebensgrundlage Umwelt und ihre Sicherung, Univerzitet Karlsruhe, 2005 (PDF Arhivirano 24. 9. 2015. na Wayback Machine).



![{\displaystyle \mathrm {2\ {(NH_{4})}_{3}{[RhCl_{6}]+3\ H_{2}}\longrightarrow } }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c6e9d6fecceb9096043e2cfc8462d519c2a33609)

