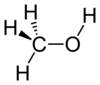
Metanol
Ovaj članak ili neki od njegovih odlomaka nije dovoljno potkrijepljen izvorima (literatura, veb-sajtovi ili drugi izvori). |
| Metanol | |
|---|---|
 | |
| Općenito | |
| Hemijski spoj | Metanol |
| Druga imena | metil-alkohol, hidroksimetan |
| Molekularna formula | CH4O |
| CAS registarski broj | 67-56-1 |
| Kratki opis | bezbojna tekućina |
| Osobine1 | |
| Molarna masa | 32,04 g/mol |
| Agregatno stanje | tekuće |
| Gustoća | 0,7918 g/cm3 |
| Tačka topljenja | –97 °C |
| Tačka ključanja | 64,7 °C |
| Rastvorljivost | potpuno rastvorljiv u vodi, etru i etanol |
| Dipolni moment | 1,69 D |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Metanol (poznat i kao metil-alkohol) je najprostiji alkohol. Vrlo je otrovan. U savremenoj industrijskoj proizvodnji zauzima najvažnije mjesto, u odnosu na druge alkohole. Njegova formula je CH3OH.
Osobine[uredi | uredi izvor]
Metanol je bezbojna tečnost, lakša od vode, ključa na 65 stepeni Celzijusa. Kada je sasvim čist ima miris sličan etanolu, dok sirov metanol, dobijen suhom destilacijom drveta ima neprijatan miris. S vodom, etrom i etanolom se miješa u svakom odnosu. Gori blijedo plavim plamenom.
Dobijanje[uredi | uredi izvor]
Metanol se nekada dobijao suhom destilacijom drveta. Danas se najčešće dobija sintezom vodika (H) i ugljik (II) oksida (CO), pri povišenoj temperaturi i pritisku uz katalizator:
- CO + 2H2 → CH3OH (p=200-300 bar; t=300-400 °C)
Upotreba[uredi | uredi izvor]
Metanol se koristi kao pogonsko gorivo kod automobilskih motora gdje je potrebna velika snaga te visoka izdržljivost protiv detonacije (=neželjeno samozapaljenje goriva kada se klip nalazi u "pogrešnom" položaju). Metanol sadrži 50% oksigena što pospješuje sagorjevanje u motorima sa unutrašnjim sagorjevanjem, ima veći stepen iskorištenja od benzina, ima izrazito visok oktanski broj od RON130 te ima izvrsna rashladna svojstva. Izduvni gasovi su čistiji od benzina i sadrže manje CO2. Mana metanola kao pogonskog goriva je da sadrži duplo manje energije od benzina po jedinici zapremine te je potrebno ubrizgati duplo više metanola da bi sagorijevanje bilo potpuno. Osim toga djeluje korozivno i otrovno pa se etanol radije koristi kao ekološka zamjena metanolu. Radne temperature su im slične, metanol preko +13 oC dok etanol ima preko +11 oC te se oba koriste samo kao "ljetno" gorivo u visokim koncentracijama. Zimi se metanol koristi uz primjese acetona (nekoliko procenata) koji mu povećava opseg radne temperature. Veliku primjenu ima u industriji, zanatstvu i u laboratorijama.
Naročito se mnogo upotrebljava kao rastvarač organskih supstanci: za spravljanje boja i lakova, izradu vještačkih plastičnih masa, fotografskih filmova i dr. Upotrebljava se i za denaturisanje etanola.
Metanol je vrlo jeftin i zato se upotrebljava, iako je ta upotreba zabranjena, za falsificiranje alkoholnih pića. Nefalsifikovana alkoholna pića također sadrže male količine metanola, a u izvjesnim slučajevima te količine mogu biti tolike da dođe do tipičnih trovanja. Ove razne primjene dovode do trovanja, kako profesionalnih tako i uslijed njegove upotrebe u alkoholnim pićima.
Derivati[uredi | uredi izvor]
Derivat metanola, 2-metoksi-2-metil-propan (MTBE = metil-tercbutil-eter), danas vrlo važan sastojak bezolovnog benzina, koji ga sadrži i više od 10%. MTBE povisuje oktanski broj benzina i zamjenjuje škodljivo tetraetil-olovo (Pb(C2H5)2), koje se još od 1921. godine dodaje benzinu, kao antidetonator.
Dobijanje MTBE-a[uredi | uredi izvor]
MTBE se dobija prevođenjem para metanola i 2-metil-propena preko pogodnog katalizatora, pri povišenom pritisku i temperaturi:
- CH3OH + CH2=C(CH3)-CH3 → CH3-O-C(CH3)2-CH3
Reakcije metanola[uredi | uredi izvor]
Metanol se u jetri oksidira u mravlju kiselinu te formaldehid, koji uzrokuje koagulaciju protoplazme:
- CH3OH → CH2=O + H2O
Toksičnost[uredi | uredi izvor]
Vrlo je otrovan. 6-10 g unijetih na usta mogu izazvati teška trovanja, moguće je potpuno osljepljenje poslije upotrebe 8-15g, a zabilježeni su i smrtni slučajevi od svega 15-20g. Procenat smrtnosti kod osoba otrovanih upotrebom metanola je vrlo visok.
| Uporedna toksičnost raznih alkohola | Toksičnost |
|---|---|
| Metanol (Metilalkohol) | 0,8 |
| Etanol (Etilalkohol) | 1,0 |
| Propanol (Propilalkohol) | 2,5 |
| Izopropilalkohol | 2,0 |
| Butanol (Butilalkohol) | 16,5 |
| Izobutilalkohol | 5,5 |
| Amilalkohol | 33,2 |
| Izoamilalkohol | 19,2 |
Odavde vidimo da toksičnost raste sa dužinom lanca te da su alkoholi sa normalnim lancem otrovniji od njihovih izomera sa bočnim lancem. Sa daljim povećanjem lanca rastvorljivost viših alkohola u tečnostima organizma jako opada, pa prema tome i njihova reasorpcija, a s tim i njihova toksičnost, dakle pravilo važi samo u ograničenom obimu. Po tom pravilu metanol mi trebao biti manje otrovan od etanola, ali to je tačno samo kad se ista količina metanola i etanola unose intravenski. Metanol unijet per os, disanjem ili preko kože (profesionalna trovanja) otrovniji je od etanola jer dok se etanol vrlo brzo eliminira iz organizma (najduže za 24h) metanol se vrlo sporo eliminira (5-10 sporije) te djeluje kumulativno. Pored toga proizvodi razlaganja etanola su voda i CO2 dok su kod metanola to formaldehid i mravlja kiselina koji djeluju otrovno. Koncentracija metanola od 10mg na litar vazduha već predstavlja ozbiljnu opasnost po zdravlje.
Simptomi trovanja i liječenje:[uredi | uredi izvor]
Metanol djeluje naročito na optički nerv. Ovo djelovanje dovodi do potpunog sljepila usljed oksidacije metanola u mravlju kiselinu koja razara nervne ćelije.
Simptomi akutnog trovanja su: glavobolja, abdominalni bolovi, gušenje, slabljenje pulsa, pad tjelesne temperature, proširene zjenice. Smrt nastupa usljed paralize centra za disanje. Pošto dolazi do acidoze za liječenje se pored ispiranja želuca mogu davati natrijumbikarbonat i glukoza intravenski.
| Commons ima datoteke na temu: Metanol |

