Transmembranski protein

1) jednostavni transmembransku α-heliks (bitopski membranski protein)
2) politopski transmembranski α-heliksni protein
3) politopni transmembranski protein β-lista
Membrana je predstavljena svijetlo žutom bojom
Transmembranski protein (TP) je tip integralnih membranskih proteina koji se proteže na cijelu ćelijsku membranu. Mnogi transmembranski proteini funkcioniraju kao ulazi koji omogućavaju transport specifičnih supstanci preko membrane. Često prolaze kroz značajne konformacijske promjene kako bi tvar premjestile kroz membranu. Obično su vrlo hidrofobni i agregiraju se i talože u vodi. Za ekstrakciju im je potreban deterdžent ili nepolarni rastvarači, iakio se neki od njih (beta-bačva) mogu također ekstrahirati pomoću sredstva za denaturaciju.
Peptidna sekvenca koja se proteže kroz membranu ili transmembranski segment, u velikoj mjeri je hidrofobna i može se vizualizirati pomoću hidropatskog plota.[1] Ovisno o broju transmembranskih segmenata, ovi proteini se mogu klasificirati kao jednostruki (ili bitopski) ili višestruko rasponski (politopski). Neki drugi integralni membranski proteini nazivaju se monotopni, što znači da su i oni trajno vezani za membranu, ali ne prolaze kroz nju.[2]
Tipovi[uredi | uredi izvor]
Klasifikacija po strukturi[uredi | uredi izvor]
Postoje dvs osnovna tipa transmembranskih proteina:[3] alfa-heliksna beta-bure. Alfa-heliksni proteini prisutni su u unutrašnjim membranama bakterijskih ćelija ili plazemskoj membrani eukariota, a ponekad i u vanjskim membranama. U vanjskim membranama uključuju stannin i određene lipoproteina, i druge. Ovo je glavna kategorija transmembranskih proteina. Procjenjuje se da su kod ljudi 27% svih proteina alfa-heliksni membranski proteini.[4] Protein zvani beta-bure se zasad nalaze samo u vanjskim membranama Gram-negativnih bakterija, ćelijskog zida Gram-pozitivnih bakterija, vanjske membrane mitohondrija i hloroplasta, ili se mogu lučiti kao toksin koji stvara pore. Svi beta-bačvasti transmembranski proteini imaju najjednostavniju topologiju gore-dolje, koja može odražavati njihovo zajedničko evolucijsko porijeklo i sličan mehanizam presavijanja. Pored domena proteina, postoje neobični transmembranski elementi koje tvore peptidi. Tipski primjer je gramicidin A, peptid koji tvori dimerni transmembranski β-heliks.[5] Ovaj peptid izlučuju Gram-pozitivne bakterije kao antibiotik. Transmembranski poliprolin-II heliks nije zabilježen u prirodnim proteinima. Ipak, ova je struktura eksperimentalno uočena u posebno dizajniranim vještačkim peptidima.[6]
Klasifikacija po topologiji[uredi | uredi izvor]
Ova klasifikacija se odnosi na položaj proteinskih N- i C-krajeva na različitim stranama lipidnog dvosloja. Tipovi I, II, III i IV su jednostuko prolazne molekule. Transmembranski proteini tipa I usidreni su na lipidnu membranu sidrenim stop-stop prenosom i imaju svoje N-krajnje domene ciljane na lumen endoplazmatskog retikuluma (ER) tokom sinteze (i vanćelijski prostor, ako se zreli oblici nalaze na ćelijskim membranama). Tipovi II i III usidreni su signalno-sidrenom sekvencom, pri čemu je tip II ciljano na ER lumenu sa svojim C-krajnim domenom, dok tip III imaju domene N-kraja ciljane na ER lumen. Tip IV podijeljen je na IV-A, s njihovim N-krajskim domenima usmjerenim na citosol i IV-B, s N-terminalnim domenom usmjerenim na lumen.[7] Implikacije na podjelu na četiri tipa posebno su očigledne u vrijeme translokacije i ER-vezane translacije, kada protein mora proći kroz ER membranu u smjeru koji ovisi o tipu.
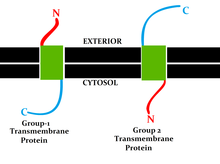
Proteini grupe II imaju C-kraj na udaljenoj strani i N-kraj u citosolu. Br>Međutim, konačna topologija nije jedini kriterij za definiranje transmembranskih proteinskih skupina, već se u klasifikaciji uzima u obzir lokacija topogenih odrednica i mehanizam grupiranja.[8]
Trodimenzjska struktura[uredi | uredi izvor]

Membranskoproteinske strukture mogu se odrediti pomoću rendgenske kristalografije, elektronske mikroskopije ili NMR spektroskopije.[9] Najčešće tercijarne strukture ovih proteina su transmembranski snop-heliksi i beta- bure. Dio membranskih proteina koji su vezani za lipidni dvosloj (vidi prstenasta lipidna ovojnica) sastoji se uglavnom od hidrofobnih [[aminokiselina.[10]
Membranski proteini koji imaju hidrofobne površine relativno su fleksibilni i izražavaju se na relativno niskim nivoima. To stvara poteškoće u dobivanju dovoljno proteina, a zatim u stvaranju kristala. Stoga je, uprkos značajnoj funkcionalnoj važnosti membranskih proteina, određivanje struktura atomske rezolucije za te proteine teže od globularnih proteina.[11] Od januara 2013. Godine, manje od 0,1% utvrđenih proteinskih struktura bili su membranski proteini, iako su činili 20–30% ukupnog proteoma.[12] Zbog ove poteškoće i važnosti ove klase proteina, metodi predviđanja strukture proteina zasnovani na grafikonima hidropatije, razvijeni su pozitivna unutrašnja pravila i drugi metodi.[13][14][15]
Termodinamička stabilnost i savijanje[uredi | uredi izvor]
Stabilnost α-heliksnih transmembranskih proteina[uredi | uredi izvor]
Transmembranski α-heliksni proteini neobično su stabilni sudeći prema studijama toplotne denaturacije, jer se ne odvijaju u potpunosti unutar membrana (za potpuno razvijanje potrebno bi razbiti previše α –heliksnih H-veza u nepolarnim medijima). S druge strane, ovi proteini lahko 'pogrešno zbunjuju', zbog nenativne agregacije u membranama, prelaska u rastvorena globulska stanja, stvaranja nenativnih disulfidnih veza ili odvijanja perifernih regija i neregularnih petlji koje su lokalno manje stabilne.
Također je važno pravilno definirati rasavijeno stanje memranskih proteina. U deterdžentskim micelama razlikuje se od onog u termičkim denaturacijskim) eksperimentima. Ovo stanje predstavlja kombinaciju presavijenih hidrofobnih α-heliksa i djelimično savijenih segmenata pokrivenih deterdžentom. Naprimjer, "savijeni" bakteriorodopsin, u micelma SDS ima četiri savijena transmembranska α-heliksa, dok je ostatak proteina smješten na granici micele-voda i može imati različite tipove nenativnih amfifilnih struktura. Razlike u slobodnoj energiji između takvih denaturisanih deterdženata i izvornih stanja slične su stabilnosti proteinskih topivih u vodi (<10 kcal / mol).
Savijanje α-heliksnih transmembranskih proteina[uredi | uredi izvor]
Preoblikovanje α-heliksnih transmembranskih proteina in vitro tehnički je teško. Primjera uspješnih eksperimenata ponovnog savijanja, kao što je bakteriorodopsin, ima relativno malo. In vivo, svi takvi proteini se normalno savijaju kotranslaciono unutar velike translokonske transmembrane. Translokonski kanal pruža visoko heterogeno okruženje za novonastale transmembranske α-helikse. Relativno polarni amfifilni α-helčiks može zauzeti transmembransku orijentaciju u translokonsku (iako bi bila na površini membrane ili bi se odvijala „in vitro“), jer njeni polarni ostaci mogu biti okrenuti prema središnjem kanalu ispunjenom vodom translokona. Takav mehanizam je neophodan za ugradnju polarnih α-heliksa u strukture transmembranskih proteina. Amfifilni heliksi ostaju vezani za translokon dok se protein potpuno ne sintetizira i ne presavije. Ako protein ostane predugo otvoren i vezan za translokon, razgrađuje se specifičnim ćelijskim sistemima "kontrole kvaliteta".
Stabilnost i savijanje β-bačve transmembranskih proteina[uredi | uredi izvor]
Stabilnost β-bačve transmembranskih proteina slična je stabilnosti proteina topivih u vodi, na osnovu studija hemijske denaturacije. Neki od njih su vrlo stabilni čak i u haotropnim agensima i na visokim temperaturama. Njihovo savijanje in vivo olakšavaju šaperoni rastvorljivi u vodi, kao što je protein Skp. Smatra se da proteini membranske β-bačve potiču od jednog pretka, čak i ako imaju različit broj listova koji se mogu dodati ili udvostručiti tokom evolucije. Neke studije pokazuju ogromnu očuvanost sekvenci među različitim organizmima, kao i konzervirane aminokiseline koje imaju strukturu i pomažu u presavijanju.[16]
3D strukture[uredi | uredi izvor]
Transporteri vođeni apsorpcijom svjetlosti[uredi | uredi izvor]
- Bakteriorodopsinoliki proteini, uključujući rodopsin (vidi također opsin);
- Bakterijski fotosintetski reakcijski centar i fotosistemi I i II;
- Kompleks za skupljanje svjetlosti iz bakterija i hloroplasta
Transporteri na oksidoredukciju[uredi | uredi izvor]
- Transmembranski proteini slični citohomu b: koenzim Q - citohrom c reduktaza (citohrom bc1); kompleks citokroma b6f; formiat dehidrogenaza, respiratorna nitrat reduktaza; sukcinat - koenzim Q reduktaza (fumarat-reduktaza) i sukcinat-dehidrogenaza. Pogledajte lanac transporta elektrona;
- Citohrom c oksidaza iz bakterija i mitohondrija.
Elektrohemijski transporteri na potencijalni pogon[uredi | uredi izvor]
- Proton ili natrij translociraju F-tip i V-tip ATPaza
Transporteri na pogon hidrolize P-P veze[uredi | uredi izvor]
- P-tip kalcij-ATPaza (pet različitih konformacija);
- Kalcijevii regulatori ATPaze fosfolamban i sarkolipin;
- ABC-transporteri;
- Općenito sekretorni put (Sec) translokon (preprotein translocira SecY).
Nosači (ulagači, simporteri, antiporteri)[uredi | uredi izvor]
- Mitohondijski proteinski nosači;
- Superfamilija glavnih olakšivača (transporter glicerol-3-fosfata, laktozna permeaza i transporter EmrD za više lijekova;
- Rezistencija-nodulacija-ćelijskih dioba (efluksni transporter AcrB, vidi multirezistentnost;
- Dikarboksilat / aminokiselina: kationski simporter (simulator protonskog glutamata);
- Monovalentni kation/protonski antiporter (natrij/ protonski antiporter 1 NhaA);
- Neurotransmiterski natrij-simporter;
- Transporteri amonijaka;
- Transporter lijekova/metabolita (mali transporter za otpornost na više lijekova EmrE - strukture su uvučene kao pogrešne)
Alfa-heliksnii kanali uključujući ionske kanale[uredi | uredi izvor]

- Slični naponski usmjerenim ionskim kanalima, uključujući kalijske panale KcsA i KvAP i usmjerač kalij-ionskog kanala prema unutra Kirbac
- Mehanosesenzitivni kanal velike provodljivosti, MscL;
- Mehanosenzitivni ionski kanal male provodljivosti (MscS);
- Transporteri metalnih iona CorA;
- Ligandni ionski kanal neurotransmiterskih receptora (acetilholinski receptor);
- Akvaporini;
- Hloridni kanali:
- Pomoćni proteini vanjske membrane (transporter polisaharida) – α-heliksni transmembranski proteini iz vanjske bakterijske membrane.
Enzimi[uredi | uredi izvor]
- Metan-monooksigenaza;
- Romboidna proteaza;
- Protein formiranja disulfidnih veza (DsbA-DsbB kompleks).
Proteini s alfa-heliksnim transmembranskim sidrima[uredi | uredi izvor]
- Receptor T-ćelija transmembranski domen dimerizacije;
- Citohrom c, kompleks nitrit-reduktaza
- Steril-sulfat sulfohidrolaze;
- Stannin;
- Glikoforinski dimer;
- Inovirusn (nitasti fag), glavni protein ovojnice;
- Pilin;
- Plućni surfaktant – pridruženi protein;
- Monoamin-oksidaza s A i B;
- Amid-hidrolaze masnih kiselina.[17]
- Citohrome P450-oksiidaza;
- Korticosteroid 11β-dehidrogenaze;
- Signalna peptid-peptidaza;
- Membranska proteaza specifična za homolog stomatina.
β-bačve od jednog polipeptidnog lanca[uredi | uredi izvor]
- Beta bačve iz osam beta-lanaca i sa "posmičnim brojem" od deset (n = 8, S = 10 ). Sadrže:
- Domen autotransportera ( n = 12, S = 14 )
- Porodica proteina vanjske membrane FadL, uključujući transporter FadL masne kiseline ( n = 14, S = 14 )
- Opća porodica bakterijskih porina, poznata kao trimerna porinska ( n = 16, S = 20 )
- Maltoporin, ili šećerni porini ( n = 18, S = 22 )
- Nukleozidni porin ( n = 12, S = 16 )
- Fosfolipaza vanjske membrane A1 ( n = 12, S = 16 )
- TonB-zavisni receptori i njihovi plug domen. Oni su spojeni membranski kanali s ligandom ( n = 22, S = 24 ), uključujući kobalamin transporter BtuB, Fe (III) -piohelin receptor FptA, receptor FepA, receptor za unos gvožđevog hidroksamata FhuA, transporter FecA i receptor za pjoverdin FpvA;
- Vanjski membranski protein OpcA ( n = 10, S = 12 ) koji uključuje proteazu OmpT vanjske membrane i adhezin / invazinski protein OpcA
- Protein vanjske membrane G porodica porina ( n = 14, S = 16 )
Napomena: n i S su broj beta-lanaca i "broj rezanja"[18] bwta-bačvi.
β-bačve od nekoliko polipeptidnih lanaca[uredi | uredi izvor]
- Trimerni autotransporter ( n = 12, S = 12 )
- Izlazni proteini vanjske membrane, poznati i kao trimerni faktori vanjske membrane (n = 12, S = 18), uključujući TolC i proteine otpornosti na više lijekova
- MspA porin (oktamer, n = S = 16 ) i α-hemolizin (heptamer n = S = 14 ). Ovi se proteini izlučuju.
Također pogledajte[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ Manor, Joshua; Feldblum, Esther S.; Arkin, Isaiah T. (2012). "Environment Polarity in Proteins Mapped Noninvasively by FTIR Spectroscopy". The Journal of Physical Chemistry Letters. 3 (7): 939–944. doi:10.1021/jz300150v. PMC 3341589. PMID 22563521.
- ^ Steven R. Goodman (2008). Medical cell biology. Academic Press. str. 37–. ISBN 978-0-12-370458-0. Pristupljeno 24. 11. 2010.
- ^ Jin Xiong (2006). Essential bioinformatics. Cambridge University Press. str. 208–. ISBN 978-0-521-84098-9. Pristupljeno 13. 11. 2010.
- ^ Almén MS, Nordström KJ, Fredriksson R, Schiöth HB (2009). "Mapping the human membrane proteome: a majority of the human membrane proteins can be classified according to function and evolutionary origin". BMC Biol. 7: 50. doi:10.1186/1741-7007-7-50. PMC 2739160. PMID 19678920.
- ^ Nicholson, L. K.; Cross, T. A. (1989). "Gramicidin cation channel: an experimental determination of the right-handed helix sense and verification of .beta.-type hydrogen bonding". Biochemistry (jezik: engleski). 28 (24): 9379–9385. doi:10.1021/bi00450a019. PMID 2482072.
- ^ Kubyshkin, Vladimir; Grage, Stephan L.; Ulrich, Anne S.; Budisa, Nediljko (2019). "Bilayer thickness determines the alignment of model polyproline helices in lipid membranes". Physical Chemistry Chemical Physics (jezik: engleski). 21 (40): 22396–22408. Bibcode:2019PCCP...2122396K. doi:10.1039/c9cp02996f. PMID 31577299.
- ^ Harvey Lodish etc.; Molecular Cell Biology, Sixth edition, p.546
- ^ Goder, Veit; Spiess, Martin (31. 8. 2001). "Topogenesis of membrane proteins: determinants and dynamics". FEBS Letters. 504 (3): 87–93. doi:10.1016/S0014-5793(01)02712-0. PMID 11532438.
- ^ Cross, Timothy A.; Sharma, Mukesh; Yi, Myunggi; Zhou, Huan-Xiang (2011). "Influence of Solubilizing Environments on Membrane Protein Structures". Trends in Biochemical Sciences. 36 (2): 117–125. doi:10.1016/j.tibs.2010.07.005. PMC 3161620. PMID 20724162.
- ^ White, Stephen. "General Principle of Membrane Protein Folding and Stability". Stephen White Laboratory Homepage. 10 Nov. 2009. web.
- ^ Carpenter, Elisabeth P; Beis, Konstantinos; Cameron, Alexander D; Iwata, So (oktobar 2008). "Overcoming the challenges of membrane protein crystallography". Current Opinion in Structural Biology. 18 (5): 581–586. doi:10.1016/j.sbi.2008.07.001. PMC 2580798. PMID 18674618.
- ^ "Membrane Proteins of known 3D Structure". Arhivirano s originala, 25. 12. 2013. Pristupljeno 20. 1. 2021.
- ^ Elofsson, Arne; Heijne, Gunnar von (7. 6. 2007). "Membrane Protein Structure: Prediction versus Reality". Annual Review of Biochemistry. 76 (1): 125–140. CiteSeerX 10.1.1.332.4023. doi:10.1146/annurev.biochem.76.052705.163539. PMID 17579561.
- ^ Chen, Chien Peter; Rost, Burkhard (2002). "State-of-the-art in membrane protein prediction". Applied Bioinformatics. 1 (1): 21–35. CiteSeerX 10.1.1.134.7424. PMID 15130854.
- ^ Hopf, Thomas A.; Colwell, Lucy J.; Sheridan, Robert; Rost, Burkhard; Sander, Chris; Marks, Debora S. (juni 2012). "Three-Dimensional Structures of Membrane Proteins from Genomic Sequencing". Cell. 149 (7): 1607–1621. doi:10.1016/j.cell.2012.04.012. PMC 3641781. PMID 22579045.
- ^ Michalik, Marcin; Orwick-Rydmark, Marcella; Habeck, Michael; Alva, Vikram; Arnold, Thomas; Linke, Dirk; Permyakov, Eugene A. (3. 8. 2017). "An evolutionarily conserved glycine-tyrosine motif forms a folding core in outer membrane proteins". PLOS ONE. 12 (8): e0182016. Bibcode:2017PLoSO..1282016M. doi:10.1371/journal.pone.0182016. PMC 5542473. PMID 28771529.
- ^ Bracey MH, Hanson MA, Masuda KR, Stevens RC, Cravatt BF (novembar 2002). "Structural adaptations in a membrane enzyme that terminates endocannabinoid signaling". Science. 298 (5599): 1793–6. Bibcode:2002Sci...298.1793B. doi:10.1126/science.1076535. PMID 12459591.
- ^ Murzin AG, Lesk AM, Chothia C (mart 1994). "Principles determining the structure of beta-sheet barrels in proteins. I. A theoretical analysis". J. Mol. Biol. 236 (5): 1369–81. doi:10.1016/0022-2836(94)90064-7. PMID 8126726.
