Laminin

Laminini su proteini vanćelijskog matriksa, visoke molekulske težine (~400 do ~900 kDa). Glavna su komponenta bazne lamine (jedan od slojeva bazne membrane), temelj proteinske mreže za većinu ćelija i organa. Laminini su važan i biološki aktivan dio bazne lamine, koji utiču na diferencijaciju, migraciju i adheziju ćelija.[1][2]
Laminini su heterotrimerni proteini koji sadrže α-lanac, β-lanac i γ-lanac, koji se nalaze u pet, četiri, odnosno tri genetičke varijante. Molekule laminina imenovane su prema sastavu njihovog lanca. Dakle, laminin-511 sadrži α5, β1 i γ1 lance.[3] Identificirano je 14 drugih kombinacija lanaca in vivo. Trimerni proteini ukrštaju se i formiraju ukrštenu strukturu koja se može vezati za druge ćelijske membrane i molekule vanćelijskog matriksa.[4] Tri kraća kraka su posebno dobra u vezivanju za druge molekule laminina, što im omogućava da formiraju listove. Dugi krak sposoban je da se veže za ćelije, što pomaže da se organizovane ćelije tkiva pričvrste za membranu.
Porodica lamininskih glikoproteina je sastavni dio strukturne skele u gotovo svakom tkivu organizma. Oni se luče i ugrađuju u ćelijske [ [vanćelijski matriks| vanćelijske matrikse]]. Laminin je od vitalnog značaja za održavanje i opstanak tkiva. Defektni laminini mogu uzrokovati nepravilno formiranje mišića, što dovodi do oblika mišićne distrofije, smrtonosne bolesti sa kožnim prištevima (spojna epidermolysis bullosa ) i defekta bubrežnog filtera (nefrotski sindrom).[5]
Tipovi
[uredi | uredi izvor]Identificirano je 15 trimera laminina. Laminini su kombinacije različitih alfa-, beta- i gama lanaca.[6]
- Pet oblika alfa lanaca su: LAMA1, LAMA2, LAMA3 (koji ima tri varijante transkripta), LAMA4, LAMA5
- Beta lanci uključuju: LAMB1, LAMB2, LAMB3, LAMB4 (nijedan poznati trimer laminina ne sadrži LAMB4 i njihova funkcija je i dalje slabo shvaćena)
- Gama-lanci su: LAMC1, LAMC2, LAMC3
Laminini su prethodno numerisani kako su otkriveni, tj. laminin-1, laminin-2, laminin-3, itd., ali je nomenklatura promenjena kako bi se opisalo koji su lanci prisutni u svakoj izoformi (laminin-111, laminin-211, itd. ).[3] Osim toga, mnogi laminini su imali uobičajena imena prije nego što je bilo koja nomenklatura laminina bila na snazi.[7][8]
| Stara nomenklatura | Stari sinonimi | Sastav lanca | Nova nomenklatura |
|---|---|---|---|
| Laminin-1 | EHS laminin | α1β1γ1 | Laminin-111 |
| Laminin-2 | Merosin | α2β1γ1 | Laminin-211 |
| Laminin-3 | S-laminin | α1β2γ1 | Laminin-121 |
| Laminin-4 | S-merozin | α2β2γ1 | Laminin-221 |
| Laminin-5 / Laminin-5A | Kalinin, epiligrin, nicein, ladsin | α3Aβ3γ2 | Laminin-332 / Laminin-3A32 |
| Laminin-5B | α3Bβ3γ2 | Laminin-3B32 | |
| Laminin-6 / Laminin-6A | K-laminin | α3Aβ1γ1 | Laminin-311 / Laminin-3A11 |
| Laminin-7 / Laminin-7A | KS-laminin | α3Aβ2γ1 | Laminin-321 / Laminin-3A21 |
| Laminin-8 | α4β1γ1 | Laminin-411 | |
| Laminin-9 | α4β2γ1 | Laminin-421 | |
| Laminin-10 | Drosophila-liki laminin | α5β1γ1 | Laminin-511 |
| Laminin-11 | α5β2γ1 | Laminin-521 | |
| Laminin-12 | α2β1γ3 | Laminin-213 | |
| Laminin-14 | α4β2γ3 | Laminin-423 | |
| α5β2γ2 | Laminin-522 | ||
| Laminin-15 | α5β2γ3 | Laminin-523 |
Funkcija
[uredi | uredi izvor]Laminini formiraju nezavisne mreže i povezani su sa tip IV kolagena mrežama preko entaktina,[9] fibronektina,[10] i perlekana. Također se vezuju za ćelijske membrane preko integrinskog receptora i drugih plazmamembranskih molekula, kao što su distroglikanski kompleks glikoproteina i glikoprotein Lutheran krvne grupe.[4] Kroz ove interakcije, laminini kritično doprinose vezivanju i diferencijaciji ćelija, obliku i kretanju ćelije, održavanju tkivnog fenotipa i podsticanju preživljavanja tkiva.[4][6] Some of these biological functions of laminin have been associated with specific amino-acid sequences or fragments of laminin.[4] Na primjer, peptidna sekvenca [GTFALRGDNGDNGQ], koja se nalazi na alfa lancu laminina, promovira adheziju endotelnih ćelija.[11]
Laminin alpha4 je raspoređen u različitim tkivima uključujući periferne živce, gaglije dortzalnog korijena, skeletne mišiće i kapilare; u nervmomuskularnom spoju, potreban je za sinapsnu specijalizaciju.[12] Predviđeno je da struktura domena laminin-G liči na pentraksin.[13]
Patologija
[uredi | uredi izvor]Disfunkcionalna struktura jednog određenog laminina, laminina-211, uzrok je jednog oblika kongenitalne mišićne distrofije.[14] Laminin-211 sastoji se od α2, β1 i γ1 lanaca. Ova distribucija laminina uključuje mozak i mišićna vlakna. U mišićima se vezuje za alfa distroglikan i integrin alfa7—beta1, preko G-domena, a preko drugog kraja se vezuje za vanćelijski matriks.
Abnormalni laminin-332, koji je neophodan za adheziju epitelnih ćelija na baznu membranu, dovodi do stanja zvanog spojna epidermolysis bullosa, karakteriziranog generaliziranim mjehurićima (prištevima), bujnim granulacijskim tkivom kože i sluznica i izdubljenim zubima.
Neispravan laminin-521 u filteru bubrega uzrokuje curenje proteina u mokraću i nefrotski sindrom.[5]
Lamininski domeni
[uredi | uredi izvor]| Lamininski domen I | |
|---|---|
| Identifikatori | |
| Simbol | Laminin I |
| Lamininski domen II | |
|---|---|
| Identifikatori | |
| Simbol | Laminin II |
| Laminin B (Domen IV) | |
|---|---|
| Identifikatori | |
| Simbol | Laminin B |
| EGF-liki laminin (Domeni III i V) | |
|---|---|
 Kristalna struktura tri uzastopna modula epidermnog faktora rasta (le) tipa laminina gama1 koji sadrži mjesto vezivanja nidogena | |
| Identifikatori | |
| Simbol | Laminin-EGF |
| Lamininski G-domen | |
|---|---|
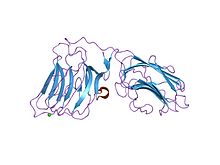 Lanac lg4-5 domenskog para laminin alfa 2, lokusni mutant ca1 | |
| Identifikatori | |
| Simbol | Laminin G-1 |
| Lamininski G-domen | |
|---|---|
 Struktura domena koji veže ligand neureksina 1beta: regulacija funkcije lns domena alternativnom prrfadom | |
| Identifikatori | |
| Simbol | Laminin G-2 |
| Lamininski N-terminal (Domen VI) | |
|---|---|
| Identifikatori | |
| Simbol | Laminin-N |
Laminini sadrže nekoliko konzerviranih proteinskih domena.
Laminin I i laminin II
[uredi | uredi izvor]Laminini su trimerne molekule: laminin-1 je alfa1 beta1 gama1 trimer. Predloženo je da se domeni I i II iz laminina A, B1 i B2 mogu spojiti i formirati trostruku spiralu struktura upredcene zavojnice.[15]
Laminin B
[uredi | uredi izvor]Lamininski B domen (također poznat kao domen IV) je vanćelijski modul nepoznate funkcije. Nalazi se u nizu različitih proteina koji uključuju, heparan-sulfat proteoglikan iz bazne membrane, protein sličan lamininu iz Caenorhabditis elegans i laminin. Lamininski domen IV se ne nalazi u kratkim lancima laminina (alfa4 ili beta3).
EGF-liki laminin
[uredi | uredi izvor]Pored različitih tipova domena globulastih proteina svaka lamininska podjedinica sadrži, u svojoj prvoj polovini, uzastopne ponavljanja, dužine oko 60 aminokiselina koje uključuju osam konzerviranih cisteina.[16] Tercijarna struktura ovog domena je po svom N-terminalu daleko sličnija onoj EGF-likog modula.[17][18] Također je poznat kao 'LE' ili 'laminin-tip EGF' domen. Broj kopija domena nalik lamininu EGF-u u različitim oblicima laminina je veoma varijabilan; pronađeno je od tri do 22 primjerka. U lancu laminina gama-1 vrste Mus musculus, sedmi LE domen se pokazao kao jedini koji veže ima visok afinitet za nidogen.[19] The binding-sites are located on the surface within the loops C1-C3 and C5-C6.[17][18]
Laminin G
[uredi | uredi izvor]Lamininski globulasti (G) domen, također poznat kao LNS (laminin-alfa, neureksin i globulin koji vezuje spolne hormone) domen, u prosjeku dug je 177 aminokiselina i može se naći u jednoj do šest kopija u raznim članovima porodice laminina, kao i u velikom broju drugih vanćelijskih proteinaa.[20] Naprimjer, svi alfa lanci laminina imaju po pet lamininskih G-domena, svi proteini porodice kolagena imaju po jedan lamininski G-domen, CNTNAP proteini imaju po četiri lamininska G-domena, dok neureksin 1 i 2 imaju po šest lamininskih G-domena. U prosjeku, otprilike jednu četvrtinu proteina koji sadrže lamininske G-domene čine samo ovi lamininski G-domeni. Najmanji lamininski G-domen može se naći u jednom od proteina kolagena (COL24A1; 77 AA), a najveći u TSPEAR (219 AA).
Tačna funkcija amininskog G [proteinski [domen|domena]] ostala je neuhvatljiva, a različite funkcije vezivanja pripisane su različitim modulima laminina G. Naprimjer, lanci laminina alfa1 i alfa2 imaju po pet C-terminalnih lamininskih G-domena, gdje samo domeni LG4 i LG5 sadrže mjesto vezanja za heparin, sulfatide i receptor ćelijske površine distroglikan.[21] Čini se da protein koji sadrži laminin-G ima široku paletu uloga u ćelijskoj adheziji, signalizaciji, migraciji, sastavljanju i diferencijaciji.
Laminin N-terminal
[uredi | uredi izvor]Sastavljanje bazne mebrane je kooperativni proces u kojem laminini polimeriziraju kroz svoj N-terminalni domen (LN ili domen VI) i pričvršćuju se na ćelijsku površinu preko svojih G-domena . Netrini se također mogu povezati sa ovom mrežom putem heterotipskih interakcija LN domena. Ovo dovodi do ćelijske signalizacije preko integrina i distroglikana (i moguće drugih receptora) koji se regrutuju u adherentni laminin. Smatra se da je ovo samosastavljanje ovisno o LN domenu ključno za integritet baznih membrana, što je naglašeno u nasljednim oblicima mišićnih distrofija koje sadrže deleciju LN modula iz alfa 2 lamininskog lanac.[22] N-terminalni domen laminina nalazi se u svim lamininskim i netrinski podjedinicama osim laminina alfa 3A, alfa 4 i gama 2.
Ljudski proteini koji sadrže lamininske domene
[uredi | uredi izvor]Lamininski domen I
[uredi | uredi izvor]LAMA1; LAMA2; LAMA3; LAMA4; LAMA5;
Lamininski domen II
[uredi | uredi izvor]LAMA1; LAMA2; LAMA3; LAMA4; LAMA5;
Laminin B (domen IV)
[uredi | uredi izvor]HSPG2; LAMA1; LAMA2; LAMA3; LAMA5; LAMC1; LAMC2; LAMC3;
EGF-liki laminin (domeni III i V)
[uredi | uredi izvor]AGRIN; ATRN; ATRNL1; CELSR1; CELSR2; CELSR3; CRELD1; HSPG2; LAMA1; LAMA2; LAMA3; LAMA4; LAMA5; LAMB1; LAMB2; LAMB3; LAMB4; LAMC1; LAMC2; LAMC3; MEGF10; MEGF12; MEGF6; MEGF8; MEGF9; NSR1; NTN1; NTN2L; NTN4; NTNG1; NTNG2; RESDA1; SCARF1; SCARF2; SREC; STAB1; USH2A;
Lamininski G domenn
[uredi | uredi izvor]AGRIN; CELSR1; CELSR2; CELSR3; CNTNAP1; CNTNAP2; CNTNAP3; CNTNAP3B; CNTNAP4; CNTNAP5; COL11A1; COL11A2; COL12A1; COL14A1; COL15A1; COL16A1; COL18A1; COL19A1; COL20A1; COL21A1; COL22A1; COL24A1; COL27A1; COL5A1; COL5A3; COL9A1; CRB1; CRB2; CSPG4; EGFLAM; EYS; FAT; FAT2; FAT3; FAT4; GAS6; HSPG2; LAMA1; LAMA2; LAMA3; LAMA4; LAMA5; NELL1; NELL2; NRXN1; NRXN2; NRXN3; PROS1; SLIT1; SLIT2; SLIT3; SPEAR; THBS1; THBS2; THBS3; THBS4; USH2A;
Lamininski N-terminal (dmen VI)
[uredi | uredi izvor]LAMA1; LAMA2; LAMA3; LAMA5; LAMB1; LAMB2; LAMB3; LAMB4; LAMC1; LAMC3; NTN1; NTN2L; NTN4; NTNG1; NTNG2; USH2A;
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ Timpl R, Rohde H, Robey PG, Rennard SI, Foidart JM, Martin GR (October 1979). "Laminin--a glycoprotein from basement membranes". The Journal of Biological Chemistry. 254 (19): 9933–7. doi:10.1016/S0021-9258(19)83607-4. PMID 114518.
- ^ DOI 10.1007/s00441-009-0838-2
- ^ a b Aumailley M, Bruckner-Tuderman L, Carter WG, Deutzmann R, Edgar D, Ekblom P, Engel J, Engvall E, Hohenester E, Jones JC, Kleinman HK, Marinkovich MP, Martin GR, Mayer U, Meneguzzi G, Miner JH, Miyazaki K, Patarroyo M, Paulsson M, Quaranta V, Sanes JR, Sasaki T, Sekiguchi K, Sorokin LM, Talts JF, Tryggvason K, Uitto J, Virtanen I, von der Mark K, Wewer UM, Yamada Y, Yurchenco PD (August 2005). "A simplified laminin nomenclature". Matrix Biology. 24 (5): 326–32. doi:10.1016/j.matbio.2005.05.006. PMID 15979864.
- ^ a b c d M. A. Haralson; John R. Hassell (1995). Extracellular matrix: a practical approach. Ithaca, N.Y: IRL Press. ISBN 978-0-19-963220-6.
- ^ a b Yurchenco PD, Patton BL (2009). "Developmental and pathogenic mechanisms of basement membrane assembly". Current Pharmaceutical Design. 15 (12): 1277–94. doi:10.2174/138161209787846766. PMC 2978668. PMID 19355968.
- ^ a b Colognato H, Yurchenco PD (June 2000). "Form and function: the laminin family of heterotrimers". Developmental Dynamics. 218 (2): 213–34. doi:10.1002/(SICI)1097-0177(200006)218:2<213::AID-DVDY1>3.0.CO;2-R. PMID 10842354.
- ^ Royce, Peter M., ured. (2002). Connective tissue and its heritable disorders: molecular, genetic, and medical aspects (2nd izd.). New York: Wiley-Liss. str. 306. ISBN 9780471251859.
- ^ Kühn, Klaus (1997). "Extracellular matrix constituents as integrin ligands". u Elbe, Johannes A. (ured.). Integrin-ligand interaction. New York: Chapman & Hall. str. 50. ISBN 9780412138614.
- ^ Smith J, Ockleford CD (January 1994). "Laser scanning confocal examination and comparison of nidogen (entactin) with laminin in term human amniochorion". Placenta. 15 (1): 95–106. doi:10.1016/S0143-4004(05)80240-1. PMID 8208674.
- ^ Ockleford C, Bright N, Hubbard A, D'Lacey C, Smith J, Gardiner L, Sheikh T, Albentosa M, Turtle K (October 1993). "Micro-trabeculae, macro-plaques or mini-basement membranes in human term fetal membranes?". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 342 (1300): 121–36. doi:10.1098/rstb.1993.0142. PMID 7904354.
- ^ Beck et al., 1999.
- ^ Ichikawa N, Kasai S, Suzuki N, Nishi N, Oishi S, Fujii N, Kadoya Y, Hatori K, Mizuno Y, Nomizu M, Arikawa-Hirasawa E (April 2005). "Identification of neurite outgrowth active sites on the laminin alpha4 chain G domain". Biochemistry. 44 (15): 5755–62. doi:10.1021/bi0476228. PMID 15823034.
- ^ Beckmann G, Hanke J, Bork P, Reich JG (February 1998). "Merging extracellular domains: fold prediction for laminin G-like and amino-terminal thrombospondin-like modules based on homology to pentraxins". Journal of Molecular Biology. 275 (5): 725–30. doi:10.1006/jmbi.1997.1510. PMID 9480764.
- ^ Hall TE, Bryson-Richardson RJ, Berger S, Jacoby AS, Cole NJ, Hollway GE, Berger J, Currie PD (April 2007). "The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin alpha2-deficient congenital muscular dystrophy". Proceedings of the National Academy of Sciences of the United States of America. 104 (17): 7092–7. Bibcode:2007PNAS..104.7092H. doi:10.1073/pnas.0700942104. PMC 1855385. PMID 17438294.
- ^ Sasaki M, Kleinman HK, Huber H, Deutzmann R, Yamada Y (November 1988). "Laminin, a multidomain protein. The A chain has a unique globular domain and homology with the basement membrane proteoglycan and the laminin B chains". The Journal of Biological Chemistry. 263 (32): 16536–44. doi:10.1016/S0021-9258(18)37424-6. PMID 3182802.
- ^ Engel J (July 1989). "EGF-like domains in extracellular matrix proteins: localized signals for growth and differentiation?". FEBS Letters. 251 (1–2): 1–7. doi:10.1016/0014-5793(89)81417-6. PMID 2666164. S2CID 36607427.
- ^ a b Stetefeld J, Mayer U, Timpl R, Huber R (April 1996). "Crystal structure of three consecutive laminin-type epidermal growth factor-like (LE) modules of laminin gamma1 chain harboring the nidogen binding site". Journal of Molecular Biology. 257 (3): 644–57. doi:10.1006/jmbi.1996.0191. PMID 8648630.
- ^ a b Baumgartner R, Czisch M, Mayer U, Pöschl E, Huber R, Timpl R, Holak TA (April 1996). "Structure of the nidogen binding LE module of the laminin gamma1 chain in solution". Journal of Molecular Biology. 257 (3): 658–68. doi:10.1006/jmbi.1996.0192. PMID 8648631.
- ^ Mayer U, Pöschl E, Gerecke DR, Wagman DW, Burgeson RE, Timpl R (May 1995). "Low nidogen affinity of laminin-5 can be attributed to two serine residues in EGF-like motif gamma 2III4". FEBS Letters. 365 (2–3): 129–32. doi:10.1016/0014-5793(95)00438-F. PMID 7781764. S2CID 21559588.
- ^ "Laminin G domain". InterPro. European Bioinformatics Institute. Pristupljeno 22 February 2016.
- ^ Tisi D, Talts JF, Timpl R, Hohenester E (April 2000). "Structure of the C-terminal laminin G-like domain pair of the laminin alpha2 chain harbouring binding sites for alpha-dystroglycan and heparin". The EMBO Journal. 19 (7): 1432–40. doi:10.1093/emboj/19.7.1432. PMC 310212. PMID 10747011.
- ^ Xu H, Wu XR, Wewer UM, Engvall E (November 1994). "Murine muscular dystrophy caused by a mutation in the laminin alpha 2 (Lama2) gene". Nature Genetics. 8 (3): 297–302. doi:10.1038/ng1194-297. PMID 7874173. S2CID 21549628.
External links
[uredi | uredi izvor]- The Laminin Protein
- Laminin na US National Library of Medicine Medical Subject Headings (MeSH)
- P19137
- P24043
- O15230
