Metilacija DNK

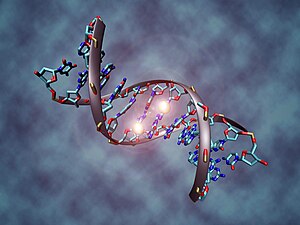
Metilacija DNK je biološki proces kojim se metilna grupa dodaje molekuli DNK. Metilacija može promijeniti aktivnost segmenta DNK bez promjene sekvence. Kada se nalazi u genu promotoru, DNK metilacija tipski djeluje na potiskivanje transkripcije gena. Kod sisara, DNK metilacija je neophodna za normalan razvoj i povezana je sa brojnim ključnim procesima uključujući genomsko utiskivanje, inaktivaciju X-hromosoma, potiskivanje transpozibilnih elementa, starenje i kancerogenezu.
Od 2016. godine pronađene su dvije nukleobaze na kojima se odvija prirodna, enzimska metilacija DNK: adenin i citozin. Modifikovane baze su N6-metiladenin[1], 5-methylcytosine[2] i N4-metilcitozin.[3]
| Nemodificirana baza | 
|
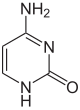
|
||||||
| Adenin, A | Citozin, C | |||||||
| Modificirani oblici | 
|
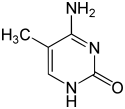
|
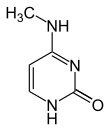
|
|||||
| N6-Metiladenin, 6mA | 5-Metilcitozin, 5mC | N4-Metilcitozin, 4mC | ||||||
Dvije od četiri baze DNK, citozin i adenin, mogu biti metilirane. Metilacija citozina je široko rasprostranjena i kod eukariota i kod prokariota, iako se stopa metilacije DNK citozina može uveliko razlikovati među vrstama: 14% citozina je metilirano u Arabidopsis thaliana, 4% do 8% u Physarum,[4] 7,6% u Mus musculus, 2,3% u Escherichia coli, 0.03% u Drosophila, 0.006% in Dictyostelium[5] i gotovo nijedan (0,0002 do 0,0003%) u Caenorhabditis[6] ili gljivama kao što su Saccharomyces cerevisiae i S. pombe (ali ne i Neurospora crassa).[7][8]:3699 Metilacija adenina uočena je u bakterijskoj, biljnoj i nedavno u sisarskoj DNK,[9][10] ali je dobila znatno manje pažnje.
Metilacija citozina da bi se formirao 5-metilcitozin dešava se na istoj poziciji 5 na pirimidinskom prstenu, gdje se nalazi metil grupa DNK baze timin; isti položaj razlikuje timin od analogne RNK baze uracil, koja nema metilnu grupu. Spontana deaminacija 5-metilcitozina pretvara ga u timin. Ovo rezultira neusklađenošću odnosa T:G. Mehanizmi za popravku zatim ga ispravljaju nazad na originalni par C:G ; alternativno, oni mogu zamijeniti A za G, pretvarajući originalni C:G par u T:A par, efektivno mijenjajući bazu i uvodeći mutaciju. Ova pogrešno inkorporirana baza neće biti ispravljena tokom DNK replikacije jer je timin DNK baza. Ako se neusklađenost ne popravi i ćelija uđe u ćelijski ciklus, lanac koji nosi T će biti dopunjen sa A u jednoj od ćelija kćeri, tako da mutacija postaje trajna. Gotovo univerzalna upotreba timina isključivo u DNK i uracila isključivo u RNK možda je evoluirala kao mehanizam kontrole grešaka, kako bi se olakšalo uklanjanje uracila nastalih spontanom deaminacijom citozina.[11] Smatra se da su metilacija DNK, kao i mnoge od njenih savremenih DNK metiltransferaza, evoluirale iz rane primitivne metilacijske aktivnosti RNK i podržana je s nekoliko linija dokaza.[12]
U biljkama i drugim organizmima, metilacija DNK nalazi se u tri različita konteksta sekvence: CG (ili CpG), CHG ili CHH (gdje H odgovara A, T ili C). Međutim, kod sisara, metilacija DNK se gotovo isključivo nalazi u CpG dinukleotidima, pri čemu su citozini na oba lanca obično metilirani. Međutim, ne-CpG metilacija se može primijetiti u embrionskim matičnim ćelijama,[13][14][15] a također je indicirano u nervnom razvoju.[16] Nadalje, ne-CpG metilacija primijećena je također u hematopoetskim progenitorskim ćelijama, a dešavala se uglavnom u kontekstu CpApC sekvence.[17]
Funkcija konzervirane metilacije DNK[uredi | uredi izvor]

Pejzaž DNK metilacije kičmenjaka je vrlo specifičan u poređenju s drugim organizmima. Kod sisara, oko 75% CpG dinukleotida je metilirano u somatskim ćelijama,[18] a metilacija DNK pojavljuje se kao zadano stanje koje mora biti posebno isključeno iz definiranih lokacija.[15][19] Nasuprot tome, genom većine biljaka, beskičmenjaka, gljiva ili protista pokazuje "mozaične" obrasce metilacije, gdje su ciljani samo specifični genomski elementi, a karakterizira ih izmjena metiliranih i nemetiliranih domena.[20][21]
Visoka CpG metilacija u genomima sisara ima evolucijsku cijenu jer povećava učestalost spontanih mutacija. Gubitak amino grupa javlja se sa velikom učestalošću za citozine, s različitim posljedicama u zavisnosti od njihove metilacije. Metilirani C-ostaci se spontano deaminiraju i formiraju T-ostatke tokom vremena; stoga CpG dinukleotidi postojano deaminiraju u TpG dinukleotide, što je dokazano nedovoljnom zastupljenošću CpG dinukleotida u ljudskom genomu (javljaju se sa samo 21% očekivane učestalosti).[22] (S druge strane, spontana deaminacija nemetiliranih C ostataka dovodi do stvaranja U ostataka, promjene koju ćelija brzo prepoznaje i popravlja.)
CpG otoci[uredi | uredi izvor]
Kod sisara, jedini izuzetak za ovo globalno smanjenje CpG nalazi se u specifičnoj kategoriji sekvenci bogatih GC i CpG koje se nazivaju CpG otoci koji su općenito nemetilirani i stoga su zadržala očekivani sadržaj CpG.[23] CpG otoci se obično definišu kao regioni sa: 1) dužinom većom od 200 bp, 2) sadržajem G+C većim od 50%, 3) odnosom uočenog i očekivanog CpG većim od 0,6, iako se ponekad koriste i druge definicije.[24] Isključujući ponovljene sekvence, u ljudskom genomu, postoji oko 25.000 CpG otoka od kojih je 75% manji od 850bp. Oni su glavne regulatorne jedinice i oko 50% CpG otoka nalaze se u regionima promotorskog gena, dok još 25% leži u genskim tijelima, često služeći kao alternativni promotori. Recipročno, oko 60-70% ljudskih gena ima CpG ostrvo u svom promotorskom regionu.[25][26] Većina CpG otoka je konstitutivno nemetilirana i obogaćena za permisivnu hromatinska modifikaciju kao što je metilacija H3K4. U somatskim tkivima, samo 10% CpG otoka je metilirano, a većina ih je locirana u intergenskim i intragenskim regijama.
Represija CpG-gustih promotora[uredi | uredi izvor]
Metilacija DNK je vjerovatno bila prisutna u određenoj mjeri kod vrlo ranih eukariotskih predaka. U gotovo svakom analiziranom organizmu, metilacija u promotorskim regijama negativno korelira s ekspresijom gena.[20][27] CpG gusti promotori aktivno transkribovanih gena nikada nisu metilirani, ali recipročno, transkripcijski tihi geni ne moraju nužno nositi metilirani promotor. Kod miševa i ljudi, oko 60-70% gena ima CpG otoke u svom promotorskom području i većina ovih CpG otoka ostaje nemetilirana, nezavisno od transkripcione aktivnosti gena, kako u diferenciranim tako i u nediferenciranim tipovima ćelija.[28][29] Treba napomenuti, dok je metilacija DNK CpG ostrva nedvosmisleno povezana sa represijom transkripcije, funkcija metilacije DNK u promotorima siromašnim CG ostaje nejasna; iako postoji malo dokaza da bi mogao biti funkcionalno relevantna.[30]
Metilacija DNK može uticati na transkripciju gena na dva načina. Prvo, sama metilacija DNK može fizički spriječiti vezivanje transkripcijskih proteina za gen,[31] i drugo, i vjerovatno važnije, metilirana DNK može biti vezana proteinima poznatim kao metil-CpG-vezujući domen proteinima (MBD). MBD proteini zatim regrutuju dodatne proteine na lokus, kao što su histon-deacetilaza i drugi proteini remodeliranja hromstina koji mogu modifikovati histon đ, čime se formira kompaktan, neaktivan hromatin, zvani heterohromatin. Ova veza između metilacije DNK i strukture hromatina je vrlo važna. Konkretno, gubitak metil-CpG-vezulućeg proteina 2 (MeCP2) je impliciran u Rettov sindrom; metil-CpG-vezujući domen protein 2 (MBD2) posreduje u utišavanju transkripcije hipermetiliranih gena u "raku".
Represija prenosivih elemenata[uredi | uredi izvor]
DNK metilacija je moćan transkripcijski represor, barem u kontekstu gustog CpG. Čini se da je transkripcijska represija gena koji kodiraju protein u suštini ograničena na vrlo specifične klase gena koji moraju trajno biti tihi iu gotovo svim tkivima. Dok metilacija DNK nema fleksibilnost potrebnu za fino podešavanje genske regulacije, njena stabilnost je savršena da osigura trajno utišavanje transpoziblnih elementa.[32] Kontrola transpozona jedna je od najstarijih funkcija metilacije DNK koju dijele životinje, biljke i višestruki protisti.[33] Čak se sugerira da je metilacija DNK evoluirala upravo u tu svrhu.[34]
Ekspanzija genoma[uredi | uredi izvor]
Poznato je da je metilacija DNK prenosivih elemenata povezana sa ekspanzijom genoma. Međutim, evolucijski pokretač ekspanzije genoma ostaje nepoznat. Postoji jasna pozitivna korelacija između veličine genoma i CpG, što sugerira da je metilacija DNK prijenosnih elemenata dovela do primjetnog povećanja mase DNK.[35]
Metilacija genskog tijela visoko transkribiranih gena[uredi | uredi izvor]
Funkcija koja se čini još konzerviranijom od utišavanja transpozona u pozitivnoj je korelaciji s ekspresijom gena. U gotovo svim vrstama kod kojih je prisutna metilacija DNK, ona je posebno obogaćena u tijelu visoko transkribiranih gena.[20][27] Funkcija metilacije genskog tijela još nije dobro shvaćeno. Brojni dokazi sugeriraju da bi mogla regulisati preradu[36] i suzbijajanje aktivnosti intragenskih transkripcijskih jedinica (kriptičkih promotora ili transpozabilnih elemenata).[37] Metilacija genskog tijela je blisko povezana s metilacijom H3K36. Kod kvasaca i sisara, metilacija H3K36 je visoko obogaćena u tijelu visoko transkribiranih gena. Barem u kvascu, H3K36me3 regrutuje enzime kao što su histon-deacilaze za kondenzaciju hromatina i sprječavanje aktivacije kriptičnih početnih mjesta.[38] Kod sisara, DNMT3a i DNMT3b PWWP domeni vezuju se za H3K36me3 i dva enzima se regrutuju u tijelo aktivno transkribiranih gena.
Detekcija[uredi | uredi izvor]
DNK metilacija može se otkriti pomoću sljedećih testova koji se koriste u naučnim istraživanjima:[39]
- Masena spektrometrija je vrlo osjetljiv i pouzdan analitički metod za otkrivanje metilacije DNK. MS, općenito, međutim, nije informativna o kontekstu sekvence metilacije, pa je stoga ograničeno u proučavanju funkcije ove modifikacije DNK.
- Metilacijski-specifični PCR (MSP), koji se zasniva na hemijskoj reakciji natrij-bisulfita sa DNK koja pretvara nemetilirane citozine CpG dinukleotida u uracil ili UpG, praćeno uobičajenim PCR.[40] Međutim, metilirani citozini neće biti pretvoreni u ovom procesu, a prajmeri su dizajnirani da preklapaju CpG mjesto od interesa, što omogućava da se odredi status metilacije kao metilirani ili nemetilirani.
- Sekvenciranje bisulfita cijelog genoma, također poznato kao BS-Seq, što je visoko propusna analiza metilacije DNK na nivou genoma. Zasnovan je na gore spomenutoj konverziji genomske DNK natrijum bisulfitom, koja se zatim sekvencira na Next-generation sekvencion platforma. Dobijene sekvence se zatim ponovo usklađuju sa referentnim genomom kako bi se odredio status metilacije CpG dinukleotida na osnovu nepodudarnosti koje su rezultat konverzije nemetiliranih citozina u uracil.
- Sekvenciranje bisulfita sa smanjenom zastupljenošću, također poznato i kao RRBS, poznaje nekoliko radnih protokola. Prvi RRBS protokol nazvan je RRBS i ima za cilj oko 10% metiloma, potreban je referentni genom. Kasnije je došlo više protokola koji su mogli sekvencirati manji dio genoma i višestruko multipleksiranje uzoraka. EpiGBS je bio prvi protokol u kojem ste mogli multipleksirati 96 uzoraka u jednoj traci iluminskog sekvenciranja i gdje referentni genom više nije bio potreban. De novo referentna konstrukcija iz čitanja Watsonovog i Crickobvog lanca učinila je da je skrining populacije SNP-a i SMP-a istovremeno činjenica.
- HELP test, koji se zasniva na diferencijalnoj sposobnosti restrikcijskih enzima da prepoznaju i cijepaju metilirana i nemetilirana CpG DNK mjesta.
- GLAD-PCR test, koji se zasniva na novom tipu enzima – metil-usmjerenim DNK endonukleazama specifičnim za lokus, koje hidroliziraju samo metiliranu DNK.
- ChIP-on-chip testovi, koji se zasnivaju na sposobnosti komercijalno pripremljenih antitijela da se vežu za proteine povezane sa metilacijom DNK kao što je MeCP2.
- Restrikcijski orijentir genomskog skeniranja, komplikovan i sada retko korišćen test zasnovan na diferencijalnom prepoznavanju restrikcijskih enzima metiliranih i nemetiliranih CpG mjkesta; test je po konceptu sličan HELP testu.
- Imunoprecipitacija metilirane DNK (MeDIP), analogno imunoprecipitacioji hromatina, imunoprecipitacija koristi se za izolaciju metiliranih fragmenata DNK za unos u metode detekcije DNK kao što su DNK mikronizovi (MeDIP- čip) ili DNK sekvenciranje (MeDIP-seq).
- Pirosekvencija DNK tretirane bisulfitom. Ovo je sekvenciranje amplikona napravljenog od normalnog prednjeg prajmera, ali biotiniliranog reverznog prajmera za PCR gen izbora. Pirosekvencer zatim analizira uzorak denaturacijom DNK i dodavanjem jednog po jednog nukleotida u mješavinu prema sekvenci koju je dao korisnik. Ako postoji nepodudarnost, ona se bilježi i bilježi postotak DNK za koji je nepodudarnost prisutna. Ovo daje korisniku postotak metilacije po CpG otoku.
- Lagani molekularni test za aktivnost DNK adenin metiltransferaze – test koji se oslanja na specifičnost restriktivnog enzima DpnI za potpuno metilirana (metilacija adenina) GATC mjesta u oligonukleotidu označenom fluoroforom i gasiteljem. Adenin-metiltransferaza metilira oligonukleotid čineći ga supstratom za DpnI. Rezanje oligonukleotida pomoću DpnI dovodi do povećanja fluorescencije.[41][42]
- Metil senzitivnu Southern blot sličan je HELP testu, iako koristi Southern bloting tehnike za ispitivanje gen-specifičnih razlika u metilaciji pomoću restrikcijskih digestija. Ova tehnika koristi se za procjenu lokalne metilacije u blizini mjesta vezivanja za sondu.
- MetilCpG-vezujući proteini (MBP) i fuzijski proteini koji sadrže samo metil-vezujući domen (MBD) koriste se za razdvajanje nativne DNK na metilirane i nemetilirane frakcije. Postotak metilacija pojedinačnih CpG ostrva može se odrediti kvantificiranjem količine mete u svakoj frakciji. Izuzetno osjetljiva detekcija se može postići u FFPE tkivima sa detekcijom zasnovanom na pripisivanju.
- Visokorezolutno topljenje: Analiza (HRM ili HRMA), je post-PCR analitička tehnika. Ciljna DNK tretira se natrij-bisulfitom, koji hemijski pretvara nemetilirane citozine u uracile, dok se metilirani citozini čuvaju. PCR amplifikacija se zatim izvodi sa prajmerima dizajniranim da amplificiraju i metilirane i nemetilirane šablone. Nakon ove amplifikacije, visoko metilirane DNK sekvence sadrže veći broj CpG mjesta u odnosu na nemetilirane šablone, što rezultira različitom temperaturom topljenja koja se može koristiti u kvantitativnoj detekciji metilacije.[43][44]
- Rekonstrukcija drevne DNK metilacije, metod za rekonstrukciju metilacije DNK visoke rezolucije iz drevnih uzoraka DNK. Metod se zasniva na prirodnim procesima degradacije koji se dešavaju u drevnoj DNK: s vremenom se metilirani citozini razgrađuju u timine, dok se nemetilirani citozini razgrađuju u uracile. Ova asimetrija u signalima degradacije korišćena je da se rekonstruišu pune mape metilacije neandertalca i denisovskih ljudi.[45] U septembru 2019. i objavljen je novi metod za zaključivanje morfoloških osobina iz podataka o metilaciji DNK. Autori su bili u mogućnosti da pokažu da povezivanje gena naniže reguliranih s fenotipovima monogenskih bolesti, gdje su jedna ili dvije kopije gena poremećene, omogućava ~85% preciznosti u rekonstrukciji anatomskih osobina direktno iz mapa metilacije DNK.[46]
- Test ekstenzije jednonukleotidnog prajmera osetljiv na metilaciju (msSNuPE), koji koristi unutrašnje prajmere koji fokusiraju ravno 5' kraj nukleotida koji se detektuje.[47]
- Test metilacije Ilumina mjeri metilaciju DNK specifičnu za lokus koristeći hibridizaciju sekvence. DNK tretirana bisulfitom hibridizirana je sa sondama na "BeadChips". Produžetak baze sa jednom bazom sa obilježenim sondama koristi se za određivanje statusa metilacije ciljnih mesta.[48] Godine 2016. objavljen je Infinium MethylationEPIC BeadChip, koji ispituje preko 850.000 metilacijskih mjesta u ljudskom genomu.[49]
- Koristeći sekvenciranje nanopora, direktno su identificirane modifikacije baze DNK i RNK pri rezoluciji nukleotida, uključujući 5mC, 5hmC, 6mA i BrdU u DNK i m6A u RNK, uz detekciju drugih prirodnih ili sintetskih epigenetičkih modifikacija mogućih kroz obuku algoritama za pozivanje baze.[50]
Također pogledajte[uredi | uredi izvor]
- 5-Hidroksimetilcitozi
- 5-metilcitozin
- 7-metilgvanozin
- Smanjenje DNK metilacije I (DDM1), biljnog gena za metilaciju
- Sredstvo za demetiliranje
- Diferencijalno metilirane regije
- DNK demetilacija
- Reprogramiranje DNK metilacije
- Epigenetika, čiji je značajan doprinos metilacija DNK
- Epigenetički sat, metod za izračunavanje starosti na osnovu metilacije DNK
- Epigenom
- Genom
- Genomski otisak, naslijeđena represija alela, koja se oslanja na metilaciju DNK
- MethBase Baza podataka o metilaciji DNK koja se nalazi na UCSC Genome Browser
- MethDB Baza podataka o metilaciji DNK
- N6-metiladenozin
Reference[uredi | uredi izvor]
- ^ D. B. Dunn, J. D. Smith: The occurrence of 6-methylaminopurine in deoxyribonucleic acids. In: Biochem J. 68(4), Apr 1958, S. 627–636. PMID 13522672. Šablon:PMC.
- ^ B. F. Vanyushin, S. G. Tkacheva, A. N. Belozersky: Rare bases in animal DNA. In: Nature. 225, 1970, S. 948–949. PMID 4391887.
- ^ Melanie Ehrlich, Miguel A. Gama-Sosa, Laura H. Carreira, Lars G. Ljungdahl, Kenneth C. Kuo, Charles W. Gehrke: DNA methylation in thermophilic bacteria: N6-methylcytosine, 5-methylcytosine, and N6-methyladenine. In: Nucleic Acids Research. 13, 1985, S. 1399. PMID 4000939. Šablon:PMC.
- ^ Evans HH, Evans TE (10. 12. 1970). "Methylation of the deoxyribonucleic acid of Physarum polycephalum at various periods during the mitotic cycle". The Journal of Biological Chemistry. 245 (23): 6440. doi:10.1016/S0021-9258(18)62627-4. PMID 5530731.
- ^ Šablon:Cite bioRxiv(Information found in abstract)
- ^ Hu CW, Chen JL, Hsu YW, Yen CC, Chao MR (januar 2015). "Trace analysis of methylated and hydroxymethylated cytosines in DNA by isotope-dilution LC-MS/MS: first evidence of DNA methylation in Caenorhabditis elegans". The Biochemical Journal. 465 (1): 39–47. doi:10.1042/bj20140844. PMID 25299492.
- ^ Bird A (decembar 2001). "Molecular biology. Methylation talk between histones and DNA". Science's Compass. Science. 294 (5549): 2113–5. doi:10.1126/science.1066726. hdl:1842/464. PMID 11739943. S2CID 82947750.
As a result of this process, known as repeat-induced point mutation (RIP), the wild-type Neurospora genome contains a small fraction of methylated DNA, the majority of the DNA remaining nonmethylated.
- ^ Capuano F, Mülleder M, Kok R, Blom HJ, Ralser M (april 2014). "Cytosine DNA methylation is found in Drosophila melanogaster but absent in Saccharomyces cerevisiae, Schizosaccharomyces pombe, and other yeast species". Analytical Chemistry. 86 (8): 3697–702. doi:10.1021/ac500447w. PMC 4006885. PMID 24640988.
- ^ Ratel D, Ravanat JL, Berger F, Wion D (mart 2006). "N6-methyladenine: the other methylated base of DNA". BioEssays. 28 (3): 309–15. doi:10.1002/bies.20342. PMC 2754416. PMID 16479578.
- ^ Wu TP, Wang T, Seetin MG, Lai Y, Zhu S, Lin K, Liu Y, Byrum SD, Mackintosh SG, Zhong M, Tackett A, Wang G, Hon LS, Fang G, Swenberg JA, Xiao AZ (april 2016). "DNA methylation on N(6)-adenine in mammalian embryonic stem cells". Nature. 532 (7599): 329–33. Bibcode:2016Natur.532..329W. doi:10.1038/nature17640. PMC 4977844. PMID 27027282.
- ^ Angéla Békési and Beáta G Vértessy "Uracil in DNA: error or signal?"
- ^ Rana AK, Ankri S (2016). "Reviving the RNA World: An Insight into the Appearance of RNA Methyltransferases". Frontiers in Genetics. 7: 99. doi:10.3389/fgene.2016.00099. PMC 4893491. PMID 27375676.
- ^ Dodge JE, Ramsahoye BH, Wo ZG, Okano M, Li E (maj 2002). "De novo methylation of MMLV provirus in embryonic stem cells: CpG versus non-CpG methylation". Gene. 289 (1–2): 41–8. doi:10.1016/S0378-1119(02)00469-9. PMID 12036582.
- ^ Haines TR, Rodenhiser DI, Ainsworth PJ (decembar 2001). "Allele-specific non-CpG methylation of the Nf1 gene during early mouse development". Developmental Biology. 240 (2): 585–98. doi:10.1006/dbio.2001.0504. PMID 11784085.
- ^ a b Lister R, Pelizzola M, Dowen RH, Hawkins RD, Hon G, Tonti-Filippini J, Nery JR, Lee L, Ye Z, Ngo QM, Edsall L, Antosiewicz-Bourget J, Stewart R, Ruotti V, Millar AH, Thomson JA, Ren B, Ecker JR (novembar 2009). "Human DNA methylomes at base resolution show widespread epigenomic differences". Nature. 462 (7271): 315–22. Bibcode:2009Natur.462..315L. doi:10.1038/nature08514. PMC 2857523. PMID 19829295.
- ^ Lister R, Mukamel EA, Nery JR, Urich M, Puddifoot CA, Johnson ND, Lucero J, Huang Y, Dwork AJ, Schultz MD, Yu M, Tonti-Filippini J, Heyn H, Hu S, Wu JC, Rao A, Esteller M, He C, Haghighi FG, Sejnowski TJ, Behrens MM, Ecker JR (august 2013). "Global epigenomic reconfiguration during mammalian brain development". Science. 341 (6146): 1237905. doi:10.1126/science.1237905. PMC 3785061. PMID 23828890.
- ^ Kulis M, Merkel A, Heath S, Queirós AC, Schuyler RP, Castellano G, Beekman R, Raineri E, Esteve A, Clot G, Verdaguer-Dot N, Duran-Ferrer M, Russiñol N, Vilarrasa-Blasi R, Ecker S, Pancaldi V, Rico D, Agueda L, Blanc J, Richardson D, Clarke L, Datta A, Pascual M, Agirre X, Prosper F, Alignani D, Paiva B, Caron G, Fest T, Muench MO, Fomin ME, Lee ST, Wiemels JL, Valencia A, Gut M, Flicek P, Stunnenberg HG, Siebert R, Küppers R, Gut IG, Campo E, Martín-Subero JI (juli 2015). "Whole-genome fingerprint of the DNA methylome during human B cell differentiation". Nature Genetics. 47 (7): 746–56. doi:10.1038/ng.3291. PMC 5444519. PMID 26053498.
- ^ Tost J (2010). "DNA methylation: an introduction to the biology and the disease-associated changes of a promising biomarker". Mol Biotechnol. 44 (1): 71–81. doi:10.1007/s12033-009-9216-2. PMID 19842073. S2CID 20307488.
- ^ Stadler MB, Murr R, Burger L, Ivanek R, Lienert F, Schöler A, van Nimwegen E, Wirbelauer C, Oakeley EJ, Gaidatzis D, Tiwari VK, Schübeler D (decembar 2011). "DNA-binding factors shape the mouse methylome at distal regulatory regions". Nature. 480 (7378): 490–5. doi:10.1038/nature11086. PMID 22170606.
- ^ a b c Zemach A, McDaniel IE, Silva P, Zilberman D (maj 2010). "Genome-wide evolutionary analysis of eukaryotic DNA methylation". Science (ScienceExpress Report). 328 (5980): 916–9. Bibcode:2010Sci...328..916Z. doi:10.1126/science.1186366. PMID 20395474. S2CID 206525166.
Here we quantify DNA methylation in seventeen eukaryotic genomes....
Supplemental figures appear to be only accessible via the science.sciencemag.org paywall. - ^ Suzuki MM, Kerr AR, De Sousa D, Bird A (maj 2007). "CpG methylation is targeted to transcription units in an invertebrate genome". Genome Research. 17 (5): 625–31. doi:10.1101/gr.6163007. PMC 1855171. PMID 17420183.
- ^ Lander ES, Linton LM, Birren B, Nusbaum C, Zody MC, Baldwin J, et al. (februar 2001). "Initial sequencing and analysis of the human genome". Nature. 409 (6822): 860–921. Bibcode:2001Natur.409..860L. doi:10.1038/35057062. PMID 11237011.
- ^ Bird AP (15. 5. 1986). "CpG-rich islands and the function of DNA methylation". Nature. 321 (6067): 209–13. Bibcode:1986Natur.321..209B. doi:10.1038/321209a0. PMID 2423876. S2CID 4236677.
- ^ Gardiner-Garden M, Frommer M (juli 1987). "CpG islands in vertebrate genomes". Journal of Molecular Biology. 196 (2): 261–82. doi:10.1016/0022-2836(87)90689-9. PMID 3656447.
- ^ Illingworth RS, Gruenewald-Schneider U, Webb S, Kerr AR, James KD, Turner DJ, Smith C, Harrison DJ, Andrews R, Bird AP (septembar 2010). "Orphan CpG islands identify numerous conserved promoters in the mammalian genome". PLOS Genetics. 6 (9): e1001134. doi:10.1371/journal.pgen.1001134. PMC 2944787. PMID 20885785.
- ^ Saxonov S, Berg P, Brutlag DL (januar 2006). "A genome-wide analysis of CpG dinucleotides in the human genome distinguishes two distinct classes of promoters". Proceedings of the National Academy of Sciences of the United States of America. 103 (5): 1412–7. Bibcode:2006PNAS..103.1412S. doi:10.1073/pnas.0510310103. PMC 1345710. PMID 16432200.
- ^ a b Feng S, Cokus SJ, Zhang X, Chen PY, Bostick M, Goll MG, Hetzel J, Jain J, Strauss SH, Halpern ME, Ukomadu C, Sadler KC, Pradhan S, Pellegrini M, Jacobsen SE (maj 2010). "Conservation and divergence of methylation patterning in plants and animals". Proceedings of the National Academy of Sciences of the United States of America. 107 (19): 8689–94. doi:10.1073/pnas.1002720107. PMC 2889301. PMID 20395551.
- ^ Mohn F, Weber M, Rebhan M, Roloff TC, Richter J, Stadler MB, Bibel M, Schübeler D (juni 2008). "Lineage-specific polycomb targets and de novo DNA methylation define restriction and potential of neuronal progenitors". Molecular Cell. 30 (6): 755–66. doi:10.1016/j.molcel.2008.05.007. PMID 18514006.
- ^ Weber M, Hellmann I, Stadler MB, Ramos L, Pääbo S, Rebhan M, Schübeler D (april 2007). "Distribution, silencing potential and evolutionary impact of promoter DNA methylation in the human genome". Nature Genetics. 39 (4): 457–66. doi:10.1038/ng1990. PMID 17334365. S2CID 22446734.
- ^ Schübeler D (januar 2015). "Function and information content of DNA methylation". Nature. 517 (7534): 321–6. Bibcode:2015Natur.517..321S. doi:10.1038/nature14192. PMID 25592537. S2CID 4403755.
- ^ Choy MK, Movassagh M, Goh HG, Bennett MR, Down TA, Foo RS (septembar 2010). "Genome-wide conserved consensus transcription factor binding motifs are hyper-methylated". BMC Genomics. 11 (1): 519. doi:10.1186/1471-2164-11-519. PMC 2997012. PMID 20875111.
- ^ Dahlet T, Argüeso Lleida A, Al Adhami H, Dumas M, Bender A, Ngondo RP, et al. (juni 2020). "Genome-wide analysis in the mouse embryo reveals the importance of DNA methylation for transcription integrity". Nature Communications. 11 (1): 3153. Bibcode:2020NatCo..11.3153D. doi:10.1038/s41467-020-16919-w. PMC 7305168. PMID 32561758.
- ^ Huff JT, Zilberman D (mart 2014). "Dnmt1-independent CG methylation contributes to nucleosome positioning in diverse eukaryotes". Cell. 156 (6): 1286–1297. doi:10.1016/j.cell.2014.01.029. PMC 3969382. PMID 24630728.
- ^ Yoder JA, Walsh CP, Bestor TH (august 1997). "Cytosine methylation and the ecology of intragenomic parasites". Trends in Genetics. 13 (8): 335–40. doi:10.1016/s0168-9525(97)01181-5. PMID 9260521.
- ^ Zhou, Wanding; Liang, Gangning; Molloy, Peter L.; Jones, Peter A. (11. 8. 2020). "DNA methylation enables transposable element-driven genome expansion". Proceedings of the National Academy of Sciences of the United States of America. 117 (32): 19359–19366. doi:10.1073/pnas.1921719117. ISSN 1091-6490. PMC 7431005. PMID 32719115.
- ^ Lev Maor G, Yearim A, Ast G (maj 2015). "The alternative role of DNA methylation in splicing regulation". Trends in Genetics. 31 (5): 274–80. doi:10.1016/j.tig.2015.03.002. PMID 25837375.
- ^ Maunakea AK, Nagarajan RP, Bilenky M, Ballinger TJ, D'Souza C, Fouse SD, Johnson BE, Hong C, Nielsen C, Zhao Y, Turecki G, Delaney A, Varhol R, Thiessen N, Shchors K, Heine VM, Rowitch DH, Xing X, Fiore C, Schillebeeckx M, Jones SJ, Haussler D, Marra MA, Hirst M, Wang T, Costello JF (juli 2010). "Conserved role of intragenic DNA methylation in regulating alternative promoters". Nature. 466 (7303): 253–7. Bibcode:2010Natur.466..253M. doi:10.1038/nature09165. PMC 3998662. PMID 20613842.
- ^ Carrozza MJ, Li B, Florens L, Suganuma T, Swanson SK, Lee KK, Shia WJ, Anderson S, Yates J, Washburn MP, Workman JL (novembar 2005). "Histone H3 methylation by Set2 directs deacetylation of coding regions by Rpd3S to suppress spurious intragenic transcription". Cell. 123 (4): 581–92. doi:10.1016/j.cell.2005.10.023. PMID 16286007. S2CID 9328002.
- ^ Rana AK (januar 2018). "Crime investigation through DNA methylation analysis: methods and applications in forensics". Egyptian Journal of Forensic Sciences. 8 (7). doi:10.1186/s41935-018-0042-1.
- ^ Hernández HG, Tse MY, Pang SC, Arboleda H, Forero DA (oktobar 2013). "Optimizing methodologies for PCR-based DNA methylation analysis". BioTechniques. 55 (4): 181–97. doi:10.2144/000114087. PMID 24107250.
- ^ Wood RJ, Maynard-Smith MD, Robinson VL, Oyston PC, Titball RW, Roach PL (august 2007). Fugmann S (ured.). "Kinetic analysis of Yersinia pestis DNA adenine methyltransferase activity using a hemimethylated molecular break light oligonucleotide". PLOS ONE. 2 (8): e801. Bibcode:2007PLoSO...2..801W. doi:10.1371/journal.pone.0000801. PMC 1949145. PMID 17726531.
- ^ Li J, Yan H, Wang K, Tan W, Zhou X (februar 2007). "Hairpin fluorescence DNA probe for real-time monitoring of DNA methylation". Analytical Chemistry. 79 (3): 1050–6. doi:10.1021/ac061694i. PMID 17263334.
- ^ Wojdacz TK, Dobrovic A (2007). "Methylation-sensitive high resolution melting (MS-HRM): a new approach for sensitive and high-throughput assessment of methylation". Nucleic Acids Research. 35 (6): e41. doi:10.1093/nar/gkm013. PMC 1874596. PMID 17289753.
- ^ Malentacchi F, Forni G, Vinci S, Orlando C (juli 2009). "Quantitative evaluation of DNA methylation by optimization of a differential-high resolution melt analysis protocol". Nucleic Acids Research. 37 (12): e86. doi:10.1093/nar/gkp383. PMC 2709587. PMID 19454604.
- ^ Gokhman D, Lavi E, Prüfer K, Fraga MF, Riancho JA, Kelso J, Pääbo S, Meshorer E, Carmel L (maj 2014). "Reconstructing the DNA methylation maps of the Neandertal and the Denisovan". Science. 344 (6183): 523–7. Bibcode:2014Sci...344..523G. doi:10.1126/science.1250368. PMID 24786081. S2CID 28665590.
- ^ Gokhman D, Mishol N, de Manuel M, de Juan D, Shuqrun J, Meshorer E, et al. (septembar 2019). "Reconstructing Denisovan Anatomy Using DNA Methylation Maps". Cell. 179 (1): 180–192.e10. doi:10.1016/j.cell.2019.08.035. PMID 31539495. S2CID 202676502.
- ^ Forat S, Huettel B, Reinhardt R, Fimmers R, Haidl G, Denschlag D, Olek K (1. 2. 2016). "Methylation Markers for the Identification of Body Fluids and Tissues from Forensic Trace Evidence". PLOS ONE. 11 (2): e0147973. Bibcode:2016PLoSO..1147973F. doi:10.1371/journal.pone.0147973. PMC 4734623. PMID 26829227.
- ^ "Infinium Methylation Assay | Interrogate single CpG sites". www.illumina.com. Pristupljeno 10. 1. 2020.
- ^ "Infinium MethylationEPIC Kit | Methylation profiling array for EWAS". www.illumina.com. Pristupljeno 10. 1. 2020.
- ^ "Epigenetics and methylation analysis". Oxford Nanopore Technologies (jezik: engleski). Arhivirano s originala, 1. 9. 2021. Pristupljeno 27. 9. 2021.
Dopunska literatura[uredi | uredi izvor]
- Law JA, Jacobsen SE (mart 2010). "Establishing, maintaining and modifying DNA methylation patterns in plants and animals". Nature Reviews Genetics. 11 (3): 204–20. doi:10.1038/nrg2719. PMC 3034103. PMID 20142834.
- Straussman R, Nejman D, Roberts D, Steinfeld I, Blum B, Benvenisty N, Simon I, Yakhini Z, Cedar H (maj 2009). "Developmental programming of CpG island methylation profiles in the human genome". Nature Structural & Molecular Biology. 16 (5): 564–71. doi:10.1038/nsmb.1594. PMID 19377480. S2CID 8804930.
- Patra SK (april 2008). "Ras regulation of DNA-methylation and cancer". Experimental Cell Research. 314 (6): 1193–201. doi:10.1016/j.yexcr.2008.01.012. PMID 18282569.
- Patra SK, Patra A, Rizzi F, Ghosh TC, Bettuzzi S (juni 2008). "Demethylation of (Cytosine-5-C-methyl) DNA and regulation of transcription in the epigenetic pathways of cancer development". Cancer and Metastasis Reviews. 27 (2): 315–34. doi:10.1007/s10555-008-9118-y. hdl:11381/1797001. PMID 18246412. S2CID 22435914.
Vanjski linkovi[uredi | uredi izvor]
| Commons ima datoteke na temu: Metilacija DNK |
- DNA Methylation na US National Library of Medicine Medical Subject Headings (MeSH)
- ENCODE threads explorer Non-coding RNA characterization. Nature
- PCMdb Pancreatic Cancer Methylation Database.
- Nagpal G, Sharma M, Kumar S, Chaudhary K, Gupta S, Gautam A, Raghava GP (februar 2014). "PCMdb: pancreatic cancer methylation database". Scientific Reports. 4: 4197. Bibcode:2014NatSR...4E4197N. doi:10.1038/srep04197. PMC 3935225. PMID 24569397.
- SMART Specific Methylation Analysis and Report Tool
- Human Methylation Mark Atlas
- DiseaseMeth Arhivirano 27. 1. 2020. na Wayback Machine Human disease methylation database
- EWAS Atlas A knowledgebase of epigenome-wide association studies

