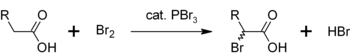Fosfor-tribromid
| Fosfor-tribromid | |
|---|---|
  | |
| Općenito | |
| Hemijski spoj | Fosfor-tribromid |
| Druga imena | Fosfor(III) bromid, Fosfor-bromid, Tribromofosfin |
| Molekularna formula | PBr3 |
| CAS registarski broj | 7789-60-8 |
| SMILES | BrP(Br)Br |
| InChI | 1S/Br3P/c1-4(2)3 |
| Kratki opis | Bistra, bezbojna tečnost |
| Osobine1 | |
| Molarna masa | 270,69 g/mol |
| Agregatno stanje | Tečno |
| Gustoća | 2,852 g/cm3 |
| Tačka topljenja | -41,5 |
| Tačka ključanja | 173,2 |
| Rizičnost | |
| NFPA 704 | |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |

Fosfor-tribromid je bistra bezbojna tečnost čija je formula PBr3. To je bezbojna tekućina koja isparava u vlažan zrak zbog hidrolize i ima prodoran miris. Upotrebljava se u laboratorijama za pretvaranje alkohola u alkil bromid.
Dobijanje[uredi | uredi izvor]
PBr3 priprema se tretiranjem crvenog fosfora bromom. Višak fosfora se koristi kako bi se spriječilo formiranje PBr5:[1][2]
- 2 P + 3 Br2 → 2PBr3
Budući da je ova reakcija visoko egzotermna, često se obavlja u prisustvu otapala, kao što je PBr3
Reakcije[uredi | uredi izvor]
Fosfor-tribromid, kao i PCl3 i PF3, imaju obiljažja i Lewisovih baza i Lewisovih kiselina. Naprimjer, sa Lewisovom kiselinom kao što je bor-tribromid formira stabilne 1:1 adukte, kao što je Br3B·PBr3. U isto vrijeme PBr3, u većini reakcija može reagirati kao elektrofil ili Lewisova kiselina, naprimjer sa aminima.
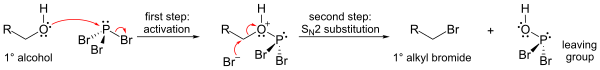
Najznačajnija reakcija PBr3 je sa alkoholima, gdje zamjenjuju OH grupu atomom broma kada nastaje alkil bromid. Pritom se mogu transferirati ava tri bromida.
- PBr3 + 3 ROH → 3 RBr + HP(O)(OH)2.
Mehanizam (prikazan za primarni alkohol) uključuje formiranje fosfor-estra (da se formira dobra napuštajuća grupa), a zatim slijedi SN2 supstitucija.
Zbog koraka supstitucije SN2, reakcija e općenito dobro odvija za primarne, sekundarne alkohole za piće, ali ne i za tercijarne alkohole. Ako reagira hiralni ugljikov centar, reakcija se obično javlja sa inverzijom konfiguracije na alkoholnpm alfa ugljiku, kao što je uobičajeno u reakciju SN2.
U sličnoj reakciji, PBr3 pretvara i karboksilne kiseline u acil-bromide
- PBr3+3 RCOOH → 3 RCOBr + HP(O)(OH)2.
Primjena[uredi | uredi izvor]
Glavna upotreba fosfor-tribromida je za konverziju primarnih ili sekundarnih alkohola u alkil-bromide,[3] kao što je gore opisano. PBr3obično daje veći prinos nego hidrobromna kiselina, a nema probleme karbokationskih rearanžmana – naprimjer, od alkohola može biti napravljen čak i neopentil bromid, sa prinosom od oko 60%.[4] Druga upotreba PBr3 je kataliza α-bromacije karboksilnih kiselina. Iako su acil bromidi rijetki u odnosu na acil hloride, oni se koriste kao međuproizvodi u Hell-Volhard-Zelinsky halogenaciji.[5] Početni PBr3 reagira sa karboksilnom kiselinom i formira acil-bromid, koji je mnogo reaktivniji prema bromaciji. Sveukupni proces se može predstaviti kao:
Na komercijalnoj razini, fosfor-tribromid se koristi u farmaceutskoj proizvodnji, kao što su preparati alprazolam, metoheksital i fenoprofen. To je također moćan agens za suzbijanje požara, na tržištu pod imenom PhostrEx.[6][7][8]
Mjere opreza[uredi | uredi izvor]
PBr3 razvija korozivni HBr, koji je toksičan i burno reagira s vodom i alkoholom. U reakcijama koje, kao sporedni proizvod, daju fosfornu kiselinu, kada se radi se destilacijom treba znati da to može razviti temperaturu iznad oko 160 °C kada nastaje fosfin koji, u dodiru sa zrakom, može izazvati eksploziju.[3]
Reference[uredi | uredi izvor]
- ^ J. F. Gay, R. N. Maxson "Phosphorus(III) Bromide" Inorganic Syntheses, 1947, vol. 2, 147ff. doi:10.1002/9780470132333.ch43
- ^ Burton, T. M.; Degerping, E. F. (1940). "The Preparation of Acetyl Bromide". Journal of the American Chemical Society. 62 (1): 227. doi:10.1021/ja01858a502.
- ^ a b Harrison, G. C.; Diehl, H. (1955). "β-Ethoxyethyl Bromide". 3: 370:cv3p0370. journal zahtijeva
|journal=(pomoć)CS1 održavanje: više imena: authors list (link) - ^ Wade, L. G. Jr. (2005). Organic Chemistry (6th izd.). Upper Saddle River, NJ, USA: Pearson/Prentice Hall. str. 477.
- ^ Wade, L. G. Jr. (2005). Organic Chemistry (6th izd.). Upper Saddle River, NJ, USA: Pearson/Prentice Hall. str. 1051.
- ^ Alberts B.; et al. (2002). Molecular Biology of the Cell, 4th Ed. Garland Science. ISBN 0-8153-4072-9. Eksplicitna upotreba et al. u:
|author=(pomoć) - ^ Campbell N. A.; et al. (2008). Biology. 8th Ed. Person International Edition, San Francisco. ISBN 978-0-321-53616-7. Eksplicitna upotreba et al. u:
|author=(pomoć) - ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Eds. (2005). Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB) Sarajevo. ISBN 9958-9344-1-8.CS1 održavanje: više imena: authors list (link)
Dopunska literatura[uredi | uredi izvor]
- Lide, D. R., ured. (1990). Handbook of Chemistry and Physics (71st izd.). Ann Arbor, MI: CRC Press. ISBN 978-0849304712.
- March, J. (1992). Advanced Organic Chemistry (4th izd.). New York: Wiley. str. 723. ISBN 978-0471601807.
- Stecher, P. G., ured. (1960). The Merck Index (7th izd.). Rahway, NJ, USA: Merck & Co.
- Holmes, R. R. (1960). "An Examination of the Basic Nature of the Trihalides of Phosphorus, Arsenic and Antimony". Journal of Inorganic and Nuclear Chemistry. 12 (3–4): 266–275. doi:10.1016/0022-1902(60)80372-7.
Vanjski linkovi[uredi | uredi izvor]
| Phosphorus tribromine na Wikimedia Commonsu. |