Karbonilna grupa

Karbonilna grupa ili karbonil – u organskoj hemiji – je funkcionalna grupa koja sadrži ugljikov atom vezan dvostrukom vezom za kisikov atom (C=O).
Termin karbonil se također može odnositi i na ugljik-monoksid kao ligand u neorganskim ili organometalnim kompleksima (metalni karbonil, kao naprimjer nikl-tetrakarbonil).
Karbonilna jedinjenja[uredi | uredi izvor]
Karbonilna grupa karakteriše sljedeće tipove spojeva:
| Jedinjenje | Aldehid | Keton | Karboksilna kiselina | Ester | Amid | Enon | Acil halid | Acil anhidrid |
| Struktura |  |
 |
 |
 |
 |

| ||
| Generalna formula | RCHO | RCOR' | RCOOH | RCOOR' | RCONR'R'' | RC(O)C(R')CR''R''' | RCOX | (RCO)2O |
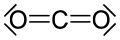
Drugi organski karbonili su urea i karbamati, izvedenice acil hlorida: hloroformati i fosgen, karbonatni estri, tioestri, laktoni, laktami, hidroksamati i izocijanati. Primjeri neorganskih karbonilnih spojeva su ugljen-dioksid i karbonil-sulfid.
Posebna grupa karbonilnih jedinjenja su 1,3-dikarbonil jedinjenja koja imaju kisele protone na središnjoj metilenskoj jedinici. Primjeri su meldrumska kiselina, dietil malonat i acetilaceton.
Reaktivnost[uredi | uredi izvor]

Kisik je elektronegativniji od ugljika, tako da odnosi elektronsku gustinu sa ugljika, čime povećava polarnost veze. Karbonilni ugljik postaje elektrofilan, i tako lakše reagira sa nukleofilima. Elektronegativni kiseonik može također reagirati sa elektrofilima, kao naprimjer, sa protonom iz kiselog rastvora ili drugim Luisovim kiselinama.
Alfa vodici karbonilnog jedinjenja su znatno kiseliji (~103 puta kiseliji) nego u oni u tipskoj C-H vezi. Naprimjer, pKa vrijednosti acetaldehida i acetona su 16,7, odnosno 19.[1] Karbonil je u tautomernoj rezonansi sa enolom. Deprotonacija enola jakom bazom daje enolat, koji je snažan nukleofil i može alkilirati elektrofile, kao što su drugi karbonili.
Ovaj članak nije preveden ili je djelimično preveden. |
Također pogledajte[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ Ouellette R.J., Rawn J.D. (1996): : Organic Chemistry, 1st Ed. Prentice-Hall, Inc., New Jersey. ISBN 0-02-390171-3.
Vanjski linkovi[uredi | uredi izvor]
| Commons ima datoteke na temu: Karbonilna grupa |
- L.G. Wade, Jr. Organic Chemistry, 5th ed. Prentice Hall, 2002. ISBN 0-13-033832-X
- The Frostburg State University Chemistry Department. Organic Chemistry Help (2000).
- Advanced Chemistry Development, Inc. IUPAC Nomenclature of Organic Chemistry Arhivirano 11. 2. 2020. na Wayback Machine (1997).
- William Reusch. tara VirtualText of Organic Chemistry (2004).
- Purdue Chemistry Department [1] (retrieved Sep 2006). Includes water solubility data.
- William Reusch. (2004) Aldehydes and Ketones, Pristupljeno 23. 5. 2005.
- ILPI. (2005) The MSDS Hyperglossary- Anhydride.

