Razlika između verzija stranice "Keton"
| [pregledana izmjena] | [pregledana izmjena] |
m Kategorija:Funkcionalne grupe uklonjena (uz pomoć HotCat-a) |
No edit summary |
||
| Red 1: | Red 1: | ||
{{Preuređivanje}}{{Čišćenje}} |
|||
[[Datoteka:Ketone-group-2D-skeletal.svg|150px|right|thumb|Ketonska grupa]] |
[[Datoteka:Ketone-group-2D-skeletal.svg|150px|right|thumb|Ketonska grupa]] |
||
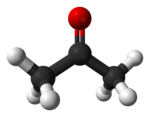
{{Multiple image|direction=vertical|align=right|image1=Aceton.svg|image2=Acetone-3D-balls.png|width=150|caption2=[[Aceton]]}} |
{{Multiple image|direction=vertical|align=right|image1=Aceton.svg|image2=Acetone-3D-balls.png|width=150|caption2=[[Aceton]]}} |
||
'''Ketoni''' su oni organski spojevi sa [[kisik]]om koja sadrže karbolnilnu - keto-grupu. Dvije akil-grupe su vezane za ugljikov atom karbonilne grupe. Ketoni nastaju oksidacijom sekudarnih alkohola. Opća formula ketona je:<br> |
'''Ketoni''' su oni organski spojevi sa [[kisik]]om koja sadrže karbolnilnu - keto-grupu. Dvije akil-grupe su vezane za ugljikov atom karbonilne grupe. Ketoni nastaju oksidacijom sekudarnih alkohola. Opća formula ketona je:<br> |
||
R1(CO)R2. |
R1(CO)R2.<ref>Kornberg A. (1989): For the love of enzymes – The Odyssay of a biochemist. Harvard University Press, Cambridge (Mass.), London,ISBN 0-674-30775-5, ISBN 0-674-30776-3.</ref> |
||
==Nomenklatura i etimologija== |
==Nomenklatura i etimologija== |
||
| Red 10: | Red 11: | ||
==Struktura i osobenosti== |
==Struktura i osobenosti== |
||
| ⚫ | Ketonski ugljici se često opisuju kao "sp<sup>2</sup> hibridiziran", opisujući uključivanje i elektronsku i molekulsku strukturu. Ketoni su trigonalno planarni oko ketonskih ugljika, sa C-C-O i uglovima C-C-C veza od približno 120°. Ketoni se razlikuju od [[aldehid]]a u toj karbonilnoj grupi (CO) po tome što je je vezana za dva ugljika unutar ugljučnog skeleta. U aldehidima, karbonilna grupa je vezana za jedan ugljik i jedan vodik, koji se nalaze na krajevima ugljičnok lanaca. Ketoni se razlikuju i od drugih spojeva koji sadrže [[funkcijska grupa|funkcionalne grupe]] , kao što su karboksilne kiseline, [[ester]]i i [[amid]]i.<ref>Hunter G. K. (2000): Vital Forces. The discovery of the molecular basis of life. Academic Press, London 2000, ISBN 0-12-361811-8.</ref><ref>Nelson D. L., Cox M. M. (2013): Lehninger Principles of Biochemistry. W. H. Freeman and Co., ISBN 978-1-4641-0962-1.</ref> |
||
[[Datoteka:KetoneVarietyPack.png|thumb|700px|center|Reprezentativni ketoni, s lijeva:<br> [[Aceton]], uobičajeni rastvarača;<br>Oksaloacetat, međuprodukt u [[Krebsov ciklus|metabolizmu šećera]]; <br>[[Acetilaceton]] u svojoj (mono) enolnoj formi (plavo); <br>[[Cikloheksanon]], precursor [[najlon]]a;<br> [[Muskon]], životinjski miris; <br> [[Tetraciklin]] – [[antibiotik]].]] |
|||
| ⚫ | Ketonski ugljici se često opisuju kao "sp<sup>2</sup> hibridiziran", opisujući uključivanje i elektronsku i molekulsku strukturu. Ketoni su trigonalno planarni oko ketonskih ugljika, sa C-C-O i uglovima C-C-C veza od približno 120°. Ketoni se razlikuju od [[aldehid]]a u toj karbonilnoj grupi (CO) po tome što je je vezana za dva ugljika unutar ugljučnog skeleta. U aldehidima, karbonilna grupa je vezana za jedan ugljik i jedan vodik, koji se nalaze na krajevima ugljičnok lanaca. Ketoni se razlikuju i od drugih spojeva koji sadrže [[funkcijska grupa|funkcionalne grupe]] , kao što su karboksilne kiseline, [[ester]]i i [[amid]]i.<ref>Hunter G. K. (2000): Vital Forces. The discovery of the molecular basis of life. Academic Press, London 2000, ISBN 0-12-361811-8.</ref><ref>Nelson D. L., Cox M. M. (2013): Lehninger Principles of Biochemistry. W. H. Freeman and Co., ISBN 978-1-4641-0962-1 |
||
Karbonilnu grupa je [[polarnost| polarna]] jer je elektronegativnosti kisika veća od one za ugljik. Stoga su ketoni nukleofilni – od kisika i elektrofilni – od ugljika. Zato što je karbonilna grupa u interakciji s vodom preko vodikovih veza, ketoni su obično rastvorljiviju u vodi nego spojevi sa metilenskim vezama. Ketoni su akceptori vodikovih veza, a kao donori obično obično ne mog privući ovakvu vezu za sebe. Zbog njihove nemogućnosti da služe i kao donatori i vodikovih veza kao akceptori, ketoni imaju tendenciju da se ne "samoasociraju" i nestabilniji su od [[alkohol]]a i karboksilnih kiselina usporedivih [[molekulska masa|molekulskih težina]]. Ovi faktori su u vezi sa sveprisutnošču ketonskih otapala u parfimerijama. |
Karbonilnu grupa je [[polarnost| polarna]] jer je elektronegativnosti kisika veća od one za ugljik. Stoga su ketoni nukleofilni – od kisika i elektrofilni – od ugljika. Zato što je karbonilna grupa u interakciji s vodom preko vodikovih veza, ketoni su obično rastvorljiviju u vodi nego spojevi sa metilenskim vezama. Ketoni su akceptori vodikovih veza, a kao donori obično obično ne mog privući ovakvu vezu za sebe. Zbog njihove nemogućnosti da služe i kao donatori i vodikovih veza kao akceptori, ketoni imaju tendenciju da se ne "samoasociraju" i nestabilniji su od [[alkohol]]a i karboksilnih kiselina usporedivih [[molekulska masa|molekulskih težina]]. Ovi faktori su u vezi sa sveprisutnošču ketonskih otapala u parfimerijama. |
||
| Red 21: | Red 20: | ||
*asimetrični derivati,<br> ovisno o ekvivalentnosti dvaju organskih supstituenta koji su priključeni na karbonilni centar. Aceton i [[benzofenon]] (C<sub>6</sub>H<sub>5</sub>C(O)C <sub>6</sub>H<sub>5</sub>) su simetrične ketone. [[Acetofenon]] (C<sub>6</sub>H<sub>5</sub>C(O)CH<sub>3</sub>) su asimetrični ketoni. U oblasti [[stereohemija|stereohemije]], asimetrični ketoni su poznati kao ''prohiralni''. |
*asimetrični derivati,<br> ovisno o ekvivalentnosti dvaju organskih supstituenta koji su priključeni na karbonilni centar. Aceton i [[benzofenon]] (C<sub>6</sub>H<sub>5</sub>C(O)C <sub>6</sub>H<sub>5</sub>) su simetrične ketone. [[Acetofenon]] (C<sub>6</sub>H<sub>5</sub>C(O)CH<sub>3</sub>) su asimetrični ketoni. U oblasti [[stereohemija|stereohemije]], asimetrični ketoni su poznati kao ''prohiralni''. |
||
==Također pogledajte== |
|||
*[[Vodikova veza]] |
|||
*[[Aceton]] |
|||
==Reference== |
==Reference== |
||
Verzija na dan 17 septembar 2017 u 15:41
Ovom članku potrebna je jezička standardizacija, preuređivanje ili reorganizacija. |
Ovaj članak zahtijeva čišćenje. |

Ketoni su oni organski spojevi sa kisikom koja sadrže karbolnilnu - keto-grupu. Dvije akil-grupe su vezane za ugljikov atom karbonilne grupe. Ketoni nastaju oksidacijom sekudarnih alkohola. Opća formula ketona je:
R1(CO)R2.[1]
Nomenklatura i etimologija
Naziv keton je izveden iz Aketon, stare njemačke oznake za aceton.
Po IUPAC nomenklaturi, ketoni se imenjuju tako da se sufiks -an na početnom alkanu promijeni u -anon. Za važnije ketone se koriste tradicijska nesistemska imena, kao, naprimjer aceton i benzofenon. Ta nesistemska imena su zadržana i u IUPAC oznakama,iako pojedini izvori koriste imena poput 2-propanon ili propan-2-on umjesto acetona – najjednostavnijeg ketona (C-H3-CO-CH3). Pozicija karbonilne grupe se obično označava brojem.
Struktura i osobenosti
Ketonski ugljici se često opisuju kao "sp2 hibridiziran", opisujući uključivanje i elektronsku i molekulsku strukturu. Ketoni su trigonalno planarni oko ketonskih ugljika, sa C-C-O i uglovima C-C-C veza od približno 120°. Ketoni se razlikuju od aldehida u toj karbonilnoj grupi (CO) po tome što je je vezana za dva ugljika unutar ugljučnog skeleta. U aldehidima, karbonilna grupa je vezana za jedan ugljik i jedan vodik, koji se nalaze na krajevima ugljičnok lanaca. Ketoni se razlikuju i od drugih spojeva koji sadrže funkcionalne grupe , kao što su karboksilne kiseline, esteri i amidi.[2][3]
Karbonilnu grupa je polarna jer je elektronegativnosti kisika veća od one za ugljik. Stoga su ketoni nukleofilni – od kisika i elektrofilni – od ugljika. Zato što je karbonilna grupa u interakciji s vodom preko vodikovih veza, ketoni su obično rastvorljiviju u vodi nego spojevi sa metilenskim vezama. Ketoni su akceptori vodikovih veza, a kao donori obično obično ne mog privući ovakvu vezu za sebe. Zbog njihove nemogućnosti da služe i kao donatori i vodikovih veza kao akceptori, ketoni imaju tendenciju da se ne "samoasociraju" i nestabilniji su od alkohola i karboksilnih kiselina usporedivih molekulskih težina. Ovi faktori su u vezi sa sveprisutnošču ketonskih otapala u parfimerijama.
Klase ketona
Ketoni se klasificiraju na osnovu supstituenata. Jedna široka klasifikacija dijeli ketone u dvije grupe:
- simetrični i
- asimetrični derivati,
ovisno o ekvivalentnosti dvaju organskih supstituenta koji su priključeni na karbonilni centar. Aceton i benzofenon (C6H5C(O)C 6H5) su simetrične ketone. Acetofenon (C6H5C(O)CH3) su asimetrični ketoni. U oblasti stereohemije, asimetrični ketoni su poznati kao prohiralni.
Reference
- ^ Kornberg A. (1989): For the love of enzymes – The Odyssay of a biochemist. Harvard University Press, Cambridge (Mass.), London,ISBN 0-674-30775-5, ISBN 0-674-30776-3.
- ^ Hunter G. K. (2000): Vital Forces. The discovery of the molecular basis of life. Academic Press, London 2000, ISBN 0-12-361811-8.
- ^ Nelson D. L., Cox M. M. (2013): Lehninger Principles of Biochemistry. W. H. Freeman and Co., ISBN 978-1-4641-0962-1.
Vanjski linkovi
- http://www.etymonline.com/index.php?term=ketone Online Etymology Dictionary.
- List of retained IUPAC names, http://www.acdlabs.com/iupac/nomenclature/93/r93_701.htm retained IUPAC names Link.