Naponski ovisni ionski kanal
| Naponski vođeni ionski kanal | |
|---|---|
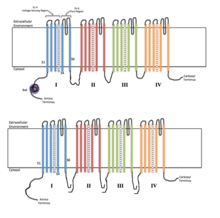 Svaki od četiri homologna domena čini jednu podjedinicu ionskog kanala. S4 segmenti osjetljivi na napon (označeni simbolima +) prikazani su kao napunjeni. | |
| Identifikatori | |
| Simbol | VIC |
| Pfam klan | CL0030 |
| TCDB | 1.A.1 |
| OPM superporodica | 8 |
| OPM protein | 2a79 |

Ionski kanali sa ograničenim naponom su klasa transmembranskih proteina koji formiraju ionske kanale koji se aktiviraju promjenama u električnom membranskom potencijalu u blizini kanala. Membranski potencijal mijenja konformaciju proteina kanala, regulirajući njihovo otvaranje i zatvaranje. Ćelijske membrane su općenito nepropusne za ione, tako da moraju difundirati kroz membranu preko transmembranskih proteinskih kanala. Oni imaju ključnu ulogu u ekscitabilnim ćelijama kao što su neuronsko i mišićno tkivo, omogućavajući brzu i koordiniranu depolarizaciju kao odgovor na pokretanje promjene napona. Pronađeni duž aksona i na sinapsama, ionski kanali vođeni naponom usmjereno šire električne signale. Naponski vođeni ionski kanali su obično ionski specifični, a identifikovani su ionski kanali specifični za natrij (Na+), kalij (K+), kalcij (Ca2+) i hloride (Cl−).[1] Otvaranje i zatvaranje kanala se pokreće promjenom koncentracije iona, a time i gradijenta naboja, između strana ćelijske membrane.[2]
Struktura[uredi | uredi izvor]
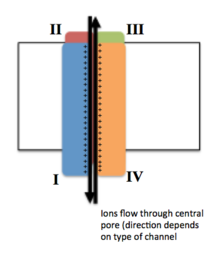
Naponski vođeni ionski kanali se općenito sastoje od nekoliko podjedinica raspoređenih na takav način da postoji centralna pora kroz koju ioni mogu putovati niz svoje elektrohemijske gradijente. Kanali su obično specifični za ione, iako ioni slične veličine i naboja ponekad mogu putovati kroz njih. Funkcionalnost naponski vođenih ionskih kanala pripisuje se njihovim trima glavnim diskretnim jedinicama: senzoru napona, pori ili provodnom putu i ulazu.[3] Na+, K+ i Ca2+ kanali sastoje se od po četiri transmembranska domena raspoređena oko centralne pore; ova četiri domena su dio jedne α-podjedinice u slučaju većine Na+ i Ca2+ kanala, dok postoje četiri α-podjedinice, od kojih svaka doprinosi jednom transmembranskom domenu, u većini K+ kanala.[4] Segmenti koji protežu membranu, označeni kao S1-S6, svi imaju oblik alfa-heliksa sa specijalizovanim funkcijama. Peti i šesti transmembranski segment (S5 i S6) i petlja pora imaju glavnu ulogu ionske provodljivosti, čineći kapiju/ulaz i pore kanala, dok S1-S4 služe kao područje osjetljivosti na napon. Četiri podjedinice mogu biti identične ili različite jedna od druge. Pored četiri centralne α-podjedinice, postoje i regulacijske β-podjedinice, sa aktivnošću oksidoreduktaza, koje se nalaze na unutrašnjoj površini ćelijske membrane i ne prelaze kroz membranu, a koje su spojene sa α-podjedinicom u endoplazmatskom retikulumu.[5]
Mehanizam[uredi | uredi izvor]
Kristalografska studija strukture kalijevog kanala pokazala je da, kada se potencijalna razlika unese preko membrane, povezano električno polje izaziva konformacijsku promjenu u kalijevom kanalu. Konformacijska promjena iskrivljuje oblik proteina kanala u dovoljnoj mjeri tako da se šupljina, ili kanal, otvara kako bi se omogućio priliv ili efluks kroz membranu. Ovo kretanje iona niz njihove koncentracijske gradijente potom stvara električnu struju dovoljnu da depolarizira ćelijsku membranu.
Naponski-vođeni natrijevi i kalcijski kanali se sastoje od jednog polipeptida sa četiri homologna domena. Svaki domen sadrži po 6 membrana koje se protežu od alfa-heliksa. Jedna od ovih spirala, S4, je heliks koji osjeti napon.[6] S4 segment sadrži mnogo pozitivnih naboja tako da visoki pozitivni naboj izvan ćelije odbija spiralu, održavajući kanal u zatvorenom stanju.
Općenito, dio ionskog kanala koji osjeća napon odgovoran je za detekciju promjena u transmembranskom potencijalu koje pokreću otvaranje ili zatvaranje kanala. Općenito se smatra da S1-4 alfa-heliksi služe ovoj ulozi. U kalijevim i natrijevim kanalima, S4 heliksi koji se bave naponom sadrže pozitivno nabijene ostatke lizina ili arginina u ponavljanim motivima.[3] U svom stanju mirovanja, polovina svake spirale S4 je u kontaktu sa ćelijskim citosolom. Nakon depolarizacije, pozitivno nabijeni ostaci na S4 domenima kreću se prema egzoplazmatskoj površini membrane. Smatra se da prva 4 arginina predstavljaju struju zatvaranja, koja se kreće prema vanćelijskom rastvaraču nakon aktivacije kanala, kao odgovor na depolarizaciju membrane. Kretanje 10-12 ovih pozitivnih naboja vezanih za proteine pokreće konformacijsku promjenu koja otvara kanal.[4] Tačan mehanizam po kojem se ovo kretanje događa još nije dogovoren, međutim kanonski, transporterski, veslački i uvrnuti modeli su primjeri dosadašnjih teorija.[7]
Kretanje naponskog senzora pokreće konformacijsku promjenu ulaza provodnog puta, kontrolirajući protok iona kroz kanal.[3]
Glavni funkcionalni dio domena proteina osjetljivog na napon ovih kanala općenito sadrži regiju sastavljenu od spirala S3b i S4, poznatu kao "lopatica" zbog svog oblika, koja izgleda kao konzervirana sekvenca, međusobno zamjenjiva, u širokom izboru ćelija i vrsta. Slična lopatica senzora napona je također pronađena u porodici nsponski-osjetljivih fosfataza u različitim vrstama.[8] Genetičkoinženjerstveno uvedene regije lopatice od vrsta nastanjenih u vulkanskim Archaebacteria u kalijeve kanale pacovskog mozga rezultira potpuno funkcionalnim ionskim kanalom, sve dok se cijelo netaknuto veslo zamijeni.Greška kod citiranja: Nevaljana oznaka <ref>;
nevaljani nazivi, npr. možda ih je previše
Iako se ionski kanali koji se regulišu naponom obično aktiviraju membranom depolarizacija, neki kanali, kao što sun kanali ispravljača kalijevih ionskih kanala ka unutrašnjosti, se umjesto toga aktiviraju hiperpolarizacijom.
Smatra se da je kapija/ulaz povezan(a) sa naponskim područjima kanala i čini se da sadrži mehaničku prepreku ionskom toku.[9] Dok je domen S6 dogovoren kao segment koji djeluje kao ova opstrukcija, njegov tačan mehanizam nije poznat. Moguća objašnjenja uključuju: segment S6 čini pokret poput škara, omogućavajući ionima da prolaze,[10] segment S6 se lomi na dva dijela, omogućavajući prolazak iona kroz kanal,[11] ili sam S6 kanal služi kao kapija.[12] Mehanizam po kojem pomicanje segmenta S4 utiče na segment S6 je još uvijek nepoznat, međutim teoretizira se da postoji S4-S5 linker čije kretanje omogućava otvaranje S6.[3]
Inaktivacija ionskih kanala dešava se unutar milisekundi nakon otvaranja. Smatra se da je inaktivacija posredovana unutarćelijskom kapijom koja kontrolira otvaranje pora u unutrašnjosti ćelije.[13] Ova kapija je modelirana kao lopta vezana za fleksibilni lanac. Tokom inaktivacije, lanac se sam savija i lopta blokira protok iona kroz kanal.[14] Brza inaktivacija je direktno povezana s aktivacijom uzrokovanom intramembranskim pokretima S4 segmenata,[15] iako je mehanizam koji povezuje kretanje S4 i zahvatanje kapije za inaktivaciju nepoznat.
Različiti tipovi[uredi | uredi izvor]
Natrijevi (Na+) kanali[uredi | uredi izvor]
Natrijski kanali imaju slična funkcionalna svojstva u mnogim različitim tipovima ćelija. Dok je identificirano deset ljudskih gena koji kodiraju natrijeve kanale, njihova funkcija je obično konzervirana između vrsta i različitih tipova ćelija.[15]
Kalcijski (Ca2+) kanali[uredi | uredi izvor]
Sa šesnaest različitih identificiranih gena za ljudske kalcijske kanale, ovaj tip kanala se razlikuje u funkciji između tipova ćelija. Ca2+ kanali proizvode akcijski potencijal slično kao Na+ kanali u nekim neuronima. Također imaju ulogu u oslobađanju neurotransmitera u presinapsnim nervnim završecima. U većini ćelija, Ca2+ kanali regulišu širok spektar biohemijskih procesa zbog svoje uloge u kontroli unutarćelijkih koncentracija Ca2+.[11]
Kalijski (K+) kanali[uredi | uredi izvor]
Kalijski kanali su najveća i najraznovrsnija klasa naponsko vođenih kanala, kodirani sa preko 100 ljudskih gena. Ovi tipovi kanala se značajno razlikuju po svojstvima ulaza; neki se inaktiviraju izuzetno sporo, a drugi se inaktiviraju izuzetno brzo. Ova razlika u vremenu aktivacije utiče na trajanje i brzinu aktiviranja akcijskog potencijala, što ima značajan uticaj na električnu provodljivost duž aksona, kao i na sinapsni prijenos. Kalijski kanali se razlikuju po strukturi od ostalih kanala po tome što sadrže četiri odvojene polipeptidne podjedinice, dok ostali sadrže po četiri homologna domena ali na jednoj polipeptidnoj jedinici.[7]
Hloridni (Cl−) kanali[uredi | uredi izvor]
Hloridni kanali su prisutni u svim tipovima neurona. Uz glavnu odgovornost za kontrolu ekscitabilnosti, hloridni kanali doprinose održavanju ćelijskog potencijala mirovanja i pomažu u regulaciji volumena ćelije.[1]
Protonski (H+) kanali[uredi | uredi izvor]
Naponski-vođeni protonski kanali prenose struje posredovane vodikovih iona u obliku hidronija, i aktiviraju se depolarizacijom na pH-ovisan način. Djeluju tako da uklanjaju kiselinu iz ćelija.[16][17][18]
Filogenetika[uredi | uredi izvor]
Filogenetička istraživanja proteina eksprimiranih u bakterijama otkrila su postojanje natporodice naponskih natrijskih kanala.[19] Naknadne studije su pokazale da su različiti drugi ionski kanali i transporteri filogenetski povezani sa naponskim ionskim kanalima, uključujući unutrašnji ispravljački K+ kanali, rijanodin-inozitol 1,4,5-trifosfatni receptor Ca2+ kanala, prolaznoreceptorski potencijalni Ca2+ kanali, policistinski kationski kanali, glutamat ovisni ionski kanali, kalcij-ovisni hloridni kanali, monovalentni kation:protonski antiporteri, tip 1, i transporteri kalija.[20]
Također pogledajte[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ a b Purves D, Augustine GJ, Fitzpatrick D, Katz LC, LaMantia A, McNamara JO, Williams SM (2001). "Voltage-Gated Ion Channels". Neuroscience (2nd izd.). Sunderland, Mass: Sinauer Associates. ISBN 978-0-87893-742-4.
- ^ Catterall WA (april 2000). "From ionic currents to molecular mechanisms: the structure and function of voltage-gated sodium channels". Neuron (jezik: engleski). 26 (1): 13–25. doi:10.1016/S0896-6273(00)81133-2. PMID 10798388.
- ^ a b c d Bezanilla F (mart 2005). "Voltage-gated ion channels". IEEE Transactions on NanoBioscience. 4 (1): 34–48. doi:10.1109/tnb.2004.842463. PMID 15816170. S2CID 8212388.
- ^ a b Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). "Section 21.3, Molecular Properties of Voltage-Gated Ion Channels". Molecular Cell Biology (4th izd.). New York: Scientific American Books. ISBN 978-0-7167-3136-8.
- ^ Gulbis JM, Mann S, MacKinnon R (juni 1999). "Structure of a voltage-dependent K+ channel beta subunit". Cell. 97 (7): 943–52. doi:10.1016/s0092-8674(00)80805-3. PMID 10399921.
- ^ Catterall WA (2010). "Ion channel voltage sensors: structure, function, and pathophysiology". Neuron. 67 (6): 915–28. doi:10.1016/j.neuron.2010.08.021. PMC 2950829. PMID 20869590.
- ^ a b Sands Z, Grottesi A, Sansom MS (2005). "Voltage-gated ion channels". Current Biology. 15 (2): R44–7. doi:10.1016/j.cub.2004.12.050. PMID 15668152.
- ^ Murata Y, Iwasaki H, Sasaki M, Inaba K, Okamura Y (juni 2005). "Phosphoinositide phosphatase activity coupled to an intrinsic voltage sensor". Nature. 435 (7046): 1239–43. Bibcode:2005Natur.435.1239M. doi:10.1038/nature03650. PMID 15902207. S2CID 4427755.
- ^ Yellen G (august 1998). "The moving parts of voltage-gated ion channels". Quarterly Reviews of Biophysics. 31 (3): 239–95. doi:10.1017/s0033583598003448. PMID 10384687. S2CID 2605660.
- ^ Perozo E, Cortes DM, Cuello LG (juli 1999). "Structural rearrangements underlying K+-channel activation gating". Science. 285 (5424): 73–8. doi:10.1126/science.285.5424.73. PMID 10390363. S2CID 26775433.
- ^ a b Jiang Y, Lee A, Chen J, Cadene M, Chait BT, MacKinnon R (maj 2002). "Crystal structure and mechanism of a calcium-gated potassium channel". Nature. 417 (6888): 515–22. Bibcode:2002Natur.417..515J. doi:10.1038/417515a. PMID 12037559. S2CID 205029269.
- ^ Webster SM, Del Camino D, Dekker JP, Yellen G (april 2004). "Intracellular gate opening in Shaker K+ channels defined by high-affinity metal bridges". Nature. 428 (6985): 864–8. Bibcode:2004Natur.428..864W. doi:10.1038/nature02468. PMID 15103379. S2CID 1329210.
- ^ Armstrong CM (juli 1981). "Sodium channels and gating currents". Physiological Reviews. 61 (3): 644–83. doi:10.1152/physrev.1981.61.3.644. PMID 6265962.
- ^ Vassilev P, Scheuer T, Catterall WA (oktobar 1989). "Inhibition of inactivation of single sodium channels by a site-directed antibody". Proceedings of the National Academy of Sciences of the United States of America. 86 (20): 8147–51. Bibcode:1989PNAS...86.8147V. doi:10.1073/pnas.86.20.8147. PMC 298232. PMID 2554301.
- ^ a b Bénitah JP, Chen Z, Balser JR, Tomaselli GF, Marbán E (mart 1999). "Molecular dynamics of the sodium channel pore vary with gating: interactions between P-segment motions and inactivation". The Journal of Neuroscience. 19 (5): 1577–85. doi:10.1523/JNEUROSCI.19-05-01577.1999. PMC 6782169. PMID 10024345.
- ^ Cherny, V.V.; Markin, V.S.; DeCoursey, T.E. (1995), "The voltage-activated hydrogen ion conductance in rat alveolar epithelial cells is determined by the pH gradient", Journal of General Physiology (objavljeno juni 1995), 105 (6), str. 861–896, doi:10.1085/jgp.105.6.861, PMC 2216954, PMID 7561747
- ^ DeCoursey, T.E. (2003), "Voltage-gated proton channels and other proton transfer pathways", Physiological Reviews, 83 (2), str. 475–579, doi:10.1152/physrev.00028.2002, OCLC 205658168, PMID 12663866
- ^ Ramsey, I. Scott; Mokrab, Younes; Carvacho, Ingrid; Sands, Zara A.; Sansom, Mark S.P.; Clapham, David E. (2010). "An aqueous H+ permeation pathway in the voltage-gated proton channel Hv1". Nature Structural & Molecular Biology. 17 (7): 869–875. doi:10.1038/nsmb.1826. PMC 4035905. PMID 20543828.
- ^ Koishi R, Xu H, Ren D, Navarro B, Spiller BW, Shi Q, Clapham DE (mart 2004). "A superfamily of voltage-gated sodium channels in bacteria". The Journal of Biological Chemistry. 279 (10): 9532–8. doi:10.1074/jbc.M313100200. PMID 14665618.
- ^ Chang, Abraham B.; Lin, Ron; Studley, W. Keith; Tran, Can V.; Saier, Milton H., Jr. (2004). "Phylogeny as a guide to structure and function of membrane transport proteins". Mol Membr Biol. 21 (3): 171–181. doi:10.1080/09687680410001720830. PMID 15204625. S2CID 45284885.
Vanjski linkovi[uredi | uredi izvor]
- IUPHAR-DB Voltage-gated ion channel subunits Arhivirano 18. 1. 2021. na Wayback Machine
- The IUPHAR Compendium of Voltage-gated Ion Channels 2005 Arhivirano 2. 4. 2018. na Wayback Machine
- Voltage-Dependent Anion Channels na US National Library of Medicine Medical Subject Headings (MeSH)
