RAD51
RAD51 je eukariotski gen. Enzim kodiran ovim genom član je porodice proteina RAD51 koji pomaže u popravljanju dvolančanog prekida DNK. Članovi porodice RAD51 su homologni bakterijskom l RecA, a kod Archaea l RadA i Rad51 Saccharomyces cerevisiae.[4][5] Protein je visoko konzerviran u većini eukariota, od kvasca do ljudi.[6]
Aminokiselinska sekvenca[uredi | uredi izvor]
Dužina polipeptidnog lanca je 339 aminokiselina, a molekulska težina 36.966 Da.[7]
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MAMQMQLEAN | ADTSVEEESF | GPQPISRLEQ | CGINANDVKK | LEEAGFHTVE | ||||
| AVAYAPKKEL | INIKGISEAK | ADKILAEAAK | LVPMGFTTAT | EFHQRRSEII | ||||
| QITTGSKELD | KLLQGGIETG | SITEMFGEFR | TGKTQICHTL | AVTCQLPIDR | ||||
| GGGEGKAMYI | DTEGTFRPER | LLAVAERYGL | SGSDVLDNVA | YARAFNTDHQ | ||||
| TQLLYQASAM | MVESRYALLI | VDSATALYRT | DYSGRGELSA | RQMHLARFLR | ||||
| MLLRLADEFG | VAVVITNQVV | AQVDGAAMFA | ADPKKPIGGN | IIAHASTTRL | ||||
| YLRKGRGETR | ICKIYDSPCL | PEAEAMFAIN | ADGVGDAKD |
- Simboli
C: Cistein
D: Asparaginska kiselina
E: Glutaminska kiselina
F: Fenilalanin
G: Glicin
H: Histidin
I: Izoleucin
K: Lizin
L: Leucin
M: Metionin
N: Asparagin
P: Prolin
Q: Glutamin
R: Arginin
S: Serin
T: Treonin
V: Valin
W: Triptofan
Y: Tirozin
Varijante[uredi | uredi izvor]
Prijavljene su dvije alternativno prerađene varijante transkripta ovog gena, koje kodiraju različite proteine. Postoje varijante transkripta koji koriste alternativne poliA signale.
Porodica[uredi | uredi izvor]
U sisara je identifikovano sedam gena sličnih recA: Rad51, Rad51L1/B, Rad51L2/C, Rad51L3/D, XRCC2, XRCC3 i DMC1/Lim15.[8] Svi ovi proteini, osim DMC1 specifičnog za mejozu, neophodni su za razvoj sisara. Rad51 je član RecA-like NTPases.
Funkcija[uredi | uredi izvor]
Kod ljudi, RAD51 je 339-aminokiselinski protein koji ima glavnu ulogu u homolognoj rekombinaciji DNK tokom popravljanja dvostrukog lanca. U ovom se procesu odvija razmjena DNK lanca ovisna o ATP-u u kojoj matrica lanca napada invadirane nizove homolognih molekula DNK. RAD51 je uključen u potragu za homologijom i fazama uparivanja niti.
Za razliku od ostalih proteina koji su uključeni u metabolizam DNK, porodica RecA/Rad51 stvara spiralni nukleoproteinski filament na DNK-u.[9]
Ovaj protein može stupiti u interakciju s ssDNK-vezujućim proteinom RPA, BRCA2, PALB2[10] i RAD52.
Strukturna osnova za stvaranje filamenta Rad51 i njegov funkcionalni mehanizam i dalje su slabo razumljivi. Međutim, nedavna istraživanja koja su koristila fluorescentno označenu Rad51,[11] ukazala su da se fragmenti Rad51 izdužuju višestrukim nukleacijskim događajima praćenim rastom, a ukupni fragment završava kada dostigne oko 2 μm dužine. Međutim, razdvajanje Rad51 od dsDNA je sporo i nepotpuno, što sugerira da postoji zaseban mehanizam koji to postiže.
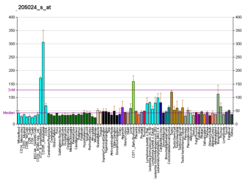
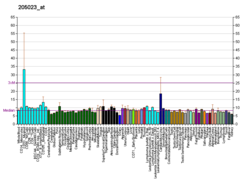
Ekspresija RAD51 u kanceru[uredi | uredi izvor]
U eukariotima, protein RAD51 ima središnju ulogu u homolognom rekombinacijskom popravku. RAD51 katalizira prijenos lanaca između oštećene sekvence i njenog neoštećenog homologa kako bi omogućio ponovnu sintezu oštećenog područja (vidi homologni rekombinacijski modeli).
Brojne studije pokazuju da je RAD51 prekomjerno eksprimiran kod različitih karcinoma (vidi Tabelu 1). U mnogim od ovih studija, povišena ekspresija RAD51 korelira sa smanjenim preživljavanjem pacijenta. Postoje i izvještaji o nedovoljnoj ekspresiji RAD51 kod karcinoma (vidi Tabelu 1).
Tamo gdje je zabilježena ekspresija RAD51, zajedno s ekspresijom BRCA1, pronađena je inverzna korelacija.[12][13] Ovo je protumačeno kao selekcija za povećanu ekspresiju RAD51 i time povećanu homolognu rekombinacijsku popravku (HRR) (pomoću HRR RAD52-RAD51 rezervnog puta[14]) da nadoknadi dodano oštećenje DNK preostalo kada je nedostajao BRCA1.[12][13][15]
Mnogi karcinomi imaju epigenetičke nedostatke u različitim genima za obnavljanje DNK, što vjerovatno uzrokuje povećanu pojavu nepopravljene oštećenja DNA. Prekomjerna ekspresija RAD51 viđena kod mnogih karcinoma može odražavati kompenzacijsku prekomjernu ekspresiju RAD51 (kao kod nedostatka BRCA1) i povećani HRR, da bi se barem djelimično riješio takvog viška oštećenja DNK.
Nedovoljno eksprimiranje RAD51 samo bi po sebi povećalo oštećenja bez popravljanja DNK. Greške replikacije nakon ovih oštećenja (vidi Sintska translezija), dovele bi do povećanih mutacija i raka.
| Kancer | Nad– ili podekspresija | Učestalost promijenjenih ekspresija | Metod procjene | Referance |
|---|---|---|---|---|
| Rak dojke (invazivni duktusni) | Nadekspresija | – | Imunohistohemija | [12] |
| Rak dojke (BRCA1-deficijentni) | Nadekspresija | – | iRNK | [13] |
| Rak dojke (negativan za progesteronski receptor) | Nadekspresija | – | iRNK | [16] |
| Rak dojke | Podekspresija | 30% | Imunohistohemija | [17] |
| Rak gušterače | Nadekspresija | 74% | Imunohistohemija | [18] |
| Rak gušterače | Nadekspresija | 66% | Imunohistohemija | [19] |
| Kanceri glave i vrata | Nadekspresija | 75% | Imunohistohemija | [20] |
| Rak prostate | Nadekspresija | 33% | Imunohistohemija | [21] |
| Plućni rak ne malih ćelija | Nadekspresija | 29% | Imunohistohemija | [22] |
| Sarkom mehkog tkiva | Nadekspresija | 95% | Imunohistohemija | [23] |
| Kancer jednjačkih pločastih ćelija | Nadekspresija | 47% | Imunohistohemija | [24] |
| Karcinom bubrežnih ćelija | Podekspresija | 100% | Proteinski Western blot , iRNK | [25] |
U popravku dvostrukog prekida[uredi | uredi izvor]
U popravaku dvostrukog prekida (DSB) homologna rekombinacija započinje resekcijom 5' do 3' lanaca. Kod ljudi, nukleaza DNA2 presijeca 5'-do-3' lanac na DSB da bi stvorila 3' jednolančana presavijena nit DNK[26][27]
Određeni broj paraloga (vidi sliku) RAD51 ključni su za regrutovanje ili stabilizaciju proteina RAD51 na mjestima oštećenja DNk kod kičmenjaka.

U kičmenjacima i biljkama, pet Homologija sekvence paraloga RAD51 eksprimirano je u somatskim ćelijama, uključujući RAD51B (RAD51L1), RAD51C (RAD51L2), RAD51D (RAD51L3 ), XRCC2 i XRCC3. Svaki od njih dijeli oko 25% identiteta aminokiselinskih sekvenci sa RAD51 i međusobno.[28]
Izvan biljaka i kičmenjaka postoji mnogo šira raznolikost proteina para51, rekombinaza para51. U pupajućem kvascu, Saccharomyces cerevisiae prisutni su paralozi Rad55 i Rad57, koji čine kompleks koji asocira na kvaščev Rad51 na ssDNK Rekombinazni paralog rfs-1 nalazi se u obloj glisti Caenorhabditis elegans (modelni organizam), gdje nije bitna za homolognu rekombinaciju. Među arheja parabole za rekombinazu RadB i RadC nalaze se u mnogim organizmima koji pripadaju Euryarchaeota, dok se čini da je veća raznolikost srodnih paraloga za rekombinazu pronađena u Crenarchaea uključujući Ral1, Ral2, Ral3, RadC, RadC1, i RadC2.
Paralozi RAD51 doprinose efikasnom popravljanju dvostruko lanca DNK homologna rekombinacija, a iscrpljivanje bilo kojeg paraloga često rezultira značajnim smanjenjem učestalosti homologne rekombinacije.[29]
Paralozi tvore dva identificirana kompleksa: BCDX2 (RAD51B-RAD51C-RAD51D-XRCC2) i CX3 (RAD51C-XRCC3). Ova dva kompleksa djeluju u dvije različite faze homologne rekombinacije popravljanja DNK. Kompleks BCDX2 odgovoran je za regrutovanje ili stabilizaciju RAD51 na mjestima oštećenja.[29] Čini se da kompleks BCDX2 djeluje olakšavajući sklop ili stabilnost RAD51 nukleoproteinski filament. Kompleks CX3 djeluje nizvodno od regrutacije RAD51 da ošteti mjesta.[29]
Još jedan kompleks, BRCA1 – PALB2 – BRCA2 kompleks i RAD51 paralozi sarađuju kako bi učitali RAD51 na ssDNK presvučenu sa RPA kako bi stvorili esencijalni rekombinacioni intermedijer, žarišna nit RAD51-ssDNK[30]
U miševa i ljudi, kompleks BRCA2 prvenstveno posreduje u urednom sastavljanju RAD51 na ssDNK, obliku koji je aktivan za homologno uparivanje i invaziju lanaca.[31] BRCA2 also redirects RAD51 from dsDNA and prevents dissociation from ssDNA.[31] Međutim, u prisustvu mutacije BRCA2, čovjekov RAD52 može posredovati sklop RAD51 na ssDNK i zamijeniti BRCA2 u homolognoj rekombinacijskoj popravci DNK,[32] mada sa nižom efikasnošću od BRCA2.
Daljnji koraci detaljno su opisani u članku Homologna rekombinacija.
Mejoza[uredi | uredi izvor]
Rad51 ima ključnu funkciju u mejotskoj profazi kod miševa i njegov gubitak dovodi do iscrpljenja kasne profaze I spermatocita.[33]
Tokom mejoze, dvije rekombinaze, Rad51 i Dmc1, međusobno djeluju s jednolančanom DNK formirajući specijalizirane filamente koji su prilagođeni za olakšavanje rekombinacija između homolognih hromozoma . I Rad51 i Dmc1 imaju suštinsku sposobnost samoagregacije.[34] Prisustvo Dmc1 stabilizira susjedne niti Rad51 sugerirajući da unakrsni odgovor između ove dvije rekombinaze može uticati na njihova biohemijska svojstva.
Hemoterapija i starenje[uredi | uredi izvor]
U starijih i hemoterapijom tretiranih žena, oociti i folikule iscrpljeni su apoptozom (programirana ćelijska smrt) što dovodi do otkazivanja jajnika. Apoptoza oocita izazvana oštećenjem DNK zavisi od efikasnosti mehanizma popravka DNK, koji opada s godinama. Preživljavanje jajnih ćelija nakon hemoterapije ili starenja može se poboljšati povećanom ekspresijom Rad51.[35] Otpornost oocita na apoptozu, inducirana Rad51 vjerojatno je posljedica središnje uloge Rad51 u homolognoj rekombinaciji i saniranju oštećenja DNK.
MikroRNK kontrola ekspresije RAD51[uredi | uredi izvor]
U sisara, mikroRNK (miRNK) regulišu oko 60% transkripcijske aktivnosti gena koji kodiraju proteine.[36] Neke miRNK također prolaze kroz utišavanje povezano sa metilacijom u ćelijama karcinoma.[37][38] Ako se represivna miRNK utiša hipermetilacijom ili delecijom, tada gen koji cilja postaje prekomjerno eksprimiran.
Identificirano je najmanje osam miRNK koje potiskuju ekspresiju RAD51 , a čini se da je pet od njih važno za rak. Naprimjer, kod trostrukog negativnog karcinoma dojke (TNBC), dolazi do prekomjerne ekspresije miR-155, zajedno sa represijom prema "RAD51".[39] Dalji testovi su direktno pokazali da transfekcija ćelija raka dojke vektorom koji prekomjerno eksprimira miR-155 potiskuje RAD51, uzrokujući smanjenu homolognu rekombinaciju i povećanu osetljivost na ionizirajuće zračenje.[39]
Još četiri miRNK koje potiskuju RAD51 (miR-148b * i miR-193b*,[40] miR-506,[41] i miR-34a[42]) su podeksprimirani u kancerima, što bi moglo dovesti do indukcije RAD51.
Podekspresija miR-148b* i miR-193b* inducira uočenu ekspresiju RAD51.[40] Deletions of 148b* and miR-193b* in serous ovarian tumors correlate with increased incidences of (possibly carcinogenic) losses of heterozygosity (LOH). This excess LOH was thought to be due to excess recombination caused by induced expression of RAD51.[40]
Premala ekspresija miR-506 povezana je s ranim periodom pojave recidiva (i smanjenim preživljavanjem) kod pacijenata sa epitelnim karcinomom jajnika.[43]
Metilacija promotora miR-34a, rezultira podekspresijom miR-34a, uočenom u 79% karcinoma prostate i 63% primarnih melanoma.[44] > Niže izraženi nivoi miR-34a također se javljaju u 63% karcinoma pluća nemalih ćelija[45] i 36% rakova debelog crijava.[46] miR-34a je također općenito podeksprimiran u primarnim tumorima neuroblastoma.[47]
Tabela 2 sažima ovih pet mikroRNK, njihovu prekomjernu ili premalu ekspresiju i karcinome kod kojih je zabilježeno da se javlja njihova promijenjena ekspresija.
| MiKroRNK | Nad/Podekspresija miRNK | Kancer | Reference |
|---|---|---|---|
| miR-155 | Nadekspresija | Tronegativni rak dojke | [39] |
| miR-148b* | Podekspresija | Rak jajnika | [40] |
| miR-193b* | Podekspresija | Rak jajnika | [40] |
| miR-506 | Podekspresija | Rak jajnika | [43] |
| miR-34a | Podekspresija | Rak prostate, Melanom | [44] |
| Rak pluća ne malih ćelija | [45] | ||
| Rak debelog crijeva | [46] | ||
| Neuroblastom | [47] |
Podaci sažeti u Tabeli 2 sugeriraju da se podekspresija mikroRNK (uzrokujući indukciju RAD51) često javlja kod karcinoma. Čini se da je nadekspresija mikroRNK koja uzrokuje potiskivanje RAD51 rjeđa. Podaci u Tabeli 1 (gore) ukazuju da je općenito prekomjerna ekspresija RAD51 češća kod karcinoma nego podekspresija.
Identificirane su i tri druge mikroRNK, prema različitim kriterijima, kao vjerovatne da potiskuju RAD51 (miR-96,[48] miR-203,[49] and miR-103/107[50]). Zatim su ove mikroRNK testirane nadekspresijom u ćelijama in vitro i utvrđeno je da zaista potiskuju RAD51 . Ova represija uglavnom je bila povezana sa smanjenim HR i povećanom osetljivošću ćelija na agense koji oštećuju DNK.
Patologija[uredi | uredi izvor]
Utvrđeno je i da ovaj protein komunicira sa PALB2 [10] i BRCA2, što može biti važno za ćelijski odgovor na oštećenje DNK. Pokazano je da BRCA2 regulira i unutarćelijsku lokalizaciju i sposobnost vezivanja DNK ovog proteina. Gubitak ovih kontrola nakon inaktivacije BRCA2 može biti ključni događaj koji dovodi do genomske nestabilnosti i tumorigeneze.[51]
Nekoliko izmjena gena Rad51 povezano je s povećanim rizikom od razvoja karcinoma dojke. Proteini osjetljivosti na rak dojke BRCA2 i PALB2 kontroliraju funkciju Rad51 na putu za popravka DNK homolognom rekombinacijom.[10][52] Pored podataka navedenih u Tabeli 1, identificirani su povećani nivoi ekspresije RAD51 u metastatskom karcinomu mliječnih žlijezda pasa, što ukazuje da genomska nestabilnost ima važnu ulogu u karcinogenezi ovog tipa tumora.[53][54][55][56]
Fanconijeva anemija[uredi | uredi izvor]
Fanconijeva anemija (FA) je nasljedni poremećaj koji karakterizira ćelijska preosjetljivost na agense za umrežavanje DNK. Izvješteno je da dominantna negativnia mutacija u genu Rad51 dovodi do FA fenotipa sa karakteristikama mentalna retardacija|mentalne retardacije.[57][58] Ovaj izvještaj uključuje dokaze da Rad 51 posredovana homologna rekombinacija popravka vjerovatno ima važnu ulogu u neurorazviću.
Interakcije[uredi | uredi izvor]
Pokazano je da RAD51 ima interakcije sa:
Reference[uredi | uredi izvor]
- ^ a b c GRCh38: Ensembl release 89: ENSG00000051180 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Shinohara A, Ogawa H, Ogawa T (maj 1992). "Rad51 protein involved in repair and recombination in S. cerevisiae is a RecA-like protein". Cell. 69 (3): 457–70. doi:10.1016/0092-8674(92)90447-K. PMID 1581961.
- ^ Seitz EM, Brockman JP, Sandler SJ, Clark AJ, Kowalczykowski SC (maj 1998). "RadA protein is an archaeal RecA protein homolog that catalyzes DNA strand exchange". Genes & Development. 12 (9): 1248–53. doi:10.1101/gad.12.9.1248. PMC 316774. PMID 9573041.
- ^ Shinohara A, Ogawa H, Matsuda Y, Ushio N, Ikeo K, Ogawa T (juli 1993). "Cloning of human, mouse and fission yeast recombination genes homologous to RAD51 and recA". Nature Genetics. 4 (3): 239–43. doi:10.1038/ng0793-239. PMID 8358431.
- ^ "UniProt, Q06609". Pristupljeno 17. 7. 2021.
- ^ Kawabata M, Kawabata T, Nishibori M (februar 2005). "Role of recA/RAD51 family proteins in mammals". Acta Medica Okayama. 59 (1): 1–9. doi:10.18926/AMO/31987. PMID 15902993.
- ^ Galkin VE, Wu Y, Zhang XP, Qian X, He Y, Yu X, Heyer WD, Luo Y, Egelman EH (juni 2006). "The Rad51/RadA N-terminal domain activates nucleoprotein filament ATPase activity". Structure. 14 (6): 983–92. doi:10.1016/j.str.2006.04.001. PMID 16765891.
- ^ a b c Buisson R, Dion-Côté AM, Coulombe Y, Launay H, Cai H, Stasiak AZ, Stasiak A, Xia B, Masson JY (oktobar 2010). "Cooperation of breast cancer proteins PALB2 and piccolo BRCA2 in stimulating homologous recombination". Nature Structural & Molecular Biology. 17 (10): 1247–54. doi:10.1038/nsmb.1915. PMC 4094107. PMID 20871615.
- ^ Hilario J, Amitani I, Baskin RJ, Kowalczykowski SC (januar 2009). "Direct imaging of human Rad51 nucleoprotein dynamics on individual DNA molecules". Proceedings of the National Academy of Sciences of the United States of America. 106 (2): 361–8. doi:10.1073/pnas.0811965106. PMC 2613362. PMID 19122145.
- ^ a b c Maacke H, Opitz S, Jost K, Hamdorf W, Henning W, Krüger S, Feller AC, Lopens A, Diedrich K, Schwinger E, Stürzbecher HW (decembar 2000). "Over-expression of wild-type Rad51 correlates with histological grading of invasive ductal breast cancer". International Journal of Cancer. 88 (6): 907–13. doi:10.1002/1097-0215(20001215)88:6<907::aid-ijc11>3.0.co;2-4. PMID 11093813.
- ^ a b c Martin RW, Orelli BJ, Yamazoe M, Minn AJ, Takeda S, Bishop DK (oktobar 2007). "RAD51 up-regulation bypasses BRCA1 function and is a common feature of BRCA1-deficient breast tumors". Cancer Research. 67 (20): 9658–65. doi:10.1158/0008-5472.CAN-07-0290. PMID 17942895.
- ^ Lok BH, Carley AC, Tchang B, Powell SN (juli 2013). "RAD52 inactivation is synthetically lethal with deficiencies in BRCA1 and PALB2 in addition to BRCA2 through RAD51-mediated homologous recombination". Oncogene. 32 (30): 3552–8. doi:10.1038/onc.2012.391. PMC 5730454. PMID 22964643.
- ^ Klein HL (maj 2008). "The consequences of Rad51 overexpression for normal and tumor cells". DNA Repair. 7 (5): 686–93. doi:10.1016/j.dnarep.2007.12.008. PMC 2430071. PMID 18243065.
- ^ Barbano R, Copetti M, Perrone G, Pazienza V, Muscarella LA, Balsamo T, Storlazzi CT, Ripoli M, Rinaldi M, Valori VM, Latiano TP, Maiello E, Stanziale P, Carella M, Mangia A, Pellegrini F, Bisceglia M, Muda AO, Altomare V, Murgo R, Fazio VM, Parrella P (august 2011). "High RAD51 mRNA expression characterize estrogen receptor-positive/progesteron receptor-negative breast cancer and is associated with patient's outcome". International Journal of Cancer. 129 (3): 536–45. doi:10.1002/ijc.25736. PMID 21064098.
- ^ Yoshikawa K, Ogawa T, Baer R, Hemmi H, Honda K, Yamauchi A, Inamoto T, Ko K, Yazumi S, Motoda H, Kodama H, Noguchi S, Gazdar AF, Yamaoka Y, Takahashi R (oktobar 2000). "Abnormal expression of BRCA1 and BRCA1-interactive DNA-repair proteins in breast carcinomas". International Journal of Cancer. 88 (1): 28–36. doi:10.1002/1097-0215(20001001)88:1<28::aid-ijc5>3.0.co;2-4. PMID 10962436.
- ^ Han H, Bearss DJ, Browne LW, Calaluce R, Nagle RB, Von Hoff DD (maj 2002). "Identification of differentially expressed genes in pancreatic cancer cells using cDNA microarray". Cancer Research. 62 (10): 2890–6. PMID 12019169.
- ^ Maacke H, Jost K, Opitz S, Miska S, Yuan Y, Hasselbach L, Lüttges J, Kalthoff H, Stürzbecher HW (maj 2000). "DNA repair and recombination factor Rad51 is over-expressed in human pancreatic adenocarcinoma". Oncogene. 19 (23): 2791–5. doi:10.1038/sj.onc.1203578. PMID 10851081.
- ^ Connell PP, Jayathilaka K, Haraf DJ, Weichselbaum RR, Vokes EE, Lingen MW (maj 2006). "Pilot study examining tumor expression of RAD51 and clinical outcomes in human head cancers". International Journal of Oncology. 28 (5): 1113–9. doi:10.3892/ijo.28.5.1113. PMID 16596227.
- ^ Mitra A, Jameson C, Barbachano Y, Sanchez L, Kote-Jarai Z, Peock S, Sodha N, Bancroft E, Fletcher A, Cooper C, Easton D, Eeles R, Foster CS (decembar 2009). "Overexpression of RAD51 occurs in aggressive prostatic cancer". Histopathology. 55 (6): 696–704. doi:10.1111/j.1365-2559.2009.03448.x. PMC 2856636. PMID 20002770.
- ^ Qiao GB, Wu YL, Yang XN, Zhong WZ, Xie D, Guan XY, Fischer D, Kolberg HC, Kruger S, Stuerzbecher HW (juli 2005). "High-level expression of Rad51 is an independent prognostic marker of survival in non-small-cell lung cancer patients". British Journal of Cancer. 93 (1): 137–43. doi:10.1038/sj.bjc.6602665. PMC 2361489. PMID 15956972.
- ^ Hannay JA, Liu J, Zhu QS, Bolshakov SV, Li L, Pisters PW, Lazar AJ, Yu D, Pollock RE, Lev D (maj 2007). "Rad51 overexpression contributes to chemoresistance in human soft tissue sarcoma cells: a role for p53/activator protein 2 transcriptional regulation". Molecular Cancer Therapeutics. 6 (5): 1650–60. doi:10.1158/1535-7163.MCT-06-0636. PMID 17513613.
- ^ Li Y, Yu H, Luo RZ, Zhang Y, Zhang MF, Wang X, Jia WH (novembar 2011). "Elevated expression of Rad51 is correlated with decreased survival in resectable esophageal squamous cell carcinoma". Journal of Surgical Oncology. 104 (6): 617–22. doi:10.1002/jso.22018. PMID 21744352.
- ^ Liu S, Li Y, Xu H, Wang K, Li N, Li J, Sun T, Xu Y (juli 2016). "Increased expression of SET domain-containing proteins and decreased expression of Rad51 in different classes of renal cell carcinoma". Bioscience Reports. 36 (3): e00349. doi:10.1042/BSR20160122. PMC 5293581. PMID 27170370.
- ^ Hoa NN, Akagawa R, Yamasaki T, Hirota K, Sasa K, Natsume T, Kobayashi J, Sakuma T, Yamamoto T, Komatsu K, Kanemaki MT, Pommier Y, Takeda S, Sasanuma H (decembar 2015). "Relative contribution of four nucleases, CtIP, Dna2, Exo1 and Mre11, to the initial step of DNA double-strand break repair by homologous recombination in both the chicken DT40 and human TK6 cell lines". Genes to Cells. 20 (12): 1059–76. doi:10.1111/gtc.12310. PMID 26525166.
- ^ Hoa NN, Kobayashi J, Omura M, Hirakawa M, Yang SH, Komatsu K, Paull TT, Takeda S, Sasanuma H (2015). "BRCA1 and CtIP Are Both Required to Recruit Dna2 at Double-Strand Breaks in Homologous Recombination". PLOS One. 10 (4): e0124495. doi:10.1371/journal.pone.0124495. PMC 4409214. PMID 25909997.
- ^ Miller KA, Sawicka D, Barsky D, Albala JS (2004). "Domain mapping of the Rad51 paralog protein complexes". Nucleic Acids Research. 32 (1): 169–78. doi:10.1093/nar/gkg925. PMC 373258. PMID 14704354.
- ^ a b c Chun J, Buechelmaier ES, Powell SN (januar 2013). "Rad51 paralog complexes BCDX2 and CX3 act at different stages in the BRCA1-BRCA2-dependent homologous recombination pathway". Molecular and Cellular Biology. 33 (2): 387–95. doi:10.1128/MCB.00465-12. PMC 3554112. PMID 23149936.
- ^ Prakash R, Zhang Y, Feng W, Jasin M (april 2015). "Homologous recombination and human health: the roles of BRCA1, BRCA2, and associated proteins". Cold Spring Harbor Perspectives in Biology. 7 (4): a016600. doi:10.1101/cshperspect.a016600. PMC 4382744. PMID 25833843.
- ^ a b Holloman WK (juli 2011). "Unraveling the mechanism of BRCA2 in homologous recombination". Nature Structural & Molecular Biology. 18 (7): 748–54. doi:10.1038/nsmb.2096. PMC 3647347. PMID 21731065.
- ^ Feng Z, Scott SP, Bussen W, Sharma GG, Guo G, Pandita TK, Powell SN (januar 2011). "Rad52 inactivation is synthetically lethal with BRCA2 deficiency". Proceedings of the National Academy of Sciences of the United States of America. 108 (2): 686–91. doi:10.1073/pnas.1010959107. PMC 3021033. PMID 21148102.
- ^ Dai J, Voloshin O, Potapova S, Camerini-Otero RD (februar 2017). "Meiotic Knockdown and Complementation Reveals Essential Role of RAD51 in Mouse Spermatogenesis". Cell Reports. 18 (6): 1383–1394. doi:10.1016/j.celrep.2017.01.024. PMC 5358547. PMID 28178517.
- ^ Crickard JB, Kaniecki K, Kwon Y, Sung P, Greene EC (mart 2018). "Spontaneous self-segregation of Rad51 and Dmc1 DNA recombinases within mixed recombinase filaments". The Journal of Biological Chemistry. 293 (11): 4191–4200. doi:10.1074/jbc.RA117.001143. PMC 5858004. PMID 29382724.
- ^ Kujjo LL, Laine T, Pereira RJ, Kagawa W, Kurumizaka H, Yokoyama S, Perez GI (februar 2010). "Enhancing survival of mouse oocytes following chemotherapy or aging by targeting Bax and Rad51". PLOS One. 5 (2): e9204. doi:10.1371/journal.pone.0009204. PMC 2820548. PMID 20169201.
- ^ Friedman RC, Farh KK, Burge CB, Bartel DP (januar 2009). "Most mammalian mRNAs are conserved targets of microRNAs". Genome Research. 19 (1): 92–105. doi:10.1101/gr.082701.108. PMC 2612969. PMID 18955434.
- ^ Saito Y, Liang G, Egger G, Friedman JM, Chuang JC, Coetzee GA, Jones PA (juni 2006). "Specific activation of microRNA-127 with downregulation of the proto-oncogene BCL6 by chromatin-modifying drugs in human cancer cells". Cancer Cell. 9 (6): 435–43. doi:10.1016/j.ccr.2006.04.020. PMID 16766263.
- ^ Lujambio A, Ropero S, Ballestar E, Fraga MF, Cerrato C, Setién F, Casado S, Suarez-Gauthier A, Sanchez-Cespedes M, Git A, Gitt A, Spiteri I, Das PP, Caldas C, Miska E, Esteller M (februar 2007). "Genetic unmasking of an epigenetically silenced microRNA in human cancer cells". Cancer Research. 67 (4): 1424–9. doi:10.1158/0008-5472.CAN-06-4218. PMID 17308079.
- ^ a b c Gasparini P, Lovat F, Fassan M, Casadei L, Cascione L, Jacob NK, Carasi S, Palmieri D, Costinean S, Shapiro CL, Huebner K, Croce CM (mart 2014). "Protective role of miR-155 in breast cancer through RAD51 targeting impairs homologous recombination after irradiation". Proceedings of the National Academy of Sciences of the United States of America. 111 (12): 4536–41. doi:10.1073/pnas.1402604111. PMC 3970505. PMID 24616504.
- ^ a b c d e Choi YE, Pan Y, Park E, Konstantinopoulos P, De S, D'Andrea A, Chowdhury D (april 2014). "MicroRNAs down-regulate homologous recombination in the G1 phase of cycling cells to maintain genomic stability". eLife. 3: e02445. doi:10.7554/eLife.02445. PMC 4031983. PMID 24843000.
- ^ Liu G, Xue F, Zhang W (septembar 2015). "miR-506: a regulator of chemo-sensitivity through suppression of the RAD51-homologous recombination axis". Chinese Journal of Cancer. 34 (11): 485–7. doi:10.1186/s40880-015-0049-z. PMC 4593343. PMID 26369335.
- ^ Cortez MA, Valdecanas D, Niknam S, Peltier HJ, Diao L, Giri U, Komaki R, Calin GA, Gomez DR, Chang JY, Heymach JV, Bader AG, Welsh JW (decembar 2015). "In Vivo Delivery of miR-34a Sensitizes Lung Tumors to Radiation Through RAD51 Regulation". Molecular Therapy. Nucleic Acids. 4: e270. doi:10.1038/mtna.2015.47. PMC 5014539. PMID 26670277.
- ^ a b Liu G, Yang D, Rupaimoole R, Pecot CV, Sun Y, Mangala LS, Li X, Ji P, Cogdell D, Hu L, Wang Y, Rodriguez-Aguayo C, Lopez-Berestein G, Shmulevich I, De Cecco L, Chen K, Mezzanzanica D, Xue F, Sood AK, Zhang W (juli 2015). "Augmentation of response to chemotherapy by microRNA-506 through regulation of RAD51 in serous ovarian cancers". Journal of the National Cancer Institute. 107 (7): djv108. doi:10.1093/jnci/djv108. PMC 4554255. PMID 25995442.
- ^ a b Lodygin D, Tarasov V, Epanchintsev A, Berking C, Knyazeva T, Körner H, Knyazev P, Diebold J, Hermeking H (august 2008). "Inactivation of miR-34a by aberrant CpG methylation in multiple types of cancer". Cell Cycle. 7 (16): 2591–600. doi:10.4161/cc.7.16.6533. PMID 18719384.
- ^ a b Wiggins JF, Ruffino L, Kelnar K, Omotola M, Patrawala L, Brown D, Bader AG (juli 2010). "Development of a lung cancer therapeutic based on the tumor suppressor microRNA-34". Cancer Research. 70 (14): 5923–30. doi:10.1158/0008-5472.CAN-10-0655. PMC 2913706. PMID 20570894.
- ^ a b Tazawa H, Tsuchiya N, Izumiya M, Nakagama H (septembar 2007). "Tumor-suppressive miR-34a induces senescence-like growth arrest through modulation of the E2F pathway in human colon cancer cells". Proceedings of the National Academy of Sciences of the United States of America. 104 (39): 15472–7. doi:10.1073/pnas.0707351104. PMC 2000550. PMID 17875987.
- ^ a b Welch C, Chen Y, Stallings RL (juli 2007). "MicroRNA-34a functions as a potential tumor suppressor by inducing apoptosis in neuroblastoma cells". Oncogene. 26 (34): 5017–22. doi:10.1038/sj.onc.1210293. PMID 17297439.
- ^ Wang Y, Huang JW, Calses P, Kemp CJ, Taniguchi T (august 2012). "MiR-96 downregulates REV1 and RAD51 to promote cellular sensitivity to cisplatin and PARP inhibition". Cancer Research. 72 (16): 4037–46. doi:10.1158/0008-5472.CAN-12-0103. PMC 3421071. PMID 22761336.
- ^ Chang JH, Hwang YH, Lee DJ, Kim DH, Park JM, Wu HG, Kim IA (februar 2016). "MicroRNA-203 Modulates the Radiation Sensitivity of Human Malignant Glioma Cells". International Journal of Radiation Oncology, Biology, Physics. 94 (2): 412–20. doi:10.1016/j.ijrobp.2015.10.001. PMID 26678661.
- ^ Huang JW, Wang Y, Dhillon KK, Calses P, Villegas E, Mitchell PS, Tewari M, Kemp CJ, Taniguchi T (decembar 2013). "Systematic screen identifies miRNAs that target RAD51 and RAD51D to enhance chemosensitivity". Molecular Cancer Research. 11 (12): 1564–73. doi:10.1158/1541-7786.MCR-13-0292. PMC 3869885. PMID 24088786.
- ^ Daniel DC (oktobar 2002). "Highlight: BRCA1 and BRCA2 proteins in breast cancer". Microscopy Research and Technique. 59 (1): 68–83. doi:10.1002/jemt.10178. PMID 12242698.
- ^ a b Pellegrini L, Yu DS, Lo T, Anand S, Lee M, Blundell TL, Venkitaraman AR (novembar 2002). "Insights into DNA recombination from the structure of a RAD51-BRCA2 complex". Nature. 420 (6913): 287–93. doi:10.1038/nature01230. PMID 12442171.
- ^ Klopfleisch R, von Euler H, Sarli G, Pinho SS, Gärtner F, Gruber AD (januar 2011). "Molecular carcinogenesis of canine mammary tumors: news from an old disease". Veterinary Pathology. 48 (1): 98–116. doi:10.1177/0300985810390826. PMID 21149845.
- ^ Klopfleisch R, Gruber AD (maj 2009). "Increased expression of BRCA2 and RAD51 in lymph node metastases of canine mammary adenocarcinomas". Veterinary Pathology. 46 (3): 416–22. doi:10.1354/vp.08-VP-0212-K-FL. PMID 19176491.
- ^ Klopfleisch R, Schütze M, Gruber AD (januar 2010). "RAD51 protein expression is increased in canine mammary carcinomas". Veterinary Pathology. 47 (1): 98–101. doi:10.1177/0300985809353310. PMID 20080488.
- ^ Klopfleisch R, Klose P, Gruber AD (maj 2010). "The combined expression pattern of BMP2, LTBP4, and DERL1 discriminates malignant from benign canine mammary tumors". Veterinary Pathology. 47 (3): 446–54. doi:10.1177/0300985810363904. PMID 20375427.
- ^ Wang AT, Kim T, Wagner JE, Conti BA, Lach FP, Huang AL, et al. (august 2015). "A Dominant Mutation in Human RAD51 Reveals Its Function in DNA Interstrand Crosslink Repair Independent of Homologous Recombination". Molecular Cell. 59 (3): 478–90. doi:10.1016/j.molcel.2015.07.009. PMC 4529964. PMID 26253028.
- ^ Ameziane N, May P, Haitjema A, van de Vrugt HJ, van Rossum-Fikkert SE, Ristic D, Williams GJ, Balk J, Rockx D, Li H, Rooimans MA, Oostra AB, Velleuer E, Dietrich R, Bleijerveld OB, Maarten Altelaar AF, Meijers-Heijboer H, Joenje H, Glusman G, Roach J, Hood L, Galas D, Wyman C, Balling R, den Dunnen J, de Winter JP, Kanaar R, Gelinas R, Dorsman JC (decembar 2015). "A novel Fanconi anaemia subtype associated with a dominant-negative mutation in RAD51". Nature Communications. 6: 8829. doi:10.1038/ncomms9829. PMC 4703882. PMID 26681308.
- ^ a b c Chen G, Yuan SS, Liu W, Xu Y, Trujillo K, Song B, Cong F, Goff SP, Wu Y, Arlinghaus R, Baltimore D, Gasser PJ, Park MS, Sung P, Lee EY (april 1999). "Radiation-induced assembly of Rad51 and Rad52 recombination complex requires ATM and c-Abl". The Journal of Biological Chemistry. 274 (18): 12748–52. doi:10.1074/jbc.274.18.12748. PMID 10212258.
- ^ a b c d e f Dong Y, Hakimi MA, Chen X, Kumaraswamy E, Cooch NS, Godwin AK, Shiekhattar R (novembar 2003). "Regulation of BRCC, a holoenzyme complex containing BRCA1 and BRCA2, by a signalosome-like subunit and its role in DNA repair". Molecular Cell. 12 (5): 1087–99. doi:10.1016/s1097-2765(03)00424-6. PMID 14636569.
- ^ a b Chen J, Silver DP, Walpita D, Cantor SB, Gazdar AF, Tomlinson G, Couch FJ, Weber BL, Ashley T, Livingston DM, Scully R (septembar 1998). "Stable interaction between the products of the BRCA1 and BRCA2 tumor suppressor genes in mitotic and meiotic cells". Molecular Cell. 2 (3): 317–28. doi:10.1016/s1097-2765(00)80276-2. PMID 9774970.
- ^ Scully R, Chen J, Plug A, Xiao Y, Weaver D, Feunteun J, Ashley T, Livingston DM (januar 1997). "Association of BRCA1 with Rad51 in mitotic and meiotic cells". Cell. 88 (2): 265–75. doi:10.1016/s0092-8674(00)81847-4. PMID 9008167.
- ^ Wang Q, Zhang H, Guerrette S, Chen J, Mazurek A, Wilson T, Slupianek A, Skorski T, Fishel R, Greene MI (august 2001). "Adenosine nucleotide modulates the physical interaction between hMSH2 and BRCA1". Oncogene. 20 (34): 4640–9. doi:10.1038/sj.onc.1204625. PMID 11498787.
- ^ Sharan SK, Morimatsu M, Albrecht U, Lim DS, Regel E, Dinh C, Sands A, Eichele G, Hasty P, Bradley A (april 1997). "Embryonic lethality and radiation hypersensitivity mediated by Rad51 in mice lacking Brca2". Nature. 386 (6627): 804–10. doi:10.1038/386804a0. hdl:11858/00-001M-0000-0010-5059-F. PMID 9126738.
- ^ Lin HR, Ting NS, Qin J, Lee WH (septembar 2003). "M phase-specific phosphorylation of BRCA2 by Polo-like kinase 1 correlates with the dissociation of the BRCA2-P/CAF complex". The Journal of Biological Chemistry. 278 (38): 35979–87. doi:10.1074/jbc.M210659200. PMID 12815053.
- ^ Yu DS, Sonoda E, Takeda S, Huang CL, Pellegrini L, Blundell TL, Venkitaraman AR (oktobar 2003). "Dynamic control of Rad51 recombinase by self-association and interaction with BRCA2". Molecular Cell. 12 (4): 1029–41. doi:10.1016/s1097-2765(03)00394-0. PMID 14580352.
- ^ Chen PL, Chen CF, Chen Y, Xiao J, Sharp ZD, Lee WH (april 1998). "The BRC repeats in BRCA2 are critical for RAD51 binding and resistance to methyl methanesulfonate treatment". Proceedings of the National Academy of Sciences of the United States of America. 95 (9): 5287–92. doi:10.1073/pnas.95.9.5287. PMC 20253. PMID 9560268.
- ^ Sarkisian CJ, Master SR, Huber LJ, Ha SI, Chodosh LA (oktobar 2001). "Analysis of murine Brca2 reveals conservation of protein-protein interactions but differences in nuclear localization signals". The Journal of Biological Chemistry. 276 (40): 37640–8. doi:10.1074/jbc.M106281200. PMID 11477095.
- ^ Wong AK, Pero R, Ormonde PA, Tavtigian SV, Bartel PL (decembar 1997). "RAD51 interacts with the evolutionarily conserved BRC motifs in the human breast cancer susceptibility gene brca2". The Journal of Biological Chemistry. 272 (51): 31941–4. doi:10.1074/jbc.272.51.31941. PMID 9405383.
- ^ Katagiri T, Saito H, Shinohara A, Ogawa H, Kamada N, Nakamura Y, Miki Y (mart 1998). "Multiple possible sites of BRCA2 interacting with DNA repair protein RAD51". Genes, Chromosomes & Cancer. 21 (3): 217–22. doi:10.1002/(SICI)1098-2264(199803)21:3<217::AID-GCC5>3.0.CO;2-2. PMID 9523196.
- ^ Tarsounas M, Davies AA, West SC (januar 2004). "RAD51 localization and activation following DNA damage". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 359 (1441): 87–93. doi:10.1098/rstb.2003.1368. PMC 1693300. PMID 15065660.
- ^ Liu J, Yuan Y, Huan J, Shen Z (januar 2001). "Inhibition of breast and brain cancer cell growth by BCCIPalpha, an evolutionarily conserved nuclear protein that interacts with BRCA2". Oncogene. 20 (3): 336–45. doi:10.1038/sj.onc.1204098. PMID 11313963.
- ^ Marmorstein LY, Ouchi T, Aaronson SA (novembar 1998). "The BRCA2 gene product functionally interacts with p53 and RAD51". Proceedings of the National Academy of Sciences of the United States of America. 95 (23): 13869–74. doi:10.1073/pnas.95.23.13869. PMC 24938. PMID 9811893.
- ^ Wu L, Davies SL, Levitt NC, Hickson ID (juni 2001). "Potential role for the BLM helicase in recombinational repair via a conserved interaction with RAD51". The Journal of Biological Chemistry. 276 (22): 19375–81. doi:10.1074/jbc.M009471200. PMID 11278509.
- ^ Masson JY, Davies AA, Hajibagheri N, Van Dyck E, Benson FE, Stasiak AZ, Stasiak A, West SC (novembar 1999). "The meiosis-specific recombinase hDmc1 forms ring structures and interacts with hRad51". The EMBO Journal. 18 (22): 6552–60. doi:10.1093/emboj/18.22.6552. PMC 1171718. PMID 10562567.
- ^ Sigurdsson S, Van Komen S, Petukhova G, Sung P (novembar 2002). "Homologous DNA pairing by human recombination factors Rad51 and Rad54". The Journal of Biological Chemistry. 277 (45): 42790–4. doi:10.1074/jbc.M208004200. PMID 12205100.
- ^ Stürzbecher HW, Donzelmann B, Henning W, Knippschild U, Buchhop S (april 1996). "p53 is linked directly to homologous recombination processes via RAD51/RecA protein interaction". The EMBO Journal. 15 (8): 1992–2002. doi:10.1002/j.1460-2075.1996.tb00550.x. PMC 450118. PMID 8617246.
- ^ Buchhop S, Gibson MK, Wang XW, Wagner P, Stürzbecher HW, Harris CC (oktobar 1997). "Interaction of p53 with the human Rad51 protein". Nucleic Acids Research. 25 (19): 3868–74. doi:10.1093/nar/25.19.3868. PMC 146972. PMID 9380510.
- ^ Tanaka K, Hiramoto T, Fukuda T, Miyagawa K (august 2000). "A novel human rad54 homologue, Rad54B, associates with Rad51". The Journal of Biological Chemistry. 275 (34): 26316–21. doi:10.1074/jbc.M910306199. PMID 10851248.
- ^ Kovalenko OV, Plug AW, Haaf T, Gonda DK, Ashley T, Ward DC, Radding CM, Golub EI (april 1996). "Mammalian ubiquitin-conjugating enzyme Ubc9 interacts with Rad51 recombination protein and localizes in synaptonemal complexes". Proceedings of the National Academy of Sciences of the United States of America. 93 (7): 2958–63. doi:10.1073/pnas.93.7.2958. PMC 39742. PMID 8610150.
- ^ Shen Z, Pardington-Purtymun PE, Comeaux JC, Moyzis RK, Chen DJ (oktobar 1996). "Associations of UBE2I with RAD52, UBL1, p53, and RAD51 proteins in a yeast two-hybrid system" (PDF). Genomics. 37 (2): 183–6. doi:10.1006/geno.1996.0540. PMID 8921390.
Vanjski linkovi[uredi | uredi izvor]
- RAD51 Protein na US National Library of Medicine Medical Subject Headings (MeSH)